MIR-122对乙型肝炎病毒抗原表达的影响
朱 蕾,陈 智,陈建忠,王 静,胡中荣,陈离伟,刘荣华,胡敏君,朱海红
(1.浙江大学医学院附属第一医院传染病诊治国家重点实验室,浙江杭州310003;2.浙江大学免疫研究所,浙江杭州310058)
在我国,乙型肝炎病毒(HBV)相关性肝细胞肝癌(hepatocellular carcinoma,HCC)发病率、死亡率均排名于疾病谱前列,严重危害人民健康[1-3]。近来,许多研究表明宿主和某些病毒都可以编码微小 RNA(microRNA,miRNA),在调控病毒生命周期及病毒与宿主相互作用的过程中起到非常关键的作用[4-7]。
人类miR-122是一种肝脏特异性表达的微小RNA,约占肝脏总miRNA的70%。它位于人第 18 号染色体上的,定位于 18q21.31[8]。近来研究表明,miR-122不仅与丙型肝炎的复制相关[10],而且在肝细胞肝癌组织中以及所有的肝细胞肝癌衍生的细胞系中表达下调[9-10]。为了探索miR-122和HBV致病机制的关系,我们利用体外稳定表达HBV的HepG2.2.15细胞模型,利用合成的miRNA和反义技术调控细胞miR-122水平,探索miR-122水平和HBV表达之间的关系。
1 材料与方法
1.1 材料 HepG2.2.15细胞为本所常规传代保 存。LipofectamineTM2000、Opti-MEM I reduced serum medium、Trizol均购自美国Invitrogen公司。G418购自美国Hyclone公司。RNase Inhibitor、 MultiScribeTMReverse Transcriptase、dNTPs、10 × Reverse Transcription Buffer、Nuclease-free water、RT primer、TaqMan 2×Universal PCR Master Mix、No AmpErase UNG均购自美国 Applied Biosystems公司。HBV DNA定量试剂盒购自杭州博康有限公司。
hsa-miR-122由上海吉凯基因化学技术有限公司合成,锁核酸修饰的LNA-anti-miR122由美国Sigma公司合成,anti-miR-122由北京奥科生物技术有限责任公司合成,anti-GFP由北京奥科生物技术有限责任公司合成,其设计如下:

1.2 方法
1.2.1 瞬时转染HepG2.2.15细胞并分组培养 常规培养HepG2.2.15细胞于含10%胎牛血清、G418 600 μg/ml的 DMEM 完全培养液中。转染前1天将细胞以1×105∕孔细胞接种于12孔培养板,待细胞融合率达到80% ~90%,用优化培养基(Opti-MEM I reduced serum medium)清洗2次,按照 LipofectamineTM2000说明书进行转染。设:hsa-miR-122组、anti-GFP组、anti-miR122组和LNA anti-miR122组,其终浓度分别为 400 nmol/L、400 nmol/L、400 nmol/L和40 nmol/L。转染5 h后,将培养基更换为含10%胎牛血清和600 μg/ml G418的DMEM培养基,继续培养。转染24 h收集上清,转染48 h后收集上清和细胞。
1.2.2 时间分辨免疫荧光法检测HBsAg和HBeAg含量 收集转染24 h和48 h后各组HepG2.2.15细胞培养上清,时间分辨免疫荧光法检测HBsAg和HBeAg含量。检测方法按照试剂盒说明书。
1.2.3 定量PCR检测HBV-DNA含量 收集转染24 h和48 h后各组HepG2.2.15细胞培养上清,荧光定量 PCR法检测上清中 HBV DNA含量,检测病毒最低限值为500 copies/ml。操作方法按照试剂盒说明书。
1.2.4 荧光定量PCR检测各组miR-122含量
转染后48 h收集细胞,提取细胞总RNA,操作按照美国Invitrogen公司Trizol试剂说明书。逆转录合成 cDNA按照 TaqManⓇMicroRNA Assays中说明书进行 RNA逆转录。0.15 μl 100 mmol/L dNTPs,1 μl MultiScribeTMReverse Transcriptase,1.50 μl 10 × Reverse Transcription Buffer,0.19 μlRNase Inhibitor,4.16 μl Nuclease-free water,5 μl 总 RNA,3 μl RT primer,混合均匀。16℃水浴 30 min,42℃水浴30 min,85℃水浴5 min,终止反应,4℃冷却,-20℃冻存备用。参照 TaqManⓇMicroRNA Assays说明书,PCR反应体系:TaqManⓇ2×Universal PCR Master Mix(No AmpEraseⓇUNG)10.00 μl,TaqManⓇMicroRNA Assays 20 ×TaqManⓇAssay 1.00 μl,RT Product 1.33 μl,Nuclease Free Water 7.67 μl,一共 20 μl。使用Applied Biosystems 7500 Real-time PCR 仪,95℃预变性 10 min,95℃变性 15 s,60℃退火/延伸60 s,共40个循环。
1.2.5 统计学处理 所有数据均采用SPSS 15.0统计软件包统计,计量资料各组数据均采用“均数士标准差”(±s)来表示,多组间比较采用单因素方差分析(One-Way ANOVA),有显著差异时作两两比较的q检验,最后再作显著性P检验。
2 结果
2.1 转染后HepG2.2.15细胞miR-122相对表达 转染48 h后,实时荧光定量PCR检测各组HepG2.2.15细胞miR-122相对表达:anti-miR-122组、LNA-antimiR-122组miR-122表达明显受抑制,显著低于阴性对照组(P<0.001)。hsa-miR-122组miR-122表达较阴性对照组升高,有显著性差异(P<0.001)。见图1。

图1 转染48 h后HepG2.2.15细胞miR-122相对表达量Fig.1 Relative expression level of miR-122 in HepG2.2.15 cells 48 h post-trans-fection
2.2 转染后HepG2.2.15细胞上清中HBsAg与HBeAg的表达 转染24 h及48 h后,anti-miR-122组与 LNA-antimiR-122组 HBsAg表达均无差异(P=1.000)。hsa-miR-122组HBsAg表达均显著低于阴性对照组(P<0.01)和anti-miR-122组、LNA-antimiR-122组(P<0.001)。anti-miR-122组、LNA-antimiR-122组HBsAg表达均显著高于阴性对照组(P<0.001)。见图2A。
转染24 h及48 h后,anti-miR-122组与LNA-antimiR-122组HBeAg表达均无差异(P=1.000)。hsa-miR-122组HBeAg表达均显著低于阴性对照组(P<0.01)和 anti-miR-122组、LNA-antimiR-122组(P<0.001)。anti-miR-122组、LNA-antimiR-122组HBeAg表达均显著高于阴性对照组(P<0.001)。见图2B。
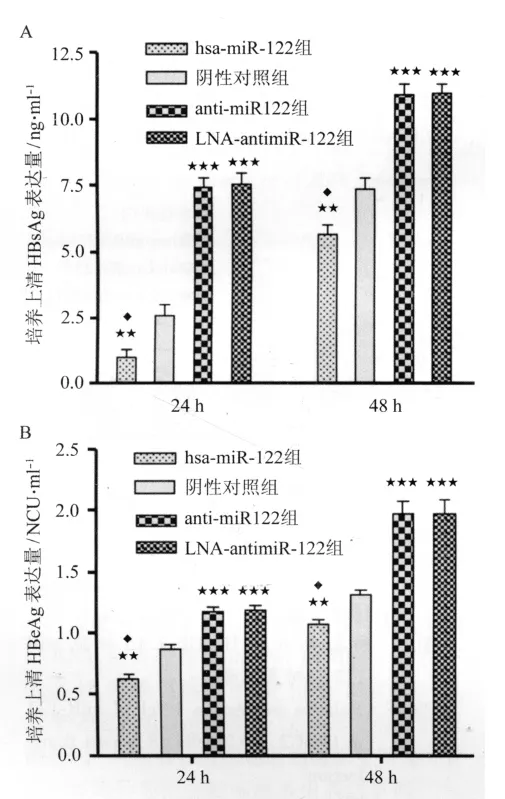
图2 转染24 h及48 h后HepG2.2.15细胞上清中HBsAg与HBeAg的表达Fig.2 Expression level of HBsAg and HBeAg in the supernatant24 h and 48 h post-transfection
2.3 转染后HepG2.2.15细胞上清中HBV DNA的表达 转染24 h与48 h后各组HBV DNA表达与阴性对照组比较无统计学意义(P>0.05)。
3 讨论
miR-122是肝脏特异性表达的miRNA,约占肝脏miRNAs表达的70%。这种调节肝脏发育的“肝特异性miRNA”,在肝脏的发育和分化及维持肝脏正常功能中发挥重要的作用。而应用反义寡聚核苷酸使miR-122失活后,出现肝脏功能受损、胆固醇合成降低,提示miR-122不仅参与肝脏分化的调节,还在维持肝脏正常功能中起着重要作用[11]。
Jopling等[10]发现,人类肝脏特异性的miR-122通过靶向结合HCV mRNA 5'非编码区并与之相互作用诱发病毒复制,是一种正调控基因表达的方式。miR-122可以与丙肝病毒基因组相互作用调节丙型肝炎病毒的表达,当miR-122被灭活,丙型肝炎病毒复制水平明显降低。
HepG2.2.15细胞是体外研究HBV复制较为理想的细胞模型[12]。它来源于 HepG2细胞,整合了ayw型HBV全基因组,能够部分模拟HBV的生活周期,这一细胞系可以成功表达HBV的全部病毒标志,包括HBV DNA、HBsAg、HBeAg、HBcAg、HBVDNAp 等,而且还能产生大量的复制中间体,与自然状态的病毒颗粒一样具有感染性,且更接近于人体肝细胞内环境的实际情况,被研究者广泛应用于HBV复制的研究。我们实验选用HepG2.2.15细胞为研究对象,为miRNA与HBV自然感染的临床应用研究提供更加客观的依据。
本研究为了探索miR-122这个肝脏特异性丰富表达的miRNA是否也与HBV复制相关,设计体外转染 HepG2.2.15细胞,调控细胞miR-122水平,观察转染不同时间内细胞分泌HBeAg和HBsAg及HBV DNA复制情况,并通过荧光定量PCR方法检测各组miR-122的含量,进一步探索miR-122和HBV表达之间的关系。我们发现miR-122与HBsAg、HBeAg的表达呈负相关,抑制细胞内miR-122水平,HBsAg与HBeAg的表达增加,上调细胞内miR-122水平,HBsAg与HBeAg的表达降低。目前已有研究表明,miR-122在大多数原发性肝癌中以及原发性肝癌衍生的细胞系中是下调的。且研究表明,HBeAg与HBsAg均阳性的HBV患者患原发性肝癌的危险率上升[13-14]。这些有可能表明HBeAg与HBsAg,miR-122与HBV相关原发性肝癌之间存在一些调控机制。miR-122的下调促进原发性肝癌的发生发展,促进HBV高表达 HBeAg与 HBsAg。而持续的 HBeAg与HBsAg高表达,更加促进了HBV患者肝脏的炎症反应及加速HBV相关肝癌的发生进程。
我们的研究发现,miR-122与HBV DNA复制无明显相关性,但miR-122可以降低HBV蛋白的表达,从某种角度上说明miR-122参与调节HBV的转录和复制。miR-122如何通过调节靶基因,继而调节 HBV表达 HBeAg与HBsAg的机制,还需进一步探索。
[1]MERICAN I,GUAN R,AMARAPUKA D,et al.Chronic hepatitis B virus infection in Asian countries[J].J Gastroenterol Hepatol,2000,15:1356-1361.
[2]TANG Z Y.Hepatocellular carcinoma-cause,treatment and metastasis[J].World J Gastroenterol,2001,7:445-454.
[3]LUO R H,ZHAO Z X,ZHOU X Y,et al.Risk factors for primary liver carcinoma in Chinese population [J].World J Gastroenterol,2005,11:4431-4434.
[4]LANCASTER A M,JOPLING C L,LEMON S M,et al.Modulation of hepatitis C virus RNA abundance by a liver-specific microRNA [J].Science,2005,309:1577-1581.
[5]LECELLIER C H,DUNOYER P,ARAR K,et al.A cellular microRNA mediates antiviral defense in human cells[J].Science,2005,308:557-560.
[6]GUPTA A,GARTNER J J,SETHUPATHY P,et al.Anti-apoptotic function of a microRNA encoded by theHSV-1 latency-associated transcript [J].Nature,2006,442:82-85.
[7]SULLIVAN C S,GRUNDHOFF A T,TEVETHIA S,et al.SV40-encoded microRNAs regulate viral gene expression and reduce susceptibility to cytotoxic T cells[J].Nature,2005,435:682-686.
[8]JOPLING C L,NORMAN K L,SARNOW P,et al.Positive and negative modulation ofviraland cellular mRNAs by liver-specific microRNA miR-122 [J].Cold Spring Harb Symp Quant Biol,2006,71:369-376.
[9]KUTAY H,BAI S,DATTA J,et al.Downregulation of miR-122 in the rodent and human hepatocellular carcinomas[J].J Cell Biochem,2006,99:671 678.
[10]MENG F,HENSON R,WEHBE-JANEK H,et al.MicroRNA-21 regulates expression of the PTEN tumor suppressor gene in human hepatocellular cancer[J].Gastroenterology,2007,133:647 658.
[11]CHANG J,NICOLAS E,MARKS D,et al.miR-122,amammalian liverspecificmicroRNA,is processed from hcr mRNA and may downregulate the high affinity cationic amino acid transporter CAT-1 [J].RNA Biol,2004,1:106-113.
[12]SELLS M A,CHEN M L,ACS G,et al.Production of hepatitis B virus particles in Hep G2cells transfected with cloned hepatitis B virus DNA[J].Proc Natl Acad Sci USA,1987,84:1005-1009.
[13]LIN T M,CHEN C J,LU S N,et al.Hepatitis B virus e antigen and primary hepatocellular carcinoma [J].Anticancer Res,1991,11(6):2063-2065.
[14]SJOGREN M H,DUSHEIKO G M,KEW M C,et al.Hepatitis B virus infection and hepatocellular carcinoma:correlation between IgM antibody to hepatitis B core antigen,hepatitis B e antigen,and hepatitis B DNA [J].Am J Trop Med Hyg,1988,39(6):582-585.

