阴离子脂质体-阳离子脂质体复合物介导的基因转染
孙 霁,陈 琰,鲁 莹,钟延强(第二军医大学药学院,上海 200433)
作为非病毒基因载体之一,阳离子脂质体由于其较高的基因携载能力和细胞摄取率而受到青睐。但由于阳离子脂质体表面带有大量正电荷,血循环中容易与体环境中的聚阴离子发生反应,从而引起较大的细胞毒性[1~3]。本实验尝试利用包封质粒(plasmid,pDNA)的阳离子脂质体与阴离子脂质体形成复合物,转染HepG2细胞[4],考察细胞毒性,从而为双脂质体复合物用于基因治疗奠定实验基础。
1 材料与仪器
1.1 实验材料 3β-[N-(N',N'-二甲氨基乙基)]氨甲酰基-胆固醇(DC-Chol)(美国Avanti Polar Lipids公司),二油酰磷脂酰乙醇胺(DOPE)(德国Lipoid公司),胆甾醇半琥珀酸酯(CHEMS)(美国Sigma公司),无血清培养基 MEM(美国 Hyclone公司),磷酸盐缓冲液(PBS)(美国Hyclone公司),胎牛血清(美国GIBCO公司),4-羟乙基哌嗪乙磺酸(HEPES)粉末(美国Sigma公司),pGPH1/GFP/Neo质粒(上海吉玛制药),HepG2细胞(中科院上海生命科学研究院细胞资源中心)。
1.2 仪器 R系列旋转蒸发器(上海申生科技有限公司),LF-1薄膜挤出器(加拿大Avestin公司),Zeta Sizer Nano ZS激光粒度分析仪(英国Malvern公司),XW-80型涡旋混合器(上海第一医学仪器厂),FA1004万分之一天平(上海天平仪器厂),凝胶成像仪(上海复日科技有限公司)。
1 方法
2.1 阳离子脂质体制备 精密称取适量脂质体膜材料(3β-[N-(N',N'-二甲氨基乙基)]氨甲酰基-胆固醇、二油酰磷脂酰乙醇胺),按摩尔比1∶1混合后溶于适量氯仿中,将该溶液加入到梨形烧瓶,充氮气3次,减压旋蒸12 h除去氯仿,得到干燥脂质薄膜。加入一定体积的4-羟乙基哌嗪乙磺酸缓冲液(20 mM,pH7.4),缓缓震摇,将脂质薄膜从瓶壁洗下,得到脂质体混悬液,使充分水合后,通过薄膜挤出器分别通过400、200、100 nm聚碳酸酯膜,各10遍,即得阳离子脂质体。
2.2 阴离子脂质体制备 精密称取适量脂质体膜材料(胆甾醇半琥珀酸酯、二油酰磷脂酰乙醇胺),按摩尔比4∶6混合后溶于适量氯仿中,将该溶液加入到梨形烧瓶,充氮气3次,减压旋蒸除去氯仿,真空维持12 h,得到干燥的脂质薄膜,加入以一定体积的20 mMHEPES缓冲液(pH7.4),缓缓震摇,将脂质薄膜从瓶壁洗下,得到脂质体混悬液,使充分水合后,通过薄膜挤出器分别通过400、200、100 nm聚碳酸酯膜,各10遍,即得阴离子脂质体。
2.3 pDNA/阳离子脂质体的制备 取1 μg质粒用HEPES缓冲液稀释至20 μl,静置5 min。取一定体积的阳离子脂质体,用缓冲液稀释至20 μl,静置5 min。然后两者混合,静置25 min按材料中正电荷与质粒负电荷比为4(n/p=4)的要求制备pDNA/阳离子脂质体。
2.4 阴离子脂质体-阳离子脂质体复合物的制备取一定体积阴离子脂质体,用HEPES缓冲液稀释至20 μl,与“2.3”中制备的pDNA/阳离子脂质体涡旋滴加复合,静置25 min。按照不同正负电荷比(+/- =1/0.5,1/1,1/1.5,1/2,1/2.5,1/3)的要求,制备阴离子脂质体-阳离子脂质体复合物。
2.5 复合物的表征 取10 μl正负电荷比为1/1的复合物于云母片上,在扫描频率为1 Hz,扫描范围为2.5 μm ×2.5 μm 的条件下进行原子力扫描,观察复合物形态特征。
2.6 凝胶阻滞实验 称取适量琼脂糖,加入约100 ml电泳缓冲液,加热溶解,配制1.0%琼脂糖凝胶溶液,室温冷却至约60℃,加入5 μl溴化乙锭溶液(500 μg/ml)插入 DNA染色,灌胶。将“2.4”中制备的复合物加入孔道中,在缓冲液中以80 V电压泳动50 min后,用全自动紫外与可见分析装置进行观察。
2.7 复合物zeta电位测定 分别取“2.4”中制备的复合物50 μl用去离子水稀释至1 ml后加入样品池进行测量,每个样品重复测量3次。
2.8 细胞转染 取肝癌HepG2细胞在含有10%胎牛血清、非必需氨基酸的培养液中连续培养(5%CO2、37℃培养箱)。取对数生长期细胞,胰酶消化后用MEM培养基稀释,按每孔2×105个细胞接种于24孔培养板,孵箱内(5%CO2、37℃培养箱)预培养24 h。细胞培养24 h后,弃去培养基,将“2.4”中制备的复合物依次加入培养孔中,37℃孵育5~6 h后,吸去培养基,用PBS洗两遍后每孔加入等体积含血清培养基。培养48 h后用胰蛋白酶消化成单细胞,重悬于PBS中,流式细胞仪检测GFP阳性细胞的百分率。
2.9 细胞毒性实验 细胞培养24 h后,将“2.4”中制备的复合物加入96板孔中,5%CO2,37℃条件下连续培养48 h。每孔加入20 μl溴化四唑蓝(MTT)溶液(5 mg/ml,即0.5%MTT),继续培养4 h。终止培养,小心吸去孔内培养液。每孔加入150 μl二甲基亚砜,置摇床上低速振荡10 min,使结晶物充分溶解。在酶联免疫OD490 nm处测量各孔的吸光值。每组设复孔3个。
3 结果
3.1 复合物zeta电位 zeta电位可以用来衡量微粒体系表面带电情况,阴离子脂质体-阳离子脂质体复合物的zeta电位明显低于阳离子脂质体的zeta电位,说明阴离子脂质体的加入能有效降低复合物的表面电位。刚加入阴离子脂质体时,其复合物zeta电位下降趋势明显;随着阴离子脂质体加入量不断越多,其复合物zeta电位下降趋势平缓。结果见图1。
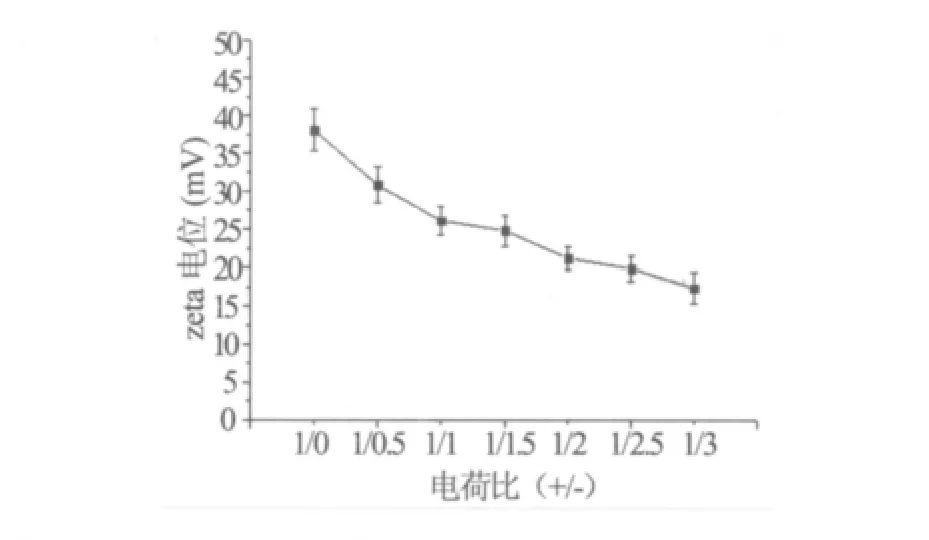
图1 不同处方复合物的zeta电位
3.2 原子力扫描图 从图2可看出复合物呈圆球形,粒径在200~300 nm。

图2 复合物的原子力扫描图
3.3 质粒包封情况 阳离子脂质体能中和核酸的负电荷,因此当阳离子脂质体/DNA复合物形成后,核酸在琼脂糖凝胶中的泳动能力大大减少甚至丧失,在紫外灯下无法观察到白色亮条带。阴离子脂质体-阳离子脂质体复合物的质粒包封情况见图3。由图3可知,未被载体包裹的裸质粒DNA在紫外灯下可见白色亮条带,仅被阳离子脂质体包裹的质粒DNA未见白色亮条带,而被不同阴离子脂质体-阳离子脂质体复合物包裹的质粒DNA也均未见白色条带。说明与阳离子脂质体一样,阴离子脂质体-阳离子脂质体复合物可以将质粒完全包裹。

图3 不同比例复合物的质粒包封情况
3.4 转染效率测定 转染效率高低是衡量基因载体的重要指标之一,良好的基因载体应具有较高的转染效率。如图4所示,复合物的转染效率均没有阳离子脂质体(电荷比(+/-)=1/0)转染效率高,其中正负电荷比为1/0.5的复合物转染效率与阳离子脂质体的转染效率最接近;随着复合物中阴离子脂质体比例的增加,转染效率呈下降趋势,表明阴离子脂质体的加入对转染效率有一定影响。

图4 不同处方复合物的转染效率
3.5 细胞毒性实验 理想的基因载体除了要有较高的转染效率外,还应具有良好的生物相容性,对细胞的毒性相对较低。如果载体的细胞毒性过大,就可能会降低其转染效率,从而影响目的基因的表达。如图5所示,复合物的细胞毒性均小于阳离子脂质体(电荷比(+/-)=1/0)的细胞毒性,说明阴离子脂质体的加入能一定程度上降低细胞毒性;复合物正负电荷比为1/1.5~1/2.0范围时,细胞成活率最高;随着阴离子脂质体的加入量不断增大,其细胞成活率呈下降趋势。
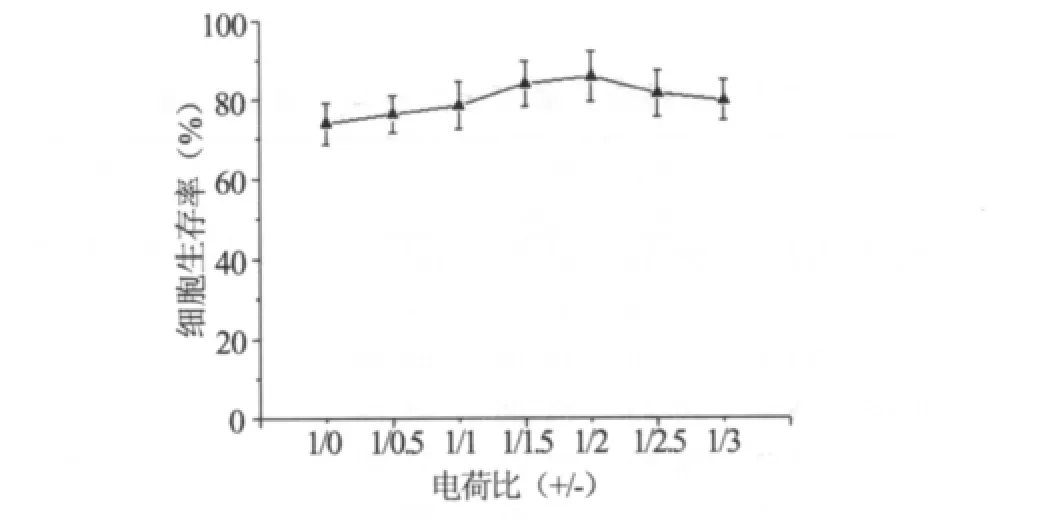
图5 不同处方复合物的细胞生存率
4 讨论
阳离子是目前公认的转染效率较高的非病毒载体之一,而且由于其表面带有大量正电荷,因此产生较大的细胞毒性。本实验在阳离子脂质体中加入一定量的阴离子脂质体,有效降低了阳离子脂质体表面电荷量。通过凝胶阻滞实验发现,阴离子的加入并没有影响阳离子脂质体对质粒的携载能力,质粒仍完全包封在阳离子脂质体中。
实验结果显示阴离子脂质体对阳离子脂质体的转染效率有一定降低作用,这是由于复合物的表面电荷没有单纯阳离子脂质体的高,影响了粒子与细胞膜的结合能力[5],从而降低了转染效率。但是,正是由于复合物表面的低电荷,使得其细胞毒性小于阳离子脂质体;当然,阴离子脂质体本身也会产生一定的细胞毒性,因此,复合物正负电荷比在某一范围时呈现出最小的细胞毒性,随着阴离子脂质体比例继续增加,复合物的毒性增大。
本实验结果还表明,与阴离子脂质体复合后使阳离子脂质体的细胞毒性降低,同时双脂质体复合物能保持质粒的包封以及对HepG2肝癌细胞的转染,为阳离子结构改造提供新的可行性。
[1]Marika R,Markku T,Urtti A.Cell-surface glycosaminoglycans inhibited cation-mediated gene transfer[J].J Gene Med,2004,6(4):405.
[2]Reinisalo M,Ruponen A,Urtti A.Polyplex-mediated gene transfer and cell cycle:effect of carrier on cellular uptake and intracellular kinetics and significance of glycosaminoglycans[J].J.Gene Med,2007,9(6):479.
[3]Charudharshini S,Diane B.Optimization and characterization of anionic lipoplexes for gene delivery[J].J.Controlled Release,2009,136(1):62.
[4]Mignet N,Richard C,Scherman D,et al.Anionic pH-sensitive pegylated lipoplexes to deliver DNA to tumors[J].Int J Pharm,2008,361(1-2):194.
[5]Julia Lehtinen,et al.Glycosaminoglycan-resistant and pH-sensitive lipid-coated DNA complexes produced by detergent removal method[J].J.Controlled Release,2008,131(2):145.

