抗生育活性天然产物研究进展
祁晶晶 ,郑灿辉,吕加国(第二军医大学药学院药物化学教研室,上海 200433)
在世界各地丰富的药用动植物资源中,许多植物的提取物具有抗生育活性,如芸香[1]、番木瓜[2]、雷公藤、棉酚[3]等。但提取物成分复杂、种类繁多,生理活性多种多样,导致抗生育作用选择性差,促使人们进一步去寻找具有抗生育活性的有效单体。近年来,研究者从大量的动植物中分离得到了具有抗生育活性的萜类、生物碱类、黄酮类化合物单体,笔者就其抗生育活性研究做一简要综述。
1 萜类化合物
萜类化合物是指具有(C5H8)n通式以及其含氧的不同饱和程度的衍生物,是由异戊二烯或异戊烷以各种方式连结而成的一类天然化合物,而其中具有抗生育活性的萜类化合物主要包括三萜类、二萜类、环状倍半萜等。
1.1 三萜类 Mi-saponin A(MSA,分子结构式见图1)是从紫荆木属(Madhuca latifolia)种子中分离得到的三萜皂苷成分,该物质具有强大的杀精子作用,杀精子浓度为500 μg/ml,作用效果优于壬苯醇醚(N-9)。药理研究发现MSA能增强精子质膜的脂质过氧化作用,导致精子质膜以及顶体囊泡的结构和功能发生蜕变。体外阴道角膜细胞和子宫颈内皮细胞毒性研究发现MSA的安全指数比N-9高8倍多[4],可作为阴道避孕剂而进一步研发。
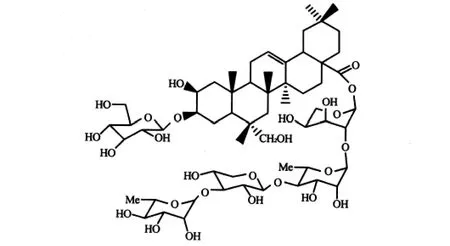
图1
bivittoside D(分子结构式见图2)是从斐济白尼参属中分离得到的羊毛甾烷型三萜类化合物[5]。其体外杀精子效果比N-9强2倍多,离体活体染色和低渗肿胀实验发现该化合物能增强精子细胞膜的通透性,融化精子质膜使其失去活性,产生避孕作用,此外该化合物对阴道乳酸菌无显著影响[6],可作为表面活性剂类杀精子剂进行研发。

图2
羽扇醇乙酸酯(lupeol acetate,分子结构式见图3)是从夹竹桃科黑板树中提取分离得到的三萜物质。研究发现雄性小鼠连续口服羽扇醇乙酸酯20 d[10 mg/(kg·d)],睾丸、附睾、精囊和前列腺等生殖器官重量减轻,与对照组相比睾丸、附中精子数量显著减少,可100%抑制雄性生育能力[7]。
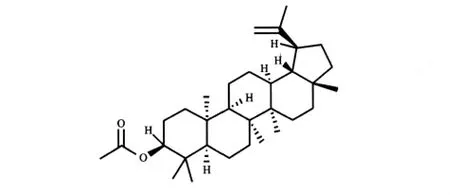
图3
demethylzeylasteral(分子结构式见图4)和celastrol(分子结构式见图5)是从雷公藤粉末中分离得到的2个三萜类成分[8],研究发现这两类物质具有显著的抗生育活性[9],其作用机制主要是与钙离子有关。钙离子内流对精卵结合、顶体反应、精子运动等具有显著的作用[10],demethylzeylasteral和celastrol均能抑制生精细胞的钙离子通道,影响精子的顶体反应,阻止精子向卵细胞中注入DNA,影响整个受精过程,实现避孕作用[11]。

图4

图5
黄体细胞能合成并分泌与生育有关的甾体激素,该类甾体激素对孕卵着床及早孕的维持有着重要的作用,Wang等[12]研究发现抗早孕药物的主要机制之一是抑制黄体细胞活性。有研究者从麦蓝菜(Vaccaria segetalis)种子中分离得到了两个具有抗黄体细胞活性的单体化合物segetosideF[13]和segetosideB(分子结构式见图6)[14]。segetosideB 是天然产物中首次报道的具有抗黄体细胞生长活性的三萜皂苷类物质,可作为抗早孕药物进行研发。
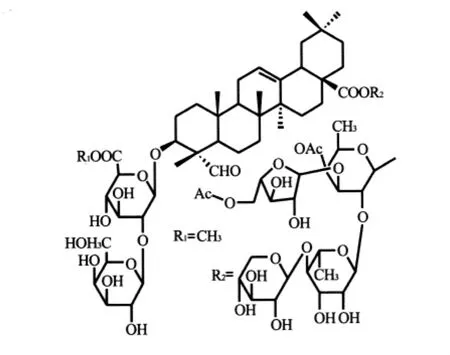
图6
1.2 二萜类化合物 azorellanone(C20H32O2)(分子结构式见图7)是从智利北部安第斯山脉的一种灌木(Azorella yareta Hauman)中提取得到的环状二萜类化合物。研究发现不同浓度的该化合物与去能精子共同孵育15 min,0.015~1.5 mM即可抑制精子运动、阻制精子与卵透明带的结合,并降低孕酮诱导的顶体反应发生率。此外该化合物可有效的减少细胞内的钙离子浓度,并且能够抑制胰蛋白酶和胰凝乳蛋白酶的活性,因此该化合物和孕酮联合使用就可以降低孕酮导致的细胞内钙离子浓度增加的作用[15],可作为一种新结构类型避孕化合物进行研究开发。
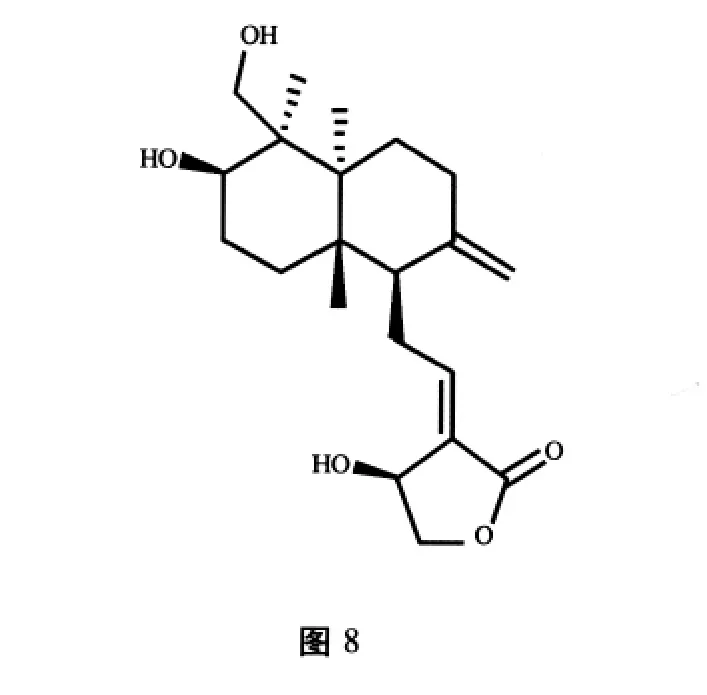
穿心莲叶中分离得到的二萜类单体化合物穿心莲内酯(分子结构式见图 8),具有抗炎[16]、抗HIV[17]、抗糖尿病[18]、抗癌[19]、抗生育[20]等多种药理活性。Wistar雄性大鼠连续口服穿心莲内酯48 d后,精子数目明显减少,精子无活动性,生精管上皮细胞完全脱落,精子分化受到限制。其作用机制是通过影响生精细胞的胞质分裂从而阻止精子发生,产生抗生育活性[21]。

土荆皮乙酸(分子结构式见图9)是上世纪80年代从松科植物金钱松的根皮中分离得到的二萜酸,具有抗生育活性,大鼠、家兔口服该物质均能产生明显的抗早孕作用[22],其抗早孕的有效剂量能使妊娠大鼠的蜕膜细胞变性,导致出血和坏死,50 μg/ml对培养的人蜕皮细胞有杀伤作用[23],可作为抗早孕类药物的先导化合物。

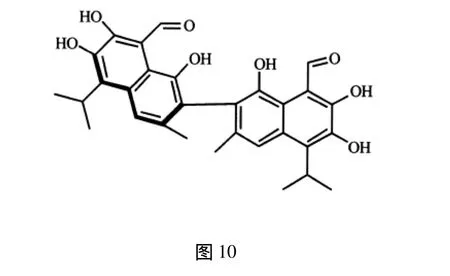
1.3 环状倍半萜 棉酚是锦葵科植物草棉、树棉或陆地棉成熟种子、根皮中提取的一种多元酚类物质,存在2个对映异构体,每个异构体具有不同的生理活性,其中左旋棉酚(分子结构式见图10)显示出较好的抗生育活性[24],其作用机制主要是造成精子的数量减少,活力降低,睾丸组织中NO水平上升,血清中的睾酮下降,损伤睾丸组织内的多种细胞[25],从而显示出较强的抗生育活性。但由于左旋棉酚对人类以及啮齿动物具有较强的毒性[26],长期服用会产生低钾血症和永久性无精子症,因此只能作为抗生育的先导化合物。
2 生物碱类
生物碱是存在于自然界中的一类含氮的碱性有机化合物,许多天然产物中提取的生物碱成分都具有抗生育活性,如雷公藤总生物碱[27]、苦参碱、鸭嘴花碱[28]等。最近西伯利亚大学的研究者们发现番木瓜种子中的生物碱成分能抑制卵细胞受精、减少精子数量并诱导睾丸细胞损伤,具有可逆的雄性抗生育作用[29]。此外印度中央药物研究中心从红果樫木根(Dysoxylum binectariferum)中提取的生物碱成分具有较好的抗生育作用,其有效单体是rohitukine(C16H19NO5)。研究发现兔子口服rohitukine(分子结构式见图11)10 mg/kg、1~7 d就能阻止怀孕,该化合物的抗生育作用可能是由于结构中C-3',C-5和C-7取代基的空间构象与雌激素受体的活性中心发生相互作用而产生的[30]。

3 黄酮类
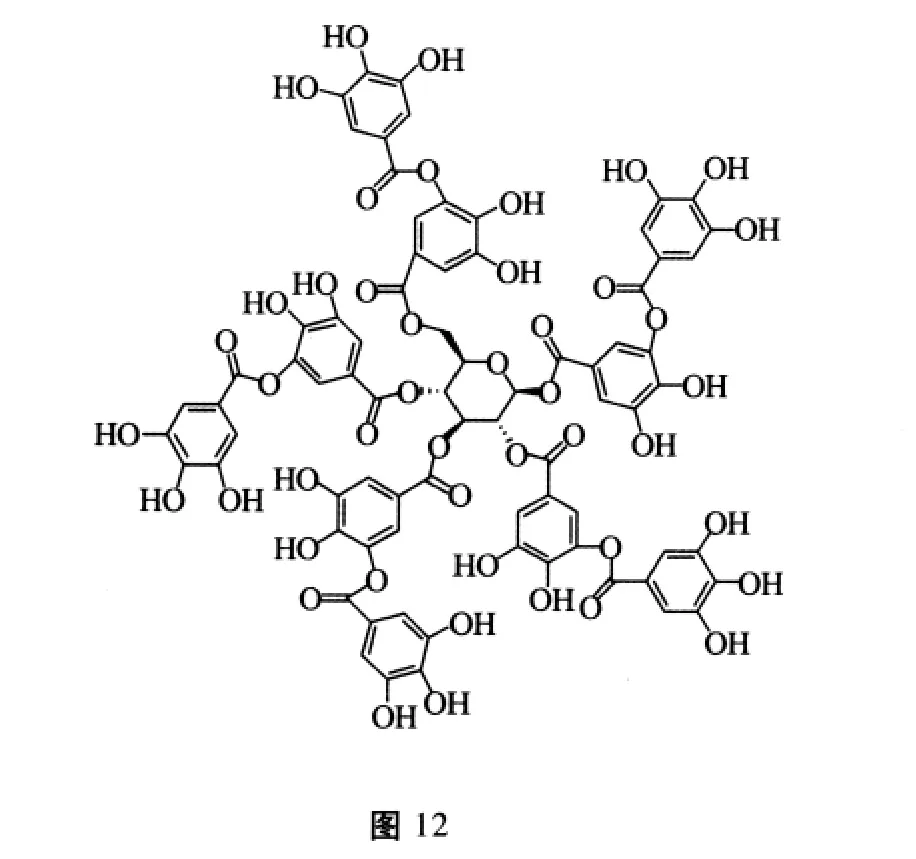
黄酮类化合物是广泛存在于植物界的一大类多酚类化合物,多以苷类形式存在,也有一部分以游离形式存在。最新研究发现黄酮类成分较多的诃子植物具有抗精子生成的活性[31],雄性小鼠口服该物质乙醇提取物100 mg/(kg·d)、60 d后发现小鼠精子数量及活力显著降低,附睾中的精子发生畸变,完全丧失了生育能力。Taitzoglou等[32]研究发现黄酮类化合物鞣酸(分子结构式见图12)具有抑制顶体酶活性、干扰精子与卵细胞的受精过程,实现抗生育作用。此外Shivayogi等[33]研究发现独脚金中的两个黄酮类物质,芹菜素和木犀草素(分子结构式见图13和14),研究表明口服这两类化合物会干扰小鼠体内的雌激素水平,并对受孕小鼠有显著的抗着床活性,从而产生抗生育作用。


4 展望
天然产物为抗生育药物研究提供了丰富的资源,近年来从天然产物中寻找具有高效、选择性好的抗生育活性成分是计划生育药物研究的热点之一,但是很多抗生育有效成分的鉴定和作用机制是目前研究中面临的主要问题。本文总结了天然产物中具有抗生育活性的萜类、生物碱类、黄酮类化合物的作用机制,为寻找理想的抗生育药物提供线索。此外,研究者以具有抗生育活性的单体化合物为先导物,进行结构优化,设计新型、方便、高效、可逆的抗生育药物,这将大大减少药物研发的时间和成本,其意义重大。
[1]Sailani MR,Moeini H.Effect of ruta graveolens and cannabis sativa alcoholic extract on spermatogenesis in the adult wistar male rats[J].Indian J Urol,2007 ,23(3):257.
[2]Lohiya NK,Manivannan B,Mishra PK,et al.Chloroform extract of carica papaya seeds induces long-term reversible azoospermia in langur monkey[J].Asian J Androl,2002 ,4(1):17.
[3]Gershenzon J,Dudareva N.The function of terpene natural products in the natural world[J].Nat Chem Biol,2007 ,3(7):408.
[4]Saha P,Majumdar S,Pal D,et al.Evaluation ofspermicidal activity of Mi-Saponin A[J].Reprod Sci,2010 ,17(5):454.
[5]Vijay L,Saxena A,Pandey K,et al.Isolation of bivittoside D from sea cucumber and activity thereof[P].US,2005/0208147 A1 ,2005-09-22.
[6]Lakshmi V,Saxena A,Mishra SK,et al.Spermicidal activity of bivittoside D from bohadschia vitiensis[J].Arch Med Res ,2008 ,39(7):631.
[7]Gupta RS,Bhatnager AK,Joshi YC,et al.Induction of antifertility with lupeol acetate in male albino rats[J].Pharmacology ,2005 ,75(2):57.
[8]Duan HQ,Takaishi Y,Momota H,et al.Triterpenoids from tripterygium wilfordii[J].Phytochemistry ,2000 ,53(7):805.
[9]Xu RS,Fidler JM,Musser JH.Bioactive compounds from tripterygium wilfordii[J].Stud Nat Prod Chem ,2005 ,32(12):773.
[10]DarszonA,Labarca P,Nishigaki T,et al.Ion channels in sperm physiology[J].Physiol Rev,1999 ,79:481.
[11]Bai JP,Shi YL,Fang X,et al.Effects of demethylzeylasteral and celastrol on spermatogenic cell Ca2+channels and progesterone-induced sperm acrosome reaction[J].Eur J Pharmacol ,2003 ,464(1):9.
[12]Wang HY,Zou QD,Li XL.Effect of traditional Chinese medicine on the growth and invasion of human first trimester cytotrophoblasts[J].R & C ,2008 ,19(2):73.
[13]Sang SM,Lao AN,Leng Y,et al.Segetoside F a new triterpenoid saponin with inhibition of luteal cell from the seeds of vac-caria segetalis[J].Tetrahedron Lett,2000 ,25:9205.
[14]Sang SM,Lao AN,Leng Y,et al.A new triterpenoid saponin with inhibition of luteal cell from the seeds of vaccaria segetalis[J].J Asian Nat Prod Res,2002 ,4(4):297.
[15]Patricio M,Milene K,Eduardo P,et al.Effect of azorellanone,a diterpene from azorella yareta hauman,on human sperm physiology[J].J Androl,2003 ,24(3):364.
[16]Shen YC,Chen CF,Chiou WF.Andrographolide prevents oxygen radical production by human neutrophils:possible mechanism(s)involved in its anti- inflammatory effect[J].Br J Pharmacol,2002 ,135(2):399.
[17]Reddy VL,Reddy SM,Ravikanth V,et al.A new bis-andrographolide ether from Andrographis paniculata nees and evaluation of anti-HIV activity[J].Nat Prod Res,2005 ,19(3):223.
[18]Zhang ZJ,Jiang J,Yu P,et al.Hypoglycemic and beta cell protective effects of andrographolide analogue for diabetes treatment[J].J Transl Med,2009,7:62.
[19]Shi MD,Lin HH,Lee YC,et al.Inhibition of cell-cycle progression in human colorectal carcinoma Lovo cells by andrographolide[J].Chem Biol Interact,2008 ,174(13):201.
[20]Kumar S,Naskar S,Hazra A,et al.Evaluation of spermicidal potential of labdane diterpenes from Andrographis paniculata[J].Int J Biochem ,2009,3(4):221.
[21]Akbarsha MA,Murugaian P.Aspects of the male reproductive toxicity/male antifertility property of andrographolide in albino rats:effect on thetestis and the cauda epididymidal spermatozoa[J].Phytotherapy Research,2000,14(6):432.
[22]王伟成,陈荣发,赵世兴,等.土槿皮乙酸的抗生育作用[J]中国药理学报,1982,3(3):185.
[23]陈浩洪,顾芝萍,游根娣,等.人蜕皮细胞培养作为抗早孕药物筛选模型的研究[J].上海铁道大学学报,1998,19(11):1.
[24]Matlin SA,Zhou R,Bialy G,et al.(-)-Gossypol:an active male antifertility agent[J].Contraception ,1985 ,31:141.
[25]楚世峰,王玉珠,郑里翔,等.棉酚造成大鼠精子质量下降与NO之间关系的研究[J].中国药理学通报,2008,24(11):1518.
[26]Stipanovic RD,Puckhaber LS,Bell AA,et al.Occurrence of(+)-and(-)-gossypol in wild species of cotton and in Gossypium hirsutum Var.mariegalante(Watt)Hutchinson[J].J Agric Food Chem ,2005,53(16):6266.
[27]OuYang XK,Jin MC,He CH.Simultaneous determination of four sesquiterpene alkaloids in tripterygium wilfordii Hook.F.extracts by high-performance liquid chromatography[J].Phytochem Anal,2007 ,18(4):320.
[28]Yuvaraj G,Vijayalakshmi M,Sandeep G.et al.Antifertility Activity of the ethanolic extract of cassia occidentalis,derris brevipes variety brevipes and justicia simplex[J].World J Chem ,2009 ,4(2):118.
[29]Udoh FV,Udoh PB,Umoh EE.Activity of alkaloid extract of carica papaya seeds on reproductive functions in male wistar rats[J].Pharm Biol,2005 ,43(6):563.
[30]Keshri G,Oberoi RM,Lakshmi V,et al.Contraceptive and hormonal properties of the stem bark of dysoxylum binectariferum in rat and docking analysis of rohitukine,the alkaloid isolated from active chloroform soluble fraction[J].Contraception ,2007 ,76:400.
[31]Srivastav A,Chandra A,Singh M,et al.Inhibition of hyaluronidase activity of human and rat spermatozoa in vitro and antispermatogenic activity in rats in vivo by terminalia chebula,a flavonoid rich plant[J].Reproductive Toxicology ,2010 ,29(2):214.
[32]Taitzoglou IA,Tsantarliotou M,Zervos I,et al.Inhibition of human and ovine acrosomal enzymes by tannic acid in vitro[J].J Reprod Fertil,2001,121(1):131.
[33]Shivayogi PH,Shrishailappa B,Shanmukhaswamy KH,et al.Antifertility and hormonal properties of flavones of Striga orobanchioides[J].Eur J Pharmacol,2000 ,391(1-2):193.

