小鼠对雨蛙肽诱发急性胰腺炎易感性的品系差异*
张化宇, 唐 寅, 常 青, 刘 璐,王宇辉, 蒋孟茜, 韩迎春, 祁 荣△, 刘国庆△
(北京大学1心血管研究所,2分子心血管学教育部重点实验室,3病理学系,北京 100191)
急性胰腺炎(acute pancreatitis,AP)是由于胰腺分泌的消化酶自我消化胰腺及其周围组织而导致的严重的急性炎症反应,并可能继发一系列的多器官功能障碍,是临床上危急重症中较难治疗的疾病之一[1]。
雨蛙肽(caerulein)是胆囊收缩素(cholecystokinin,CCK)的类似物,小鼠腹腔过量给予雨蛙肽刺激,可以引起类似于人类急性胰腺炎疾病时的生化及病理生理改变。因此,雨蛙肽诱导的急性胰腺炎小鼠模型对临床研究急性胰腺炎的发病机制、病理过程、诊断及药物干预治疗效果等方面有重要意义[2,3]。近年来,用于雨蛙肽诱导的急性胰腺炎模型小鼠的品系主要涉及 C57BL/6J[4,5]、BALB/c[6,7]和 ICR[8,9]3种。然而,多项研究报告有不同的结果,表明不同品系的小鼠对雨蛙肽诱发的胰腺炎可能有不同的敏感性,但目前尚缺乏对这种品系间差异的系统研究。而实际上,小鼠品系的差别在疾病模型制备中是非常重要的。动脉硬化[10-12]、肥胖和糖尿病[13,14]等均如此。本研究以血液生化学、胰腺病理学和胰腺炎性因子表达水平为指标,研究C57BL/6J、BALB/c和ICR 3种不同品系的小鼠对雨蛙肽诱导的急性胰腺炎易感性的差异。
材料和方法
1 动物
2月龄雌性C57BL/6J、BALB/c和ICR小鼠,体重约20 g,由北京大学医学部实验动物部提供。所有小鼠均在12 h光照、12 h黑暗的标准周期下,于无菌设备中饲养,自由进食及饮水。实验方案经北京大学医学部实验动物伦理管理委员会批准。
2 主要试剂
Caerulein和DEPC购自 Sigma。α淀粉酶和脂肪酶测定试剂盒购自北京中生北控生物科技股份有限公司。动物组织总RNA Trizol提取液购自北京鼎国昌盛生物技术有限公司。Reverse Transcript Kit购自Fermentas。引物由北京奥科鼎盛生物科技有限公司合成。
3 主要方法
3.1 急性胰腺炎小鼠模型 C57BL/6J、BALB/c和ICR 3种品系的小鼠各12只,随机分为2组,即实验组(n=6)与对照组(n=6)。各组小鼠自由饮水条件下禁食12 h。实验组小鼠腹腔注射caerulein的生理盐水溶液(50 μg/kg),每小时1次,连续注射7次。对照组小鼠同法腹腔注射生理盐水。于第1次腹腔注射后的 0、3、6、9、12、24 h,对各组小鼠分别进行眶静脉取血,肝素抗凝,离心分离血浆,试剂盒测定血浆淀粉酶和脂肪酶活性。第1次注射24 h后处死小鼠,取胰腺组织,分别用于病理学及炎症因子表达的研究。
3.2 胰腺组织病理学评分 对24 h取得的各组小鼠胰腺组织进行福尔马林缓冲液固定、石蜡包埋和切片。切片进行 HE染色。按照病理学评分标准[15,16](表 1),对各胰腺组织的切片进行双人、双盲的病理评分。对评分结果进行统计学分析。
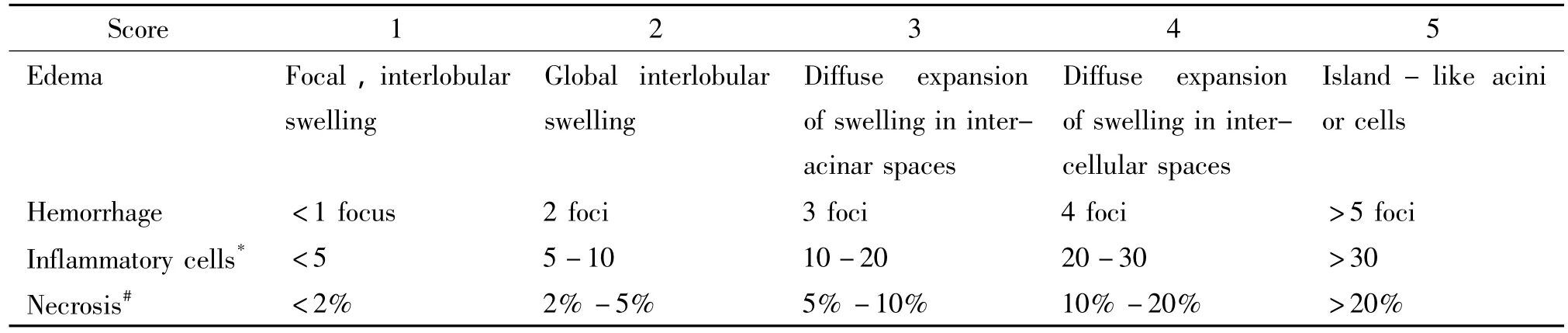
表1 胰腺炎症损伤病理评分标准Table 1.The standards of pathological scoring to the injury extent of pancreas
3.3 胰腺组织炎症因子表达测定 取小鼠胰腺组织约50 mg,于2 mL RNA Trizol提取液中匀浆,提取胰腺组织总RNA。利用Fermentas Reverse Transcript试剂盒将总RNA反转录,获得cDNA。实时定量PCR(real-time quantitative PCR)测定各胰腺组织中的 IL-1、IL-6、IL-10、TNF-α 和TGF-β1炎症因子mRNA表达水平。每个样品重复3次,并以SYBR Green作为荧光剂,结果以18S rRNA的表达水平标准化。
4 统计学处理
结 果
1 血浆淀粉酶和脂肪酶的变化
实验组和对照组小鼠在诱导急性胰腺炎的0、3、6、9、12和24 h的血浆淀粉酶和脂肪酶活性见图1。与对照组正常小鼠相比,实验组小鼠在雨蛙肽诱导急性胰腺炎后,其血浆淀粉酶和脂肪酶水平均有明显升高,并在9-12h达到峰值。3种品系的实验组小鼠在诱导急性胰腺炎后,BALB/c和ICR小鼠的血浆淀粉酶水平较C57BL/6J小鼠有更显著的升高,见图1A;BALB/c小鼠的脂肪酶峰值水平显著高于C57BL/6J和ICR小鼠,见图1B。以上结果表明,BALB/c和ICR小鼠在雨蛙肽诱导急性胰腺炎后,其血浆生化学指标(淀粉酶和脂肪酶)较C57BL/6J小鼠有更显著的改变。
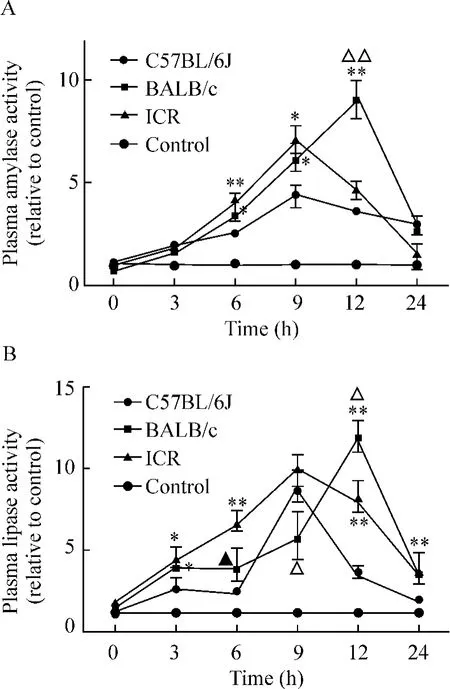
Figure 1.Plasma α - amylase and lipase activity of C57BL/6J,BALB/c and ICR mice.BALB/c and ICR mice showed more dramatic increase of plasma α-amylase activity(A)and lipase activity(B)than those in C57BL/6J mice.*P <0.05,**P <0.01 vs C57BL/6J mice;△P <0.05,△△P <0.01 vs ICR mice.图1 C57BL/6J、BALB/c和ICR小鼠血浆淀粉酶和脂肪酶的活性测定
2 胰腺病理学变化
3种品系小鼠的胰腺病理切片见图2。与对照组相比,实验组小鼠的胰腺均有明显的水肿改变。胰腺组织显示小叶间隙增宽、结构紊乱,腺泡细胞局限性或广泛性坏死,小叶间及坏死灶内均有大量炎性细胞浸润,见图2A;而对照组小鼠胰腺形态学结构完好,无炎症改变,见图2A。

Figure 2.Morphology and pathological scores of pancreatic tissues.A:HE staining of the pancreatic tissues(×200,scale bar 100 μm)from control and AP - induced groups of each mouse strain.Compared with the integrated and normal morphology in control groups,representative sections from AP-induced groups showed obvious pathological changes.B:pathological severity evaluation of the pancreatic tissues in terms of edema,inflammation cells,hemorrhage and necrosis.Pathological scoring was determined according to the standards described in Table 1.C:total pathological scores of the pancreatic tissues from each mouse strain.Compared with BALB/c and ICR mice,the pancreata of C57BL/6J mice showed milder pathological changes after AP induction.*P < 0.05,** P <0.01 vs C57BL/6J mice;#P <0.05 vs BALB/c mice.图2 胰腺组织病理形态学研究及病理评分
对C57BL/6J、BALB/c和ICR实验组小鼠的胰腺切片进行病理评分,结果显示,BALB/c小鼠胰腺的炎症细胞浸润在3种品系的小鼠中最为严重,见图2B;BALB/c和ICR小鼠胰腺的水肿程度显著高于C57BL/6J小鼠,见图2B。对水肿、坏死、炎细胞浸润和出血4个指标进行总评分,C57BL/6J小鼠的病理总评分显著低于BALB/c和ICR小鼠,见图2C。结果表明,在雨蛙肽诱导急性胰腺炎情况下,C57BL/6J小鼠胰腺病理形态学的改变较BALB/c和ICR小鼠更轻。
3 胰腺组织炎症因子mRNA表达水平的定量比较
我们对3种品系的实验组小鼠胰腺组织中的炎症因子IL-1β、IL-6、IL-10、TNF-α 和 TGF-β1mRNA的表达水平进行定量分析,以评估其胰腺局部炎症的严重程度。结果如图3所示:ICR小鼠胰腺组织中的促炎因子IL-1β表达显著高于C57BL/6J和BALB/c小鼠,见图3A;TNF-α表达水平从高到低分别为ICR>BALB/c>C57BL/6J,见图3D;IL-6、TGF-β1以及炎症抑制因子IL-10表达水平在3种品系的小鼠间无显著差异,见图3B-E。结果表明,在雨蛙肽诱导的急性胰腺炎的病程中,C57BL/6J小鼠的炎症因子表达水平较ICR和BALB/c小鼠低。
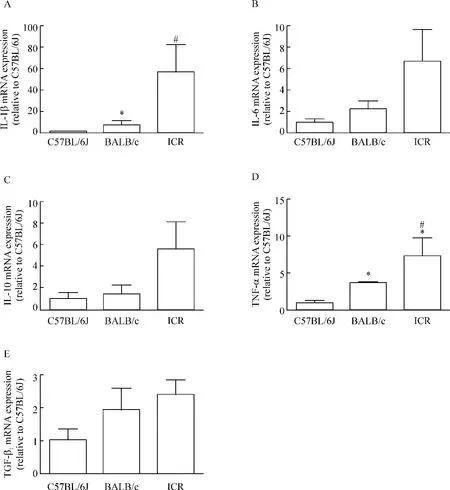
Figure 3.The expression of inflammatory factors in pancreatic tissues after AP induction.Total RNA was isolated from 50 mg pancreatic tissues,and the expression of IL-1β,IL-6,IL-10,TNF-α and TGF-β1was quantified by real-time PCR with SYBR Green.The results were normalized by‘housekeeping’18S rRNA.The expression of IL-1β and TNF-α in the pancreata of ICR mice was more higher than that in BALB/c and C57 BL/6J mice,and BALB/c mice also showed higher TNF - α expression than C57BL/6J mice.*P <0.05 vs C57BL/6J;#P <0.05 vs BALB/c mice.图3 胰腺组织炎症因子表达水平
讨 论
急性胰腺炎是临床危重病症之一,但在疾病的诊断和治疗上仍缺乏有效手段。目前,血浆淀粉酶和脂肪酶水平仍是临床上常用的诊断胰腺炎及其严重程度的特异性指标;胰腺的病理形态学改变也为胰腺炎的诊断和治疗提供更为直接有力的证据。
本研究通过采用雨蛙肽对 C57BL/6J、BALB/c和ICR 3种不同品系的小鼠诱导急性胰腺炎,表明小鼠品系的差异对急性胰腺炎造模效果有明显影响。其中,BALB/c小鼠的血浆酶学指标、胰腺病理学改变及TNF-α表达水平方面显著高于C57BL/6J小鼠;而ICR小鼠在急性胰腺炎诱导中的血浆淀粉酶水平和IL-1β、TNF-α表达水平显著高于C57BL/6J小鼠。因此,与其它 2种品系的小鼠相比,C57BL/6J小鼠在急性期血浆胰腺酶学指标、胰腺病理学改变及胰腺组织炎症因子表达水平上,都显示了对雨蛙肽诱导的急性胰腺炎较低的敏感性。
正是基于对急性胰腺炎小鼠模型的研究,人们对急性胰腺炎的病理改变特征和炎症因子表达上调、氧自由基损伤及钙离子内流异常等机制方面有了更深入的了解。我们的研究将为急性胰腺炎疾病的临床诊断、治疗和研究提供帮助。
此外,对于急性胰腺炎易感因素及其机制的研究还有赖于基因修饰小鼠。在建立基因修饰小鼠模型时,小鼠品系的选择也至关重要。常用于代谢实验研究的C57BL/6J小鼠,因其对雨蛙肽诱发的胰腺炎易感性较低,可用于研究胰腺炎的促进因子;而BALB/c、ICR小鼠的高易感性,将对研究胰腺炎的保护因素有价值。我们的研究结果将为急性胰腺炎研究中基因修饰小鼠的模型建立时如何选择合适的小鼠品系提供理论支持。
[1]田 雨.急性胰腺炎的临床表现[J].中国社区医师,2009,25(2):8-9.
[2]李全生,陈晓理,周总光,等.雨蛙素腹腔注射法建立小鼠急性坏死性胰腺炎模型的实验研究[J].中国普外基础与临床杂志,2004,11(4):335-337.
[3]吕 帅,冯佳燕,高志荣,等.LPS和雨蛙肽诱导大鼠离体胰腺组织损伤并抑制HSP60蛋白的变化[J].中国病理生理杂志,2010,26(6):1146 -1150.
[4]Sans MD,DiMagno MJ,D'Alecy LG,et al.Caeruleininduced acute pancreatitis inhibits protein synthesis through effects on eIF2B and eIF4F[J].Am J PhysiolGastrointest Liver Physiol,2003,285(3):G517 - G528.
[5]Wang Y,Sternfeld L,Yang F,et al.Enhanced susceptibility to pancreatitis in severe hypertriglyceridaemic lipoprotein lipase-deficient mice and agonist-like function of pancreatic lipase in pancreatic cells[J].Gut,2009,58(10):422-430.
[6]Zhong B,Zhou Q,Toivola DM,et al.Organ-specific stress induces mouse pancreatic keratin overexpression in association with NF - κB activation[J].J Cell Sci,2004,117(9):1709-1718.
[7]Bhatia M,Wong FL,Fu D,et al.Role of hydrogen sulfide in acute pancreatitis and associated lung injury[J].FASEB J,2005,19(6):623-625.
[8]李全生,张肇达,陈晓理,等.实验性胰腺炎小鼠小肠隐凹素-4 mRNA表达变化的研究[J].四川大学学报(医学版),2003,34(1):92-94.
[9]Chao KC,Chao KF,Chuang CC,et al.Blockade of interleukin 6 accelerates acinar cell apoptosis and attenuates experimental acute pancreatitis in vivo[J].Br J Surg,2006,93(3):332-338.
[10]Deschepper CF,Olson JL,Otis M,et al.Characterization of blood pressure and morphological traits in cardiovascular-related organs in 13 different inbred mouse strains[J].J Appl Physiol,2004,97(1):369 -376.
[11]Brown MD,Jin L,Jien ML,et al.Lipid retention in the arterial wall of two mouse strains with different atherosclerosis susceptibility[J].J Lipid Res,2004,45(6):1155-1161.
[12]Tian J,Pei H,James JC,et al.Circulating adhesion molecules in apoE-deficient mouse strains with different atherosclerosis susceptibility[J].Biochem Biophys Res Commun,2005,329(3):1102-1107.
[13]Funkat A,Massa CM,Jovanovska V,et al.Metabolic adaptations of three inbred strains of mice(C57BL/6,DBA/2,and 129T2)in response to a high - fat diet[J].J Nutr,2004,134(12):3264 -3269.
[14]Karasawa H,Takaishi K,Kumagae Y.Obesity-induced diabetes in mouse strains treated with gold thioglucose:a novel animal model for studying β - cell dysfunction[J].Obesity,2011,19(3):514-521.
[15]Schmidt J,Lewandrowsi K,Warshaw AL,et al.Morphometric characteristics and homogeneity of a new model of acute pancreatitis in the rat[J].Int J Pancreatol,1992,12(1):41-51.
[16]Grewal HP,Mohey el Din A,Gaber L,et al.Amelioration of the physiologic and biochemical changes of acute pancreatitis using an anti-TNF-α polyclonal antibody[J].Am J Surg,1994,167(1):214 -219.

