氨甲酰化促红细胞生成素抗大鼠慢性心力衰竭的实验研究
,志禄
(1兰州大学第一临床医学院,兰州 730000;2兰州大学第一医院;3保定市第二医院)
近年许多研究表明促红细胞生成素(EPO)具有心、脑、肾、视网膜等组织器官保护作用,EPO的衍生物氨甲酰化促红细胞生成素(CEPO)同样具有组织保护作用,且无造血功能,因而大大降低了高血压、血栓形成等风险的发生率,但其是否具有抗慢性心力衰竭(CHF)的作用尚未见报道。2010年3~4月,我们建立大鼠CHF模型,予以CEPO干预,通过观察血流动力学、血清诱生型一氧化氮合酶(iNOS)及超氧化物歧化酶(SOD)等指标,探讨其是否具有抗CHF的作用及其可能的机制,为防治CHF提供新的思路。
1 材料与方法
1.1 实验动物 健康雄性清洁级Wistar大鼠90只,购自兰州大学医学实验动物中心,体质量(200±20)g。室内单独分笼常规饲料喂养,自由饮用紫外线消毒自来水,给予标准照明及通风条件。
1.2 主要试剂、药品 NOS(分型)测定试剂盒、SOD测定试剂盒(南京建成科技有限公司),盐酸异丙肾上腺素注射液(ISO,上海禾丰药业有限公司),CEPO(Warren Pharmaceuticals公司)。
1.3 实验分组、造模及给药 随机选取12只大鼠作为对照组,剩余78只腹腔注射 ISO 5 mg/kg,1次/d,连续3 d造模[1],对照组同期腹腔注射等量生理盐水。喂养5周后,造模大鼠死亡11只。其中腹腔注射ISO 后第1、2、3天分别死亡5、3、2只,其后喂养期间死亡1只;对照组大鼠无死亡。对存活大鼠进行造模成功判定,以左室舒张末压(LVEDP)≥15 mmHg提示CHF模型构建成功[2]。剔除造模失败、术中意外死亡及术后死亡大鼠,共有24只大鼠造模成功,随机再分为干预组(n=12)及心衰组(n=12)。干预组腹腔注射 CEPO 50 μg/kg[3],2 次/周,持续4周[4],心衰组及对照组同期腹腔注射等量生理盐水,干预4周后进行实验指标的测定。CEPO干预期间,干预组大鼠无死亡,心衰组大鼠死亡1只,死因可能为心衰加重,对照组大鼠死亡1只,经解剖检验死因为肠粘连。腹腔注射时均注意回抽,避免入血管、膀胱及肠管。
1.4 检测指标 干预4周后,于最后1次给药后禁食水12 h,称重,穿刺右侧颈总动脉,并置入内含0.1%肝素、直径1 mm、末端带有微压力传感器的聚乙烯导管,连接BL-410S生物机能实验系统,记录血流动力学指标,包括心率(HR)、LVEDP、左室内压峰值(LVSP)、左室内压上升/下降最大速率(±dp/dtmax)。血流动力学指标测定完成后,于右侧颈总动脉插管处留取血样本2 ml置于抗凝管中,室温静置15 min后,于常温下3 000 r/min离心10 min,留取上清液,置入-70℃冰箱备用。按试剂盒说明检测血清iNOS、SOD水平。
1.5 统计学方法 采用SPSS17.0软件进行数据分析,计量资料以±s表示,采用一维方差分析。以P≤0.05为有统计学差异。
2 结果
2.1 一般情况 实验全程对照组大鼠饮食正常、行动自如、毛色光泽,心衰组及干预组大鼠先后出现精神不振、活动懒散、进食减少及毛枯无泽、散乱竖起等心力衰竭症状,严重者还出现脱毛、口唇及足趾发绀、行走不稳等症状。但干预组大鼠CEPO干预后心衰症状较心衰组有所改善。
2.2 血流动力学变化 见表1。
表1 各组大鼠血流动力学指标比较(±s)
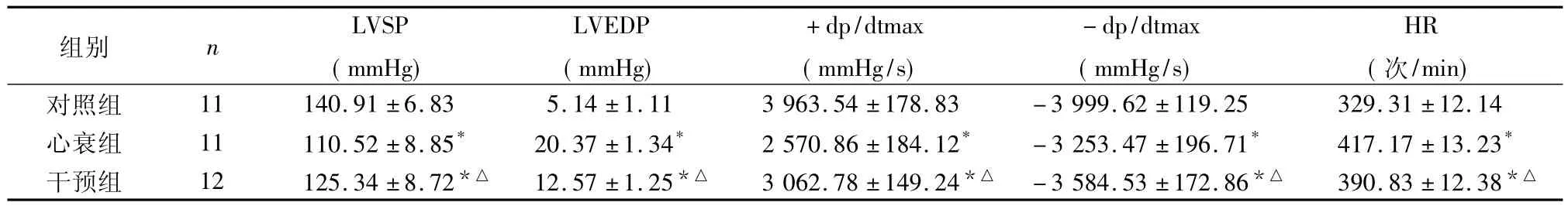
表1 各组大鼠血流动力学指标比较(±s)
注:与对照组比较,*P <0.05;与心衰组比较,△P <0.05
组别 n LVSP(mmHg)LVEDP(mmHg)+dp/dtmax(mmHg/s)-dp/dtmax(mmHg/s)HR(次/min)对照组 11 140.91±6.83 5.14±1.11 3 963.54±178.83 -3 999.62 ±119.25 329.31 ±12.14心衰组 11 110.52 ±8.85* 20.37 ±1.34* 2 570.86 ±184.12* -3 253.47 ±196.71* 417.17 ±13.23*干预组 12 125.34 ±8.72*△ 12.57 ±1.25*△ 3 062.78 ±149.24*△ -3 584.53 ±172.86*△ 390.83 ±12.38*△
2.3 血清iNOS及SOD水平测定 与对照组相比,心衰组及干预组血清iNOS水平显著升高(P<0.05),而 SOD 水平显著降低(P <0.05);与心衰组相比,干预组血清iNOS水平显著降低(P<0.05),而SOD水平显著升高(P<0.05)。见表2。
表2 各组大鼠血清iNOS及SOD水平比较(U/ml,±s)

表2 各组大鼠血清iNOS及SOD水平比较(U/ml,±s)
注:与对照组比较,*P <0.05;与心衰组比较,△P <0.05
组别 n iNOS SOD对照组11 8.58 ±0.91 56.80 ±2.62心衰组 11 29.73 ±0.99* 44.16 ±3.88*干预组 12 21.23±1.49*△ 50.96±3.43*△
3 讨论
CHF是多种心血管疾病的最终转归,严重威胁着人类的健康,预后不良,心衰的5年生存率与恶性肿瘤相仿[5]。因此,防治CHF具有非常重要的意义。CHF的病理生理改变十分复杂,其中神经内分泌紊乱和心室重塑是CHF最主要的发病机制,而心肌细胞过度凋亡引起的心肌细胞丢失及氧自由基(OFR)水平过高在CHF的发生、发展过程中起着重要的作用。其中NO除具有血管扩张效应、抗平滑肌细胞增殖、抗血小板聚集和黏附等作用外,还有细胞毒性及作为炎症介质等作用。在体和离体研究发现,低浓度NO能增加心肌收缩力,而高浓度NO则抑制心肌收缩力。NO合成的关键酶一氧化氮合成酶(NOS)分为两型,即原生型一氧化氮合成酶(cNOS)和iNOS。Saito等通过在大鼠急性心肌梗死模型中应用选择性iNOS抑制剂S-methylisothiourea(SMT)证实了iNOS在心脏结构和功能方面的负性作用[6]。cNOS主要参与抑制左室重构及左室功能异常[7]。
CHF时iNOS高度表达,而cNOS降低,NO水平明显增高,高浓度NO可损害线粒体能量代谢、抑制细胞增殖、破坏DNA结构、促进心肌细胞凋亡;另外,NO还具有细胞毒性作用,可以影响细胞代谢,干扰细胞呼吸链和酶的活性,激活使DNA降解的核酶,从而直接启动细胞凋亡,进而恶化CHF。OFR是机体内一类活泼的不稳定基团,可与细胞膜及细胞器膜的多价不饱和脂肪酸发生过氧化反应,导致细胞损伤。在生理情况下OFR产生与消除处于动态平衡。这种平衡一旦被打破,过高的OFR水平将会造成细胞结构和功能的受损,进而导致机体代谢紊乱。尤其是过高的OFR还可以损伤血管内皮细胞,暴露内皮下胶原,吸引血小板黏附、集聚,并使血管舒张因子合成减少、活性减弱,造成血管过度收缩,加速CHF的进程。而SOD是体内清除OFR最主要的酶,其活力的高低间接反映机体清除OFR的能力。
本实验结果表明,CEPO可明显改善CHF大鼠血流动力学指标,升高LVSP及±dp/dtmax并降低LVEDP及HR。因此,CEPO可以改善CHF大鼠心功能。同时,CEPO干预组具有降低血清iNOS水平,升高SOD水平的作用。提示CEPO可能通过抑制过度的NO释放及清除OFR来改善CHF大鼠的心功能,从而发挥其抗CHF作用。本研究为治疗CHF提供了新的干预方法和科学依据,为开发CEPO的新用途奠定了新的理论基础。
[1]Krenek P,Kmecova J,Kucerova D,et al.Isoproterenol-induced heart failure in the rat is associated with nitric oxide-dependent functional alterations of cardiac function [J].Eur J Heart Fail,2009,11(2):140-146.
[2]Tonnessen T,Christensen G,Oie E,et al.Increased cardiac expression of endothelin-1 mRNA in ischemic heart failure in rats[J].Cardiovasc Res,1997,33(3):601-610.
[3]Fiordaliso F,Chimenti S,Staszewsky L,et al.A nonerythropoietic derivative of erythropoietin protects the myocardium from ischemiareperfusion injury[J].Proc Natl Acad Sci U S A,2005,102(6):2046-2051.
[4]Li Y,Takemura G,Okada H,et al.Reduction of inflammatory cytokine expression and oxidative damage by erythropoietin in chronic heart failure[J].Cardiovasc Res,2006,71(4):684-694.
[5]中华医学会心血管病分会,中华心血管病杂志编辑委员会.慢性收缩性心力衰竭治疗建议[J].中华心血管病杂志,2002,30(1):7-23.
[6]Saito T,Hu F,Tayara L,et al.Inhibition of NOS2 prevents cardiac dysfunction in myocardial infarction and congestive heart failure[J].Am J Physiol Heart Circ Physiol,2002,283(1):339-345.
[7]Jones SP,Greer JJ,Van Haperen R,et al.Endothelial nitric oxide synthase over expression attenuates congestive heart failure in mice[J].Proc Natl Acad Sci U S A,2003,100(8):4891-4896.

