用紫外分光光度仪测定总蛋白试剂盒的吸收峰和吸光度
何乐春
重庆医疗器械质量检验中心(重庆市医疗器械质量与安全控制工程技术研究中心),重庆 401121
总蛋白由白蛋白和球蛋白组成,是血浆固体成分中含量最多、组成复杂、功能广泛的一类化合物。总蛋白的检查是主要检测肝功能代谢能力的试验,反映肝脏的储备能力。总蛋白升高往往是由于一种或多种免疫球蛋白增加所引起的,如急性失水、代谢钠丢失、多发性骨髓瘤等;总蛋白降低大多是由于白蛋白的降低所引起,如水钠潴留、长期营养不良、严重结核、甲亢和恶性肿瘤等。因此,临床上检测血清总蛋白及其组分,不仅可作为评价营养状态及消化功能的指标,而且对肝脏疾病、肾脏疾病、出血性疾病和免疫性疾病等的诊断、治疗和预后判断有重要价值。
1 仪器与材料
1.1 仪器
双光束紫外可见分光光度仪(北京普析通用仪器有限公司,型号:TU-1901)、电热恒温度水浴锅。
1.2 材料
选用8个厂家生产的总蛋白测定试剂盒,依次编号为1~8号(表1)。TruLab N复合定值质控血清(正常值)为德赛诊断系统(上海)有限公司生产,批号:12335。
2 方法与结果
2.1 实验原理
双缩脲法:在碱性条件下,蛋白质分子中的肽键与二价铜离子发生双缩脲反应生成紫红色的络合物,其中每个铜离子与5~6个肽键络合,在540~550 nm范围内有最大吸收峰,且呈色强度在一定浓度范围内与肽键数量即蛋白质含量成正比,经与同样处理的蛋白质标准液比较,即可求得蛋白质的含量。该法为临床测定血清总蛋白的首选方法[1-3]。
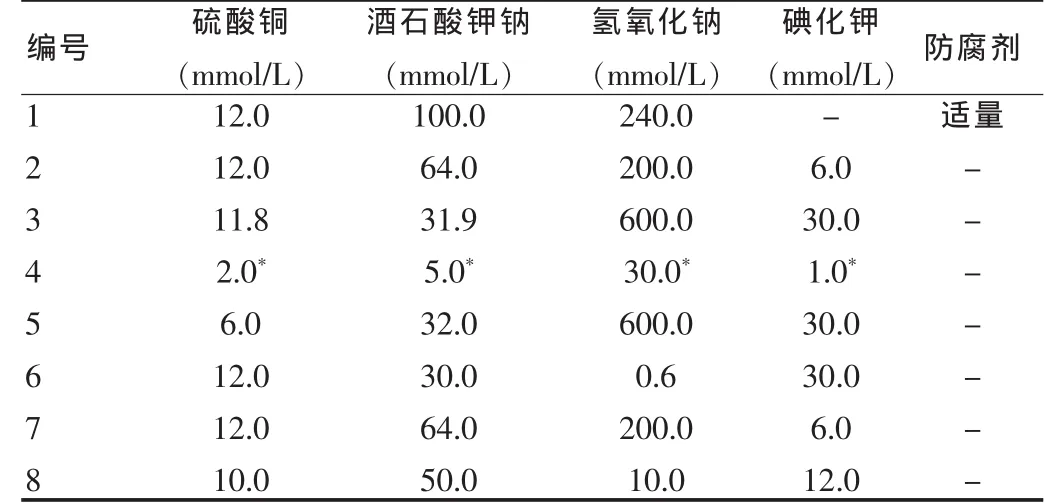
表1 各总蛋白试剂盒主要成分配方
2.2 试验方法
2.2.1 选择8个厂家生产的总蛋白试剂盒,分别按说明书中要求将质控血和相应试剂按一定比例进行加样,然后将所得混合液在紫外分光光度仪上进行扫描,检出相应吸收峰和吸光度(表 2)。
2.2.2 第一次试验扫描时用蒸馏水调零(即用蒸馏水走基线),再用紫外分光光度仪对其混合液进行扫描,连续扫描两次,得出吸收峰及相应吸收度。
2.2.3 第二次试验扫描时用各自厂家生产的试剂调零(即用试剂走基线),再用紫外分光光度仪对其混合液进行扫描,连续扫描两次,得出吸收峰及相应吸收度。
2.2.4 以4号厂家的吸光度为基础,其他7个厂家分别按质控血清∶试剂的比例计算出相应的理论吸光度和误差[4-5]。误差=[(测定值-理论值)/理论值]×100%。

表2 各总蛋白试剂盒的加样量及试验条件
2.3 结果
2.3.1 以蒸馏水调零所得的吸收峰和吸光度:用蒸馏水调零后,对其混合液连续扫描2次,分别得出吸收峰及相应吸光度(表3),吸收峰图谱见图1。

表3 各总蛋白试剂盒的吸收峰和吸光度(以蒸馏水调零)
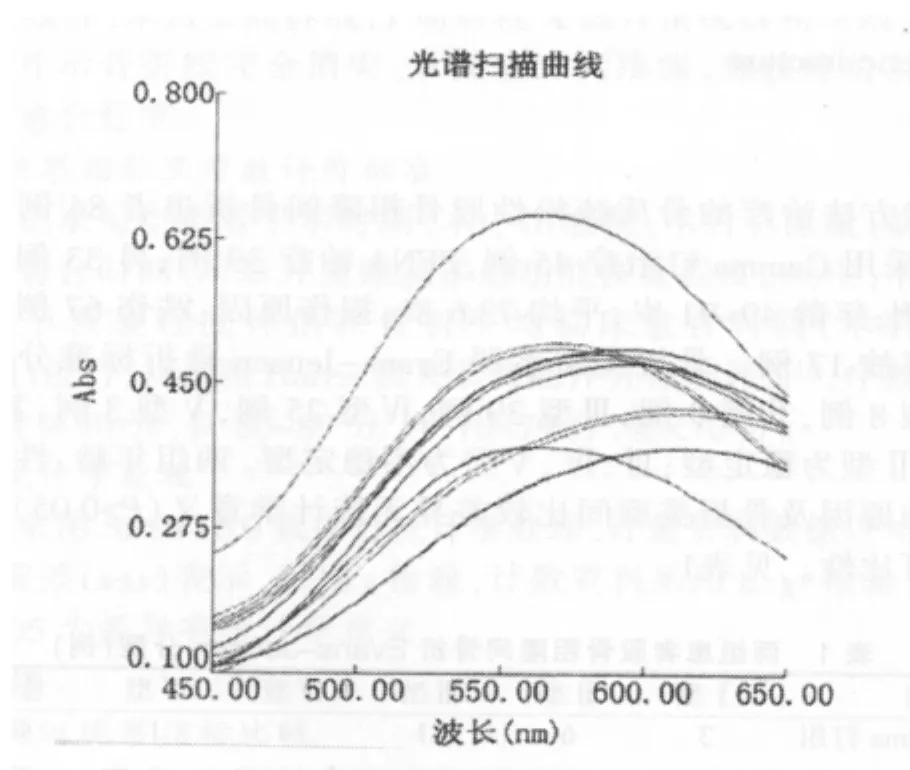
图1 以蒸馏水调零后所得的总蛋白吸收峰图谱
2.3.2 以试剂调零所得的吸收峰和吸光度∶用试剂调零后,对其混合液连续扫描两次,分别得出吸收峰及相应吸光度(表4),吸收峰图谱见图2。
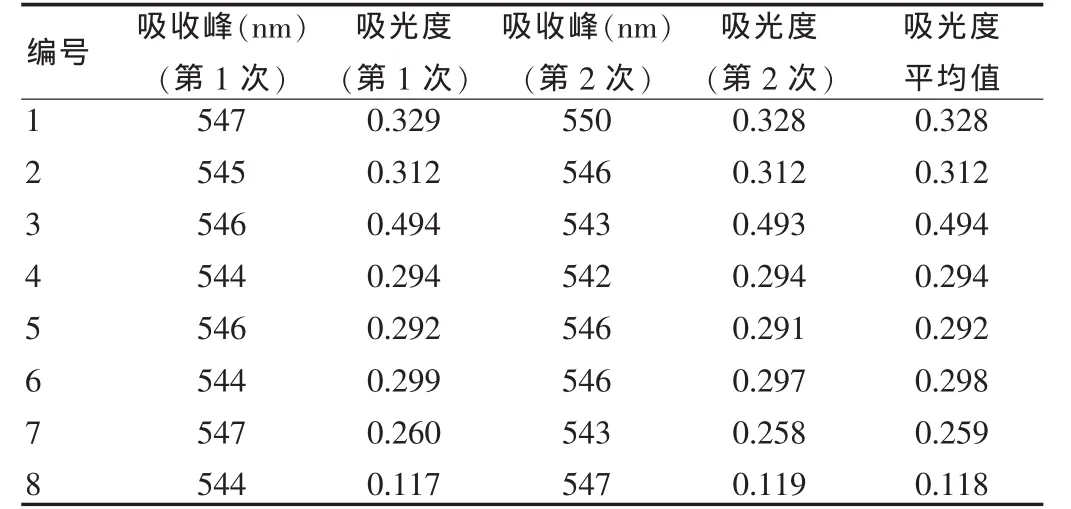
表4 各总蛋白试剂盒的吸收峰和吸光度(以试剂调零)

图2 以试剂调零后所得的总蛋白吸收峰图谱
2.3.3 理论吸光度和误差的计算:以4号厂家的吸光度为基础,计算出相应的理论吸光度和误差(表5)。

表5 各总蛋白试剂盒的理论吸光度和误差
3 讨论
从表3、4检出的吸收峰波长结果以及相应的图谱来看,表3所检出的吸收峰波长已远远偏离了说明书中要求的吸收峰波长,表4检出的吸收峰波长在正常范围内。即第一次试验扫描虽然是以蒸馏水调零,对混合液进行平行操作扫描,但连续两次扫描所得吸收峰波长和理论吸收峰波长之差在10 nm以上,且图谱比较乱,没有规律性;而用各自厂家生产的试剂调零后,检出的吸收峰和理论吸收峰一致,吸收峰之差均在10 nm以内,相应图谱显示吸收峰明显,有一定规律性。
在分析方法学上,8个厂家生产的试剂盒均采用的是终点法。从紫外分光光度仪的特性来讲,任一物质通过仪器扫描所得的吸收峰和理论吸收峰之差都应在±2 nm内,这样所得的结果才能经得起验证,但考虑到体外诊断试剂的特殊性,所以吸收峰之差在10 nm以内均认同和理论值吸收峰值相一致。
从表4、5的比较中可看出3、5、6号的吸光度与理论吸光度几乎一致,误差<2%,而 1、2、7、8号的吸光度与理论吸光度存在一定差异,误差范围在20%以内,排除在试验操作过程中一些不确定的因素如人为误差等,各自厂家生产的试剂对其吸光度值起着决定性的作用。8个厂家生产的总蛋白试剂盒均为单试剂,除了1号厂家加了适量防腐剂外,其余厂家的配方完全一样,在试验中都用的是终点法且反应原理一样,之所以出现吸光度值的差异与各自厂家配方的比例不一致有关。
[1]国家药典委员会.中国药典[S].三部.北京:中国医药科技出版社,2010:附录ⅥB.
[2]朱铁志.脂血标本总蛋白测定方法的探讨[J].中国医学检验杂志,2009,10(2):94-95.
[3]王霞文.临床生物化学和生物化学检验[M].南京:南京大学出版社,1995:180-182.
[4]叶应妩,王毓三,申子瑜.全国临床检验手册[M].3版.南京:东南大学出版社,2006:452-456.
[5]中华人民共和国卫生部.WS/T 124-1999临床化学体外诊断试剂盒质量检验总则[S].1999.

