宫颈人乳头瘤病毒第二代杂交捕获法和实时荧光聚合酶链反应检测法的临床应用比较
王立锋
1.苏州大学医学院,江苏 苏州 215007;2.上海市瑞金医院分院(上海市闵行中心医院)妇产科,上海 201100
宫颈癌作为一种危害妇女健康的严重疾病,目前在妇女中其发病率则仅次于乳腺癌的发病率,位于妇女恶性肿瘤发病的第2位,每年全世界约有50万新发病例,25万死亡病例,其中发展中国家占2/3。我国是宫颈癌的高发区,占全球宫颈癌总数的10%[1-5]。研究证实,人乳头状瘤病毒(HPV)是引起妇女宫颈癌及癌前病变发病的致病病毒;研究证实子宫颈上皮内瘤变(cervical intraepithelial neoplasia,CIN)患者多数伴HPV感染,调查发现妇女宫颈癌患者标本中HPV-DNA的可检出率为90.0%~99.7%,特别是那些高危型HPV感染。国际癌症研究组织(IARC)对世界25个国家(不包括东亚地区)的宫颈癌标本的研究发现了15种高危型HPV,而与我国宫颈癌密切相关主要病毒类型依次为HPV16、HPV58和HPV18,HPV58是我国、日本、朝鲜等东亚地区高发病毒流行株[6-9]。所以对存在CIN患者进行高危型HPV感染的筛查检测在临床上对于早期预防及发现宫颈癌具有十分重要的临床意义。第二代杂交捕获法(HCⅡ)是目前被FDA唯一批准的HPV感染检测方法,其具有能同时检测13种高危型HPV感染的方法。近年来,一种新的DNA检测技术实时荧光聚合酶链反应技术(real-time PCR)检测获得很大的发展,realtime PCR检测高危型HPV DNA具有试验操作简便,在扩增高危型HPV时结合了核酸特异型探针以进行杂交,该方法提高了实验室检测的敏感性及特异性[10-12]。本研究采用realtime PCR和HCⅡ技术来分别检测100例行液基细胞薄层涂片技术(TCT)≥低度鳞状上皮内病变(LSIL),未明确诊断意义的不典型鳞状上皮细胞(ASCUS)患者宫颈标本中的高危亚型HPV,探讨两种检测方法的优缺点及其不同CIN程度的高危型HPV的检出率,并探讨两种高危HPV检测方法在宫颈癌筛查中的作用。
1 材料与方法
1.1 材料
标本来源于2011年1~6月在上海市闵行区中心医院妇产科行液基细胞薄层涂片技术(LCT)≥未明确诊断意义的ASCUS患者100例。检查者按细胞学分类,ASCUS 48例,LSIL 36例,高度鳞状上皮内病变(HSIL)16例。分别采用realtime PCR与HCⅡ检测高危型HPV。及时将临床采集的标本送检,按照操作流程预处理临床采集的标本后置于低温冰箱保存待检。所有患者均对研究知情。
1.2 仪器与试药
高危型HPV实时荧光PCR临床检测试剂盒均由上海复星诊断有限公司所提供;采用Line-Gene FQIN33 A型realtime-PCR仪进行DNA检测;HCⅡ基因杂交信号扩大系(美国Digene公司)、HPV-DNA试剂盒(美国Digene公司)、微孔板封面胶膜(Xygen公司)、子宫颈采样器(含保存液)(美国Digene公司)、圆底96孔酶标板(Xygen公司)。
1.3 实时荧光聚合酶链反应技术检测方法
不同引物和探针(5'端和3'端分别标有荧光报告基团和荧光淬灭基团),只在相应型别模板的型特异性碱基区域与模板发生相互作用,PCR扩增时,兼有5'-3'核酸外切酶活性的Taq酶将探针降解,荧光报告基团脱离荧光淬灭基团的作用,荧光信号逐渐增强,由定量PCR仪的荧光监测系统对标本的荧光信号进行实时动态检测,确定模板的型别。realtime PCR法高危型HPV检测反应试剂盒可分辨13种高危型 HPV 型别(包括 16、18、31、33、35、39、32、52、56、58、59、68)。具体操作流程按试剂盒说明书指示的步骤进行操作。其操作流程包括如下步骤:①提取样本DNA。②配制real-time PCR反应液:将每1份样本标本分别分装到13个PCR反应管中以分别检测13种高危型HPV型别。③样本实时荧光PCR扩增与检测:扩增过程为50℃反应进行2 min,在94℃条件下进行DNA变性2进入PCR反应循环,循环温度及时间程序为 93℃,20 s,50℃,90 s,共计 40 个反应循环,反应温度降至50℃时检测反应荧光值。④对反应结果进行判断分析。
1.4 第二代杂交捕获检测方法
HCⅡ可同时检测 13种高危型HPV(包括 16、18、31、33、35、39、32、52、56、58、59、68),按照试剂上所述的操作步骤进行,其具体操作步骤如下:将DNA双链解链为单链DNA;将解链的DNA和RNA探针进行杂交,生成RNA-DNA杂交体;RNA-DNA杂交体和微孔壁上固定的特异性抗体相结合;结合的抗体进行磷酸化反应将信号放大;底物在碱性磷酸酶的作用下发光,利用读数器读取发光的强弱来判定微孔壁上碱性磷酸酶的含量,进而得出特异性结合的RNA-DNA杂交体的具体含量;最后进行反应结果的读取,判断标准:HPV负荷量≥1.0 pg/ml,则定义为HPV感染阳性。
1.5 病理判断
阴道镜下多点活检病理学检测:对于检测HPV阳性,或HPV阴性但TCT≥LSIL的病例均行阴道镜下多点活检或颈管诊刮。病理学家在完全不知道TCT和HPV结果的情况下盲法阅片做出诊断。
1.6 统计学方法
所以统计分析处理均采用SPSS 11.0统计软件包进行,计量资料采用均数±标准差()表示,组间比较采用t检验,计数资料采用百分率表示,组间对比采用χ2检验。以P<0.05为差异具有统计学意义。
2 结果
2.1 人乳头瘤病毒检出率及不同程度宫颈病变两种人乳头瘤病毒检出状况
本组诊断CIN 35例,CIN现患率为35%(35/100),其中,≥CINⅡ 16例,占16%(16/100)。68例病理结果以及两种HPV检出情况见表1。

表1 两种方法检测不同程度宫颈病变中人乳头瘤病毒阳性率比较[n(%)]
2.1 两种方法检测宫颈病变的符合率
两种方法的总符合率为82.3%,Kappa指数为0.579,见表2。

表2 两种方法检测宫颈病变符合率比较(例)
2.2 两种方法检测高危型人乳头瘤病毒的阳性率比较
HCⅡ和real-time PCR检测高危型HPV的阳性率分别为63.0%(63/100)和71.0%(71/100),两者比较差异有统计学意义(P<0.05)。
2.3 两种人乳头瘤病毒检测方法的评价
以病理结果为参照标准,评价两种HPV检测方法对预测高度CIN(CINⅡ以上病变)的临床价值,其临床评价指标见表3。
3 讨论
宫颈癌是威胁妇女健康的主要恶性肿瘤之一,目前发现的HPV基因型有100余种,大约40种涉及生殖道感染,约20种与肿瘤发生有关。依据HPV致病能力的不同,HPV可分为低危型和高危型,当前的流行病学数据证实,宫颈癌及其癌前病变发病的主要病因为高危型HPV的持续感染所致。 低危型 HPV,如 HPV6、11、42、43、44 等常引起外生殖器湿疣等良性病变和宫颈上皮内低度病变(CINⅠ);高危型HPV包 括 HPV16、18、31、33、39、45、51、52、56、58、59、68、73 等 ,研究证实这些型别的HPV持续感染与官颈病变的发生发展密切相关,尤其是HPV16和18型的致癌力最强[13-14]。在我国,现有的流行病学数据表明我国妇女宫颈癌的发病率明显高于发达国家。而研究证实约90%以上的宫颈癌患者在其宫颈组织标本种均可检测到高危型HPV[15-16]。
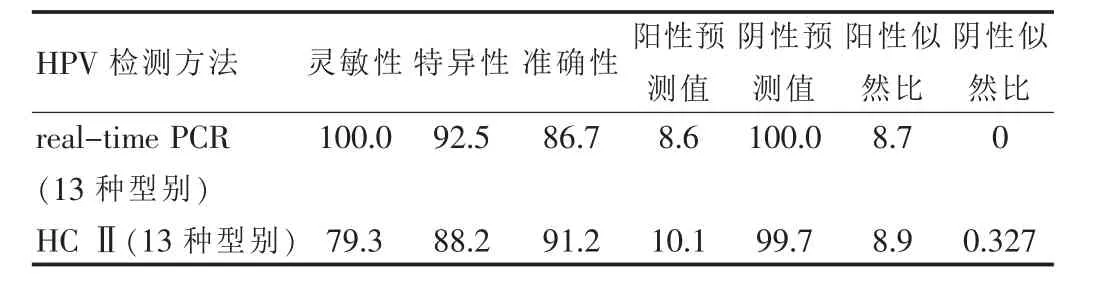
表3 两种人乳头瘤病毒检测方法对预测高度子宫颈上皮内瘤样病变的临床评价指标(%)
HC-Ⅱ技术是由FDA认证的用于宫颈癌普查的惟一非放射性检测高危型HPV型别辅助诊断方法(美国Digene公司),目前,一系列研究证实第二代杂交捕获法拥有很高的特异性和敏感性,其具有可一次性同时对一份宫颈样本检测13种导致高危宫颈病变的高危型HPV型别,该方法具有操作简单、检测效率高且成本较低廉的优点。研究证实在进行特异性高危型HPV感染发病危险性的群体流行病学调查研究基础上方能进行正规的宫颈癌发病的筛查,但是、当前临床上存在关于HPV基因分型型别试验并不统一,目前关于检测的金标准尚缺乏,因此给比较不同课题组之间将研究结果进行比较带来了很大的困难和不便[17]。
Real-time PCR技术是近年快速发展的一种DNA检测新技术,该技术的原理为在常规PCR原理基础之上使用荧光基团标记的探针(双荧光标记标记的两个荧光基因——报告基因及淬灭基因)来解决常规PCR在进行DNA扩增时由于样本易污染所产生的假阳性问题,该方法使得DNA检测的特异性得到很大的提高。多重实时荧光PCR核酸检测技术能同时对宫颈标本检测13种导致高危宫颈病变的高危型HPV型别,该技术在那些存在低拷贝数宫颈脱落细胞标本进行高危型HPV型别检测方面存在一定优势[18-19]。
若确定两种方法检测的真假阳性可经直接测序法进行评价。本文为分析其对高度CIN的临床预测价值,故以临床病理结果作为评价的参照。在本研究中,笔者分别利用HCⅡ技术与real-time PCR检测100例行TCT≥未明确诊断意义的ASCUS患者宫颈标本中的HPV高危亚型,结果发现,HCⅡ和real-time PCR检测高危型HPV的阳性率分别为63.0%和71.0%,两者比较差异有统计学意义(P<0.05),两种方法的符合率为 82.3%,Kappa指数为0.579。HCⅡ和 real-time PCR对高危型HPV感染的诊断敏感性分别为86.2%和91.7%,特异性分别为92.3%和98.9%。HCⅡ检测高危HPV对宫颈高度病变的敏感性、特异性、准确性、阳性预测值、阴性预测值、阳性似然比和阴性似然比分别为79.3%、88.2%、91.2%、10.1%、99.7%、8.9和 0.327;real-time PCR 以上各指标分别为 100.0%、92.5%、86.7%、8.6%、100.0%、8.7和 0。 结果显示,real-time PCR与HCⅡ检测宫颈上皮内瘤变患者高危型HPV有较好的相关性;但real-time PCR检测高危型HPV具有更好的敏感性和特异性。本研究结果显示,HCⅡ的阳性似然比为8.9,高于real-time PCR(8.7),即HCⅡ检测正确判断子宫颈高度病变的机会是错误判断为非高度病变的8.9倍,而real-time PCR为8.7倍。阴性似然比是该筛查方法错误判断阴性的可能性是正确判断阴性的可能性的多少倍,real-time PCR为0,而HCⅡ的阴性似然比为0.327,两种检测方法的阴性似然比都较小。
总之,对CIN患者宫颈组织标本进行高危HPV亚型检测是十分必要的,real-time PCR与HCⅡ能有效检测CIN患者高危型HPV,能及早发现及早干预,提高患者的预后。
[1]唐振华,李柱南,胡伟平.应用实时荧光聚合酶链反应技术与第二代杂交捕获法检测高危亚型人乳头瘤病毒[J].检验医学,2008,23(3):216-219.
[2]Cogliano V,Baan R,Straif K,et al.Carcinogenicity of human papillomavirus[J].Lancet Oncol,2005,6(4):204-209.
[3]Lee SA,Kang D,Seo SS,et al.Multiple HPV infection in cervical cancer screened by HPV DNA chip[J].Cancer Lett,2003,198(2):187-192.
[4]廖光东,刘彬,陈凤,等.流式荧光杂交法检测高危型人乳头瘤病毒的临床价值[J].肿瘤,2008,28(5):431-435.
[5]乔友林,章文华,李凌,等.子宫颈痛筛查方法的横断面比较研究[J].中国医学科学院学报,2002,24(1):50-53.
[6]Bellanger S,Tan CL,Xue YZ,et al.Tumor suppressor or oncogene a critical role of the human papillomavirus(HPV)E2protein in cervical cancer progression[J].Am J Cancer Res,2011,1(3):373-389.
[7]Sahasrabuddhe VV,Luhn P,Wentzensen N.Human papillomavirus and cervical cancer:biomarkers for improved prevention efforts[J].Future Microbiol,2011,6:1083-1098.
[8]Schmidt Grimminger DC,Bell MC,Muller CJ,et al.HPV infection among rural American Indian women and urban white women in South Dakota:an HPV prevalence study[J].BMC Infect Dis,2011,11:252.
[9]邱小华,刘伟.宫颈癌患者人乳头瘤病毒基因检测分型研究[J].中国全科医学,2011,14(21):2360-2362.
[10]陈忠领,魏新燕,范美珍,等.女性感染人乳头瘤病毒基因分型结果分析[J].国际检验医学杂志,2010,31(9):944-945.
[11]马佳,董兆文.人乳头瘤病毒感染与宫颈癌[J].中国计划生育学杂志,2000,8(8):378-380.
[12]Ramogola MD,McGrath CM,Barnhart KT,et al.Papillomavirus in HIV-Infected women with cervical intraepithelial neoplasia stages 2 and 3 in Botswana[J].Int J Gynecol Pathol,2011,30(6):591-596.
[13]Wang J,Wu M,Zhang S,et al.Prevalence of cervical intraepithelial neoplasia in patients with atypical squamous cells of undetermined significance from cervical pap smears in Beijing[J].Eur J Gynaecol Oncol,2011,32(4):411-414.
[14]万磊,李隆玉.人乳头瘤病毒感染与官颈癌关系的研究进展[J].实用癌症杂志,2005,20(2):222-224.
[15]胡必文.武汉地区宫颈感染人乳头状瘤病毒基因分析[J].实用医技杂志,2007,14(14):183-183.
[16]沈艳红.我国山西省子宫颈癌高发区人乳头瘤病毒感染调查[J]中国医学科学院学报,2003,25(4):381-385.
[17]Ma YY,Cheng XD,Zhou CY,et al.Value of P16 expression in the triage of liquid-based cervical cytology with atypical squamous cells of undetermined significance and low-grade squamous intraepithelial lesions[J].Chin Med J(Engl),2011,124(16):2443-2447.
[18]Mendoza N,Hernandez PO,Tyring SK.HPV vaccine update:new indications and controversies[J].Skin Therapy Lett,2011,16(8):1-3.
[19]Lamontagne DS,Barge S,Le NT,et al.Human papillomavirus vaccine delivery strategies that achieved high coverage in low-and middle-income countries[J].Bull World Health Organ,2011,89(11):821-830.

