两种校准品和3种双缩脲试剂测定血清总蛋白结果偏倚评估及方法学评价
王时南 杨 欢
双缩脲法测定血清总蛋白至今已将近100年的历史,其间不少学者对其进行了系统的实验并发表了大量的文献。美国临床化学协会和国际临床化学协会以Doumas1975年提出的配方为推荐方法[1];1981年Doumas又将该法推荐为侯选参考方法;《全国临床检验操作规程》推荐Doumas双缩脲配方做为血清总蛋白测定常规方法[2]。鉴于当时国内双缩脲试剂配方很不一致,国内有学者对不同配方的双缩脲试剂进行了标准化评价,并提出有必要对其配方进行统一[3]。但目前国内不同厂家生产的双缩脲试剂盒其配方仍存在着较大的差异,而且不同实验室应用的校准品也不一致。已有报道,一些项目的试剂或校准品不同,其结果存在有明显的差异[4,5]。为此,我们对两种校准品和3种双缩脲试剂盒测定血清总蛋白结果进行了实验。
材料与方法
1.试剂与仪器:(1)罗氏公司(Roche)生产校准血清(c.f.a.s):总蛋白浓度标示值为50.2g/L(其中清蛋白为35.0g/L)。总蛋白标准液(其成分为纯清蛋白),浓度标示值为50.0g/L,由上海科华东菱诊断用品有限公司产品提供;②3种双缩脲试剂盒配方见表1;③仪器AU5400全自动生化分析仪。
2.实验样本:笔者医院门诊及住院病人新鲜血清标本。
3.方法:①试剂盒 A、B、C 分别与校准血清(c.f.a.s)和总蛋白标准液组合成6个检测系统,其中以试剂盒A(Doumas配方)与校准血清(c.f.a.s)和总蛋白标准液分别组成为两个参照系统,试剂盒B和C与校准血清(c.f.a.s)和总蛋白标准液分别组成各两个待检系统;②按NCCLS EP9-A文件,每日选取高、中、低值新鲜临床血清标本10份,分别用3种试剂按顺序1→10进行测定,再按相反顺序10→1重复测定,共测定5天,记录结果,去除离群点,计算线性方程、相关系数、偏倚评估与统计学分析;③收集肝功检测剩余无脂浊、无黄胆、无溶血血清制成高值(85.5g/L)和低值(55.2g/L)两份血清(其浓度经试剂A和校准血清测得),然后将高、低值2份血清每天上午、下午各测定1次,每次测双份,共测20天,按NCCLS EP5-A文件,计算它们批内、批间、日间和总CV%;④用血清总蛋白含量为120g/L和 40g/L两份标本按不同4∶0、3∶1、2∶2、1∶3、0∶4 比例混合,其血清总蛋白浓度依次为 120g/L、100g/L、80g/L、60g/L、40g/L 5 份标本,每份标本用 3 种双缩脲试剂盒各测定4次,然后按NCCLS EP6-P文件方案评价线性[8];⑤1份血清总蛋白浓度为71.3g/L,用3种双缩脲试剂测定,比较它们的反应曲线;⑥分析参数:终点法,S 3.0μl,R150μl,主/副波长540nm/660nm,读数点0~27,反应方向正向;⑦离群点的检查:计算样本重复测定值间差值(Dxi和Dyi)的平均数和两种检测系统测定结果均值差(Yi-Xi)的平均数;超出上述平均数4倍时,检验结果视为离群点,应弃去,必要时重做;⑧相关系数r≥0.975(或 r2≥0.95)说明两试剂测定结果相关良好,当r<0.975,可通过测定另外标本来扩宽X范围。
5.统计学方法:应用SPSS 16.0和Excel 2003软件;显著性检验均采用配对t检验。
结 果
1.实验数据经计算判断均无离群点,r2均 >0.95。3种双缩脲试剂盒、两种校准品测定血清总蛋白结果见表2。
2.用罗氏公司生产校准血清(c.f.a.s)校准,以试剂盒A为参照系统,试剂盒B和试剂盒C为待检系统,其散点图见图1、图2,偏倚图见图3、图4。
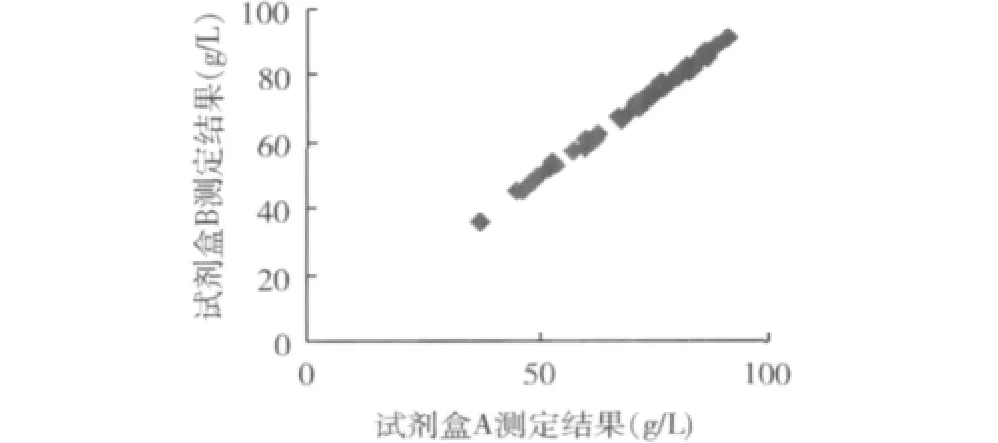
图1 试剂盒A与试剂盒B散点图n=50,r=0.9989,y=1.01x -1.08
3.用总蛋白标准液校准,以试剂盒A为参照系统,试剂盒B和试剂盒C为待检系统,散点图见图5、图6,偏倚图见图7、图8。
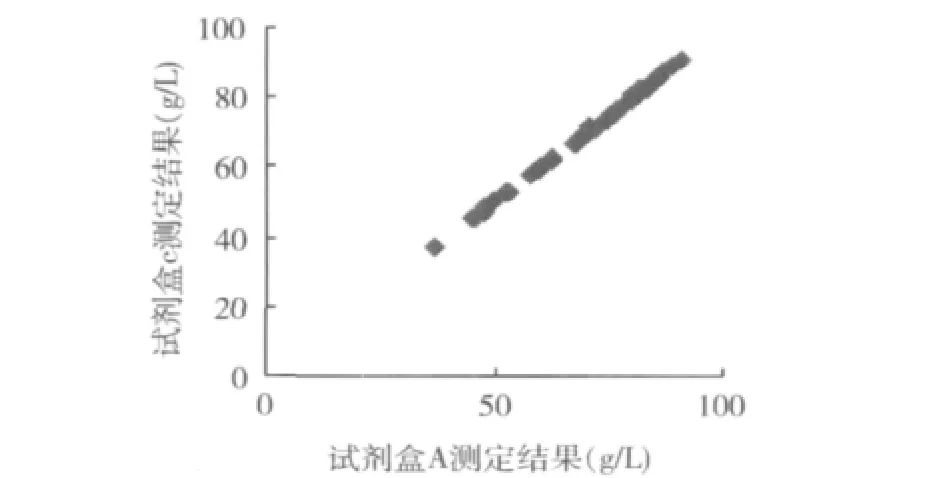
图2 试剂盒A与试剂盒C测定结果散点图n=50,r=0.9995,y=1.00x+0.03
4.根据图1、图2中的回归方程Roche校准品双缩脲试剂盒A与试剂盒B、C预期偏倚估计:见表3。
5.根据图4、图6中的回归方程总蛋白标准液双缩脲试剂盒A与试剂盒B、C预期偏倚估计:见表4。

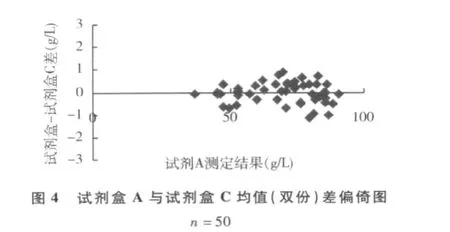
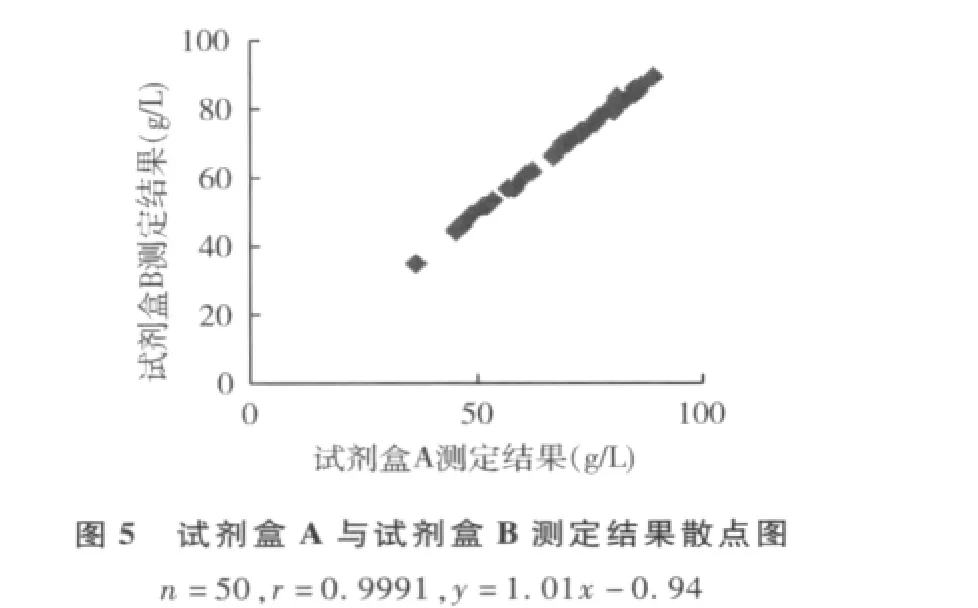

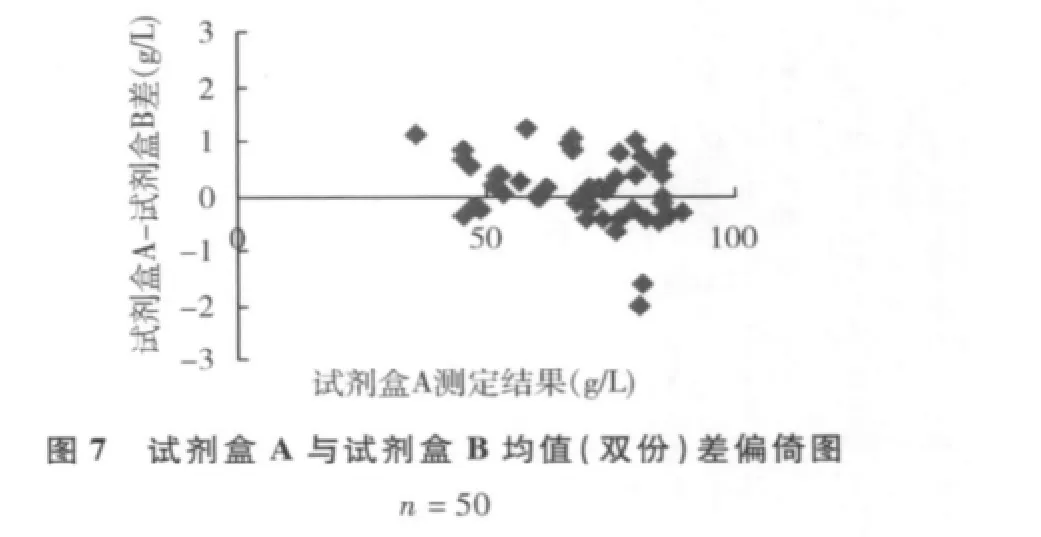
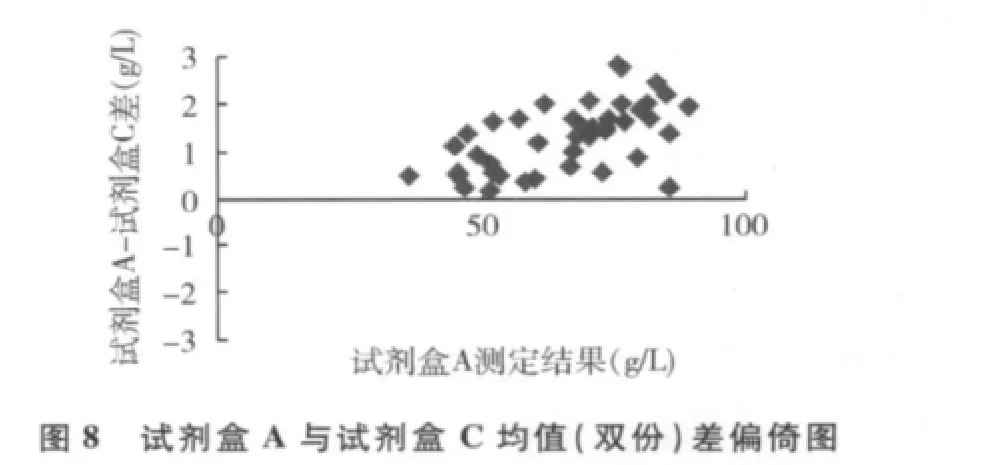

表3 Roche校准品双缩脲试剂盒A与试剂盒B、C预期偏倚估计

表4 总蛋白标准液双缩脲试剂盒A与试剂盒B、C预期偏倚估计
6.3种双缩脲试剂测定血清总蛋白高、低值标本 批内、批间、日间和总CV%:见表5。
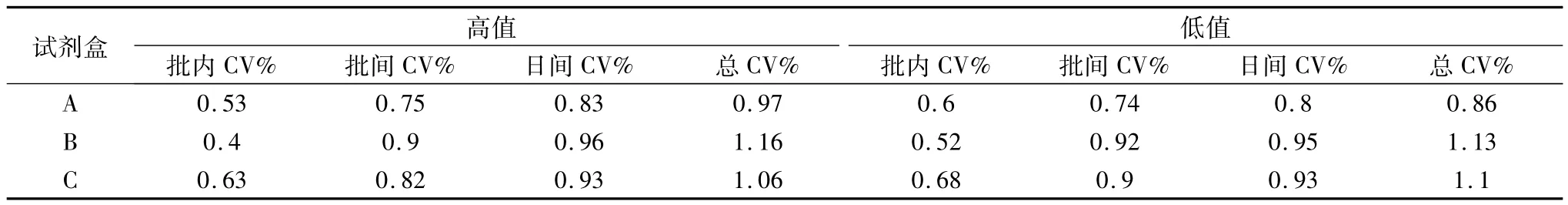
表5 3种双缩脲试剂盒测定血清总蛋白批内、批间、日间和总CV%
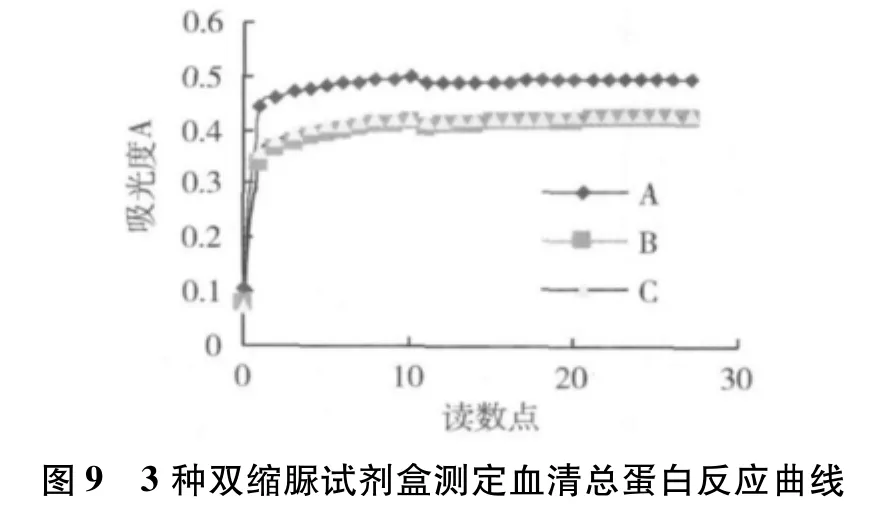
7.3种双缩脲试剂盒测定血清总蛋白(浓度为71.3g/L)反应曲线的比较:见图9。
8.3种双缩脲试剂盒测定血清总蛋白的标准曲线:见图10。

按NCCLS EP6-P文件线性评价方案,经统计处理,3种双缩脲试剂盒稀释变异均可接受(C<C0.05),试剂盒 A和试剂盒 B线性良好(F<F0.05),试剂盒C不可接受(F>F0.05)。
讨 论
目前市场上双缩脲试剂盒配方的成分大致上相同,但在各成分的质量上仍存在有一定的差异,而测定血清总蛋白的参考物一般为基质状态与病人血清标本基本相似的校准血清或系纯清蛋白配制而成的总蛋白标准液。双缩脲法测定血清总蛋白结果的准确性取决于血清蛋白主要组分参考物的有效性和测定血清不同组分在双缩脲反应中呈色的一致性。Doumas于1981年验证了他推荐的双缩脲试剂配方对γ球蛋白(其成分99.1%为IgG)和人清蛋白二者的吸光度是一致的。如果用基质状态与病人血清标本基本相似的校准血清校准,试剂配方对测定结果可能无明显影响,如用纯清蛋白配制而成的总蛋白标准液校准,因与病人血清标本基质状态存在有明显的差异,不同双缩脲试剂配方测定结果就有可能产生偏倚,其偏倚的大小与方向取决于测定血清标本中清、球蛋白量及与该双缩脲试剂反应中呈色的差异。因此,用Doumas配方的双缩脲试剂,两种校准品测定结果的偏倚,主要是两种校准品校准值存在差异。
本实验结果表明,用罗氏公司生产校准血清(c.f.a.s)校准仪器时,3种双缩脲试剂盒测定50份临床血清标本结果均值相对偏倚小于0.76%,试剂盒B、C与试剂盒A比较,差异均无统计学意义(P>0.05)。如用总蛋白标准液校准仪器,试剂盒B与试剂盒A比较,50份临床血清标本结果均值相对偏倚为0.1%,差异无统计学意义(P>0.05);而试剂盒C与试剂盒A比较,50份临床血清标本结果均值相对偏倚为2.19%,差异具有统计学意义(P<0.01),表明两试剂测定结果存在有明显的系统误差。同一试剂用两种校准品测定50份临床血清标本,3种双缩脲试剂盒均值相对偏倚为1.0% ~3.5%,经统计分析,差异均具有统计学意义(P<0.01)。
从表2~表4中我们可以看出,无论用校准血清(c.f.a.s)还是用总蛋白标准液校准仪器,双缩脲试剂盒B和C与双缩脲试剂盒A比较的相对偏倚为0% ~2.19%,预期相对偏倚为 -3.68% ~0.22%,均小于CLIA'881/2总允许误差。由表5中可知,3种双缩脲试剂盒测定血清总蛋白总CV为0.86% ~1.16%,均远小于CLIA'881/4总允许误差。这也许是我国目前双缩脲法测定血清总蛋白试剂配方得不到统一的主要原因。从图9、图10中可以看出,读数点0~27,3种双缩脲试剂盒反应均已基本完全;波长为540nm时,试剂盒A的吸光度明显高于试剂盒B和C;试剂盒A和试剂盒B线性优于试剂盒C。
鉴于本实验的结果,我们建议尽可能选用试剂盒A配方即Doumas配方。因客观原因(如试剂不中标)不能选用试剂盒A配方时,应选用与病人血清标本基质状态相似的校准品,以提高不同实验室间血清总蛋白测定结果的可比性。
1 Doumas BT.Standards for total serum protein assays a collaborative study[J].Clin Chem,1975,21:1159-1166
2 叶应妩,王毓三,申子瑜.全国临床检验操作规程[M].3版,南京:东南大学出版社,2006:337-339
3 陆永绥,潘秋英,陈秀枢,等.血清总蛋白测定双缩脲试剂及标准化评价[J].临床检验杂志,1996,14(3):115 -117
4 王时南,陈彬彬.两种胆固醇试剂偏倚评估及可比性研究[J].医学研究杂志,2007,36(11):90 -91
5 王时南.胆固醇两种校准品测定结果偏倚评估及校准品应用中的问题[J].中国卫生检验杂志,2010,20(3):602 -603

