锰胁迫对甜菜幼苗光合色素含量及碳氮代谢相关酶活性的影响
吴旭红,张 超
(齐齐哈尔大学生命科学与农林学院,黑龙江 齐齐哈尔 161006)
锰作为植物生长发育的必需营养元素,由于其直接参与水的光解和电子传递,并可在叶绿体中与蛋白质结合形成酶蛋白,因此在光合作用中发挥重要功能;同时锰是多种酶的活化剂,起调节植物体内氧化还原状况,促进种子萌发、幼苗生长及刺激代谢等多方面的作用。另一方面,随着锰在很多工业领域中的广泛应用,促使硫酸锰生产工业迅速发展,产生的硫酸锰渣也日益增多,锰渣的渗滤液可以进入土壤环境而带来污染。除重金属的开采、提炼等污染源外,不合理的灌溉、其它工业污染物的排放、大量酸性和生理酸性肥料的施用,都加剧了土壤酸化。pH值的降低,可以促使土壤中锰的释放。pH5.0左右,土壤中可给态锰的含量大幅提高,会造成其他营养元素如铁和钙的吸收障碍[1]。鉴于在酸性条件下作物锰毒害经常发生,因而已有一些关于锰毒的研究报道,受高锰灌溉的水稻,孕穗期会发生黑根、死苗、减产20%~30%;在高锰土壤中生长的菠萝,由于吸收过量锰,造成体内多种酶系统及功能组织的损伤,从而影响其生长发育[2-4]。甜菜作为大面积栽培的经济作物,锰污染的研究未见报道。本试验主要针对硫酸锰污染对甜菜幼苗的早期碳、氮代谢的生理响应进行研究,对光合色素含量及碳氮代谢相关酶活性及其相互关系进行了探讨,对不同基因型的甜菜不同强度、不同剂量的锰毒的敏感性和耐受性做出初步评价。
1 材料与方法
1.1 材料与处理
供试材料为KWS9419和甜单301甜菜种子,由齐齐哈尔市种子公司提供。
取2种甜菜种子,分别用70%的酒精消毒1min及5%的次氯酸钙溶液浸泡2h后,用无菌水冲洗干净,再用无菌水浸泡10h,之后将处理过的种子播于细砂经清水浸泡1h,高温灭菌(130℃,3h)定量称重的花盆中(50粒/盆),于人工气候培养箱中(25℃/20℃±1℃,光照13h、黑暗11h循环,相对湿度70%~80%)控制培养。待子叶展平时,用1/2Hongland营养液浇灌,3d后换成全营养液。当两对真叶完全展开时(苗期),将预先配制的含0、0.2、0.5、0.8 mmol/L MnSO4的 Hongland 营养液调至 pH 5.5,于每天 8:00—9:00 进行处理,每盆用 200mL 含相应浓度的锰营养液分2次浇透,每隔3d处理1次,次日8:00—9:00时称重,测定每盆失水量后以水补足,分别于处理后的3d、6d、9d和12d取全展的功能叶进行相关指标的测定,每个处理设置3次重复。
1.2 生理生化指标的测定
取 0.5g 幼叶,于 5mL 由 Tris-HCl(50mmol/L pH 8.0)、甘油(12.5%v/v)和巯基乙醇(5%v/v)组成的介质中制备匀浆,离心20min(15000r/min),上清液用来测定Rubisco的含量。Rubisco含量及蛋白水解酶活性参照Makino的方法测定[5];NR和GS测定采用李彩凤的方法[6];光合色素含量的测定参照《植物生理生化实验原理和技术》[7]。
2 结果
2.1 锰污染对甜菜幼苗叶片光合色素含量的影响
锰污染明显影响甜菜叶片光合色素含量。表1中可以看出,KWS9419和甜单301幼苗在0.2mmol/L锰胁迫浓度时,总叶绿素和类胡萝卜素含量均呈现高于对照,此后随胁迫程度加强而下降的趋势。特别是甜单301,最高锰胁迫处理的叶绿素含量比对照减少了42.11%,类胡萝卜素含量比对照减少了57.27%,说明锰污染对叶绿素含量有负面影响。从光合色素种类比较,叶绿素a和类胡萝卜素降幅较大,0.5mmol/L锰胁迫处理,KWS9419的叶绿素a比对照下降28.06%、类胡萝卜素降幅为11.34%,而叶绿素b比对照高出6.5%;最高锰处理时,则分别比对照降低46.87%、31.09%,而叶绿素b仅有小幅(3.36%)下降。甜单301锰污染对叶绿体色素的破坏程度分别为,中等强度胁迫(0.5mmol/L)叶绿素a比对照下降46.31%、类胡萝卜素降幅为19.38%,叶绿素b比对照低7.66%;最高锰处理时,则分别比对照降低51.86%、57.27%,叶绿素b比对照下降12.91%。品种间比较,KWS9419除对照外,在对应的各处理浓度下,叶绿素a、b和叶绿素a+b及类胡萝卜素含量都高于甜单301。随处理浓度加大,各指标含量降幅低于甜单301。类胡萝卜素既是光合色素,又是内源性抗氧化剂,可以淬灭活性氧而防止膜过氧化[3]。高锰胁迫下,2种甜菜幼苗类胡萝卜素含量均显著降低,但KWS9419降幅小,说明类胡萝卜素有效发挥了抗氧化作用。2种甜菜幼苗叶绿素a/b变化趋势相同,均随锰污染强度的加大而减小。中锰污染时,甜单301的叶绿素a/b有一个骤降,此后与KWS9419维持相同水平。叶绿素a/b值的逐渐降低,说明锰污染加速了植物叶片的衰老进程;也说明KWS9419在色素方面耐受性更强,有较强的光保护能力。
?
2.2 不同浓度锰污染对甜菜幼苗叶片Rubisco含量和蛋白水解酶活性的影响
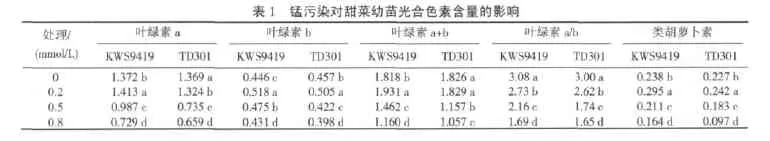
1,5-二磷酸核酮糖羧化酶Rubisco既参与植物的光合作用又参与光呼吸过程,是所有光合生物进行光合碳同化的关键酶。Rubisco含量的高低直接影响植物的净光合产量。图1显示,除0.2mmol/L锰处理的KWS9419叶片Rubisco含量有一个小幅上升外,两个甜菜品种Rubisco含量均随锰污染浓度的加大和处理时间的延长呈下降趋势。品种间比较,0.2mmol/L及0.5mmol/L锰处理6d时,KWS9419和甜单301 Rubisco含量都维持在相对较高的水平,且变幅较小,各处理之间差异不显著;0.8mmol/L锰处理,则分别降至对照的86.73%和75.89%;处理达到12d时,两个品种Rubisco含量均呈现较大幅度下降。0.2mmol/L锰处理与对照比差异不显著,但相对中等强度 (0.5mmol/L)锰处理,KWS9419和甜单301 Rubisco含量分别降至对照的84.49%和64.60%;高强度(0.8mmol/L)锰污染,甜单301 Rubisco含量已经比对照降低了44.89%,达到相同处理强度的KWS9419 Rubisco含量的81.18%。品种之间和污染强度之间均呈显著差异。两个品种在高锰污染下Rubisco含量的变化趋势相同,但甜单301在中度和重度锰胁迫下,Rubisco含量陡然下降,降幅比KWS9419大。
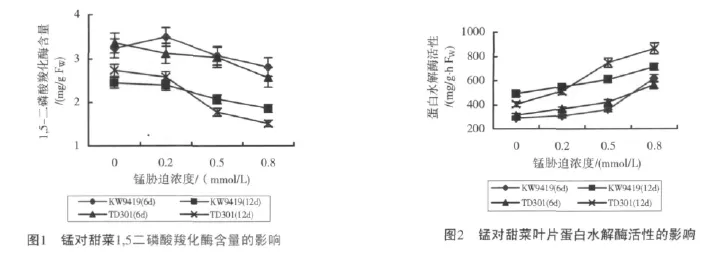
从总趋势上看(见图2),蛋白水解酶活性随锰污染强度的增加和时间的延长明显上升。6d锰污染处理时,0.2mmol/L和0.5mmol/L胁迫浓度之间蛋白水解酶活性差异不显著,品种之间蛋白水解酶活性也未达差异显著水平,但高锰处理下两品种与中度及重度锰污染处理浓度之间均达差异显著水平,但品种之间差异不显著。锰污染达12d时,中等强度处理KWS9419蛋白水解酶活性是对照的1.23倍,甜单301已达对照的1.84倍;高锰处理时,两品种酶活性分别是对照的1.44倍和2.12倍。由此可见,甜单301比KWS9419蛋白水解酶活性上升速度快、增幅高。对比图1、图2在现有锰污染剂量和时间条件下,Rubisco含量和蛋白水解酶活性之间存在一定的相关性,经统计分析表明,蛋白水解酶活性随Rubisco含量的降低而升高,两者之间存在显著的负相关,相关系数为r2=0.9381,y=-158.26x+882.9。
2.3 锰污染对甜菜幼苗叶片NR活性的影响
NR是一种黄素蛋白,存在于细胞质中,与存在于叶绿体中的亚硝酸还原酶共同作用,将NO3-还原为NH4+,是植物氮素代谢中的关键酶。从功能叶片NR活性变化规律来看,较低浓度锰污染(0.2mmol/L),KWS9419和甜单301的NR活性都有不同程度的增加,尤其是甜单301,处理9d和12d时,NR活性分别是对照的1.79倍、1.64倍,而KWS9419 NR活性分别是对照的1.55倍、1.58倍,各时点的测定值都低于甜单301。中度污染强度下,两品种的NR活性呈先升后降的趋势,除第3d外,KWS9419的NR活性都高于甜单301。高锰处理,随污染时间的延长,NR活性明显下降。品种间比较,处理3d时,NR活性品种间差异不显著。随处理时间加长,甜单301的NR活力急剧下降,9~12d时,分别比KWS9419降低了32.97%和24.48%,已达对照的59.0%和51.43%。处理与对照之间及两品种之间达到差异显著水平。这说明较低浓度和中等强度短时锰污染,有提高NR活力、刺激甜菜前期氮代谢的作用,随污染剂量加大和时间延长,有抑制NR活力的作用;同时也表现出不同甜菜品种对高锰污染的耐受性差异。
2.4 不同浓度锰污染对甜菜幼苗叶片GS活力的影响
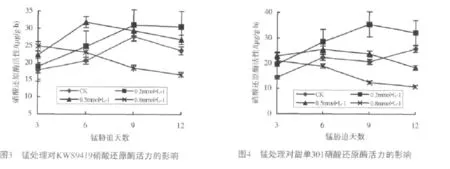
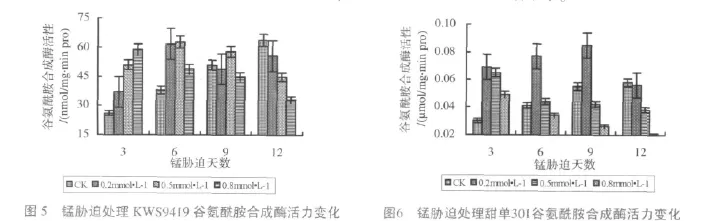
在叶绿体中发生的由GS和GOGAT构成的GS-GOGAT途径是高等植物将氨同化为有机氮化物的重要途径。功能叶片GS活性动态变化显示(图5~6),较低浓度的锰,对酶活刺激效应明显,甜单301在0.2mmol/L锰处理3d和9d时,分别比对照高56.52%和54.54%,是KWS9419的1.86倍和1.73倍,说明甜单301对环境锰的敏感性较KWS9419强。随处理浓度加大,抑制效应显现,两品种GS均呈下降态势,但两品种的变化趋势有所不同。0.5mmol/L锰污染,KWS9419除处理第12d的GS低于对照外,其余处理均高于对照;而甜单301除处理第3d的GS高于KWS9419,其它各处理GS活性均低于KWS9419。KWS9419在0.8mmol/L锰处理9~12d时低于对照,而甜单301各处理均显著低于对照,且6~12d处理的GS维持在相对稳定的较低水平,动态变幅缩小。高锰处理9~12d,甜单301的GS活性已降至KWS9419的57.78%和60.60%。显示甜单301对锰胁迫的耐受性较KWS9419低。中等和重度锰污染,两品种GS活力达差异显著水平。
3 讨论
锰作为植物必需的微量营养元素,在生长发育中起着不可替代的作用,其缺乏和过量都会对植物产生显著影响[8]。本试验研究表明,中度尤其在重度锰污染条件下,甜菜幼苗期叶片中光合色素含量呈显著下降趋势。叶绿素含量降低与合成叶绿素所需的酶受重金属破坏有关[9],锰作为重金属离子,当被甜菜吸收和随时间累积到一定程度,会诱导活性氧(ROS)的产生,而加速膜脂过氧化作用。膜脂过氧化作用中产生脂质自由基,它能连续诱发脂质的过氧化作用,且又可以使蛋白质脱氢而产生蛋白质自由基,使蛋白质分子发生链式聚合,从而使细胞膜变性,导致细胞损伤。锰污染使甜菜幼苗期叶片中光合色素含量降低的可能原因就是在逆境条件下体内自由基累积,加剧了叶绿体膜脂过氧化,使叶绿体膜的结构和功能遭到破坏;此外,锰逆境胁迫在细胞内的累积,可能作用于叶绿体色素合成过程中-SH基酶的活性巯基,从而抑制其酶活性。2品种甜菜幼苗叶绿素a/b变化趋势表明,锰污染加速了植物叶片的衰老进程。
1,5-二磷酸核酮糖羧化酶/加氧酶(Rubisco)既可催化羧化反应,又可以催化加氧反应,是催化光化学合成和光呼吸早期反应的关键酶。光呼吸是植物的绿色细胞在光照下吸收氧气释放CO2的反应,这种反应需叶绿体参与,在大气中,光呼吸与光合作用同时进行、伴随发生,CO2和O2竞争Rubisco同一个结合位点,光合作用可为光呼吸提供O2,而光呼吸释放的CO2又可作为光合作用的底物。通过在不同甜菜品种幼苗中测定锰污染对Rubisco含量的影响,发现伴随着叶绿体色素含量的下降,出现了Rubisco的同步降解。说明在锰逆境下,光合放氧的加氧反应和光呼吸释放CO2的羧化反应均受到不同程度的抑制。同时也与在逆境胁迫下,ROS含量的增加可以诱发Rubisco的降解有关。
在甜菜的发育过程中,碳、氮代谢相互协调决定甜菜的产量和品质。在生育前期主要以氮代谢为主,中期两者并重,后期主要以碳代谢为主[10]。通过锰处理对甜菜蛋白水解酶活性的影响,发现在甜菜两个品种幼苗中呈现相似的趋势;并且随Rubisco的降低,蛋白水解酶活性升高。这说明由于在锰逆境下Rubisco的降低、叶绿体色素合成的受阻,光合碳同化能力下降,可能造成甜菜早期分化和发育的物质和能量不足以满足器官建成和代谢的需要,而强烈诱导蛋白水解酶基因的表达,使蛋白水解酶活性大幅提高。其结果不仅加速了原有组织蛋白的大量分解,还可造成保护酶系统的破坏和抗逆境蛋白的减少,从而影响抗性基因的表达。其机理有待进一步研究。
硝酸还原酶(NR)是植物体内重要的诱导酶,是氧化态氮形成还原态氮的转化酶,酶活性的高低与其对土壤中无机氮的利用密切相关。谷氨酰胺合成酶(GS)是参与氨同化过程的关键酶。两者对于甜菜的早期氮代谢起重要作用,直接影响苗期发育及产量和品质。研究表明,锰污染尤其是重度污染大幅度降低了两个甜菜品种的NR和GS活性,抑制了对土壤中硝酸盐的利用和氨的进一步同化。但较低浓度和中等强度短时锰污染,有提高NR活力、刺激甜菜前期氮代谢的作用,随污染剂量加大和时间延长,有抑制NR活力的作用。从光合色素含量和碳、氮代谢相关酶活性变化趋势可见,不同甜菜品种对高锰污染的耐受性有差异,0.2mmol/L锰胁迫浓度,甜单301比KWS9419光合色素含量的增加和NR、GS活性的刺激效应明显,但在中度和重度锰污染下,上述指标均大幅下降,两品种已达差异显著水平(p<0.05)。说明甜单301对锰的敏感性高于KWS9419,而KWS9419对锰的耐受性优于甜单301。
[1]陆景陵.植物营养学(上)[M].北京:中国农业大学出版社,1994.
[2]何勇强,陆申年,黎耿碧.废矿还耕锰矿区土壤上菠萝锰毒害的研究[J].农业环境保护,1996,15(1):15-18.
[3]胡蕾,施益华,刘鹏,等.锰对大豆膜脂过氧化及POD和CAT活性的影响研究[J].金华职业技术学院学报,2003(1):29-32.
[4]杨德俊,杨卫韵,刘鹏,等.锰对大豆若干生理特性的影响[J].亚热带植物科学,2005,34(2):8-10.
[5]Makino A,Mae T,Ohira K.Colorimetric measurement of protein with Coomassie brilliant blue R on sodium dodecyl sulfatepolycarylamide gel electrophoresis by eluting with formamide[J].Agr Biol Chem,1986(50):1911-1912.
[6]李彩风,马凤鸣,赵越,等.氮素形态对甜菜氮糖代谢关键酶活性及相关产物的影响[J].作物学报,2003,29(1):128-132.
[7]李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000.
[8]施益华,刘鹏.锰在植物体内生理功能研究进展[J]. 江西林业科技,2003(2):26-28.
[9]STOBART A K,CRIFFITHA W T,AMEEN-BUKHARI I.The effect of Cd2+on the biosynthesis of chlorophyll in leaves of barley[J].Plant Physiology,1985,63(3):293-298.
[10]王晔,赫磊,石晓艳,等.甜菜氮素同化与蔗糖代谢的关键酶及相关性研究[J].东北农业大学学报2009,40(6):17-22.

