腺苷诱导人食管癌EC109细胞凋亡及其内质网分子机制
韦碧柳,李国平,蒲泽锦,黄官友,冯家琳,叶艳清,吴灵飞
(汕头大学医学院第二附属医院1.消化内科,2.妇产科,3.信息科,广东 汕头 515041)
腺苷是人体内重要的生物信号分子,正常情况下维持在极低浓度水平,通过不同的腺苷受体发挥生理调节功能[1]。然而,体外高浓度腺苷却可通过线粒体途径[2]或其死亡受体途径[3]等不同机制诱导多种肿瘤细胞凋亡。已有研究表明,腺苷可诱导人肝癌HepG2细胞凋亡[4],其机制可能与内质网应激途径有关[5]。虽然食管癌 EC109细胞和肝癌HepG2细胞均属于上皮类型细胞,但两种细胞来源于不同的上皮,腺苷是否亦可通过此途径诱导食管癌细胞凋亡目前尚未见报道。本文旨在观察腺苷对人食管癌EC109细胞凋亡的作用,并探讨其与内质网应激途径相关的分子机制。
1 材料与方法
1.1 药物、试剂和仪器
腺苷购自美国Amerco公司。DMEM培养基购自美国Gibco公司;胎牛血清购自美国Clark Bio公司;山羊抗人葡萄糖调节蛋白78(glucose regulated protein 78,GRP78)抗体、小鼠抗人胱天蛋白酶4抗体、兔抗人转录因子CHOP抗体、兔抗人胱天蛋白酶3抗体和小鼠抗人β肌动蛋白抗体均购自Santa Cruz公司;蛋白酶抑制剂 PMSF、裂解液、4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole,DAPI)和碘化丙啶(propidium iodide,PI)、生物素标记的山羊抗兔IgG抗体(二抗)和生物素标记的山羊抗小鼠IgG抗体(二抗)均购自Sigma公司;Alexa Flour标记的羊抗兔 IgG抗体(荧光标记二抗)购自Invitrogen公司;亲和素生物素辣根过氧化物复合物(avidin biotin horseradish peroxidase complex,ABC)试剂盒购自美国Vector Laboratories公司;ECL化学发光试剂盒购自Pierce公司;TUNEL试剂盒购自Promega公司;硝酸纤维素膜购自Millipore公司。荧光显微镜BX51(日本Olympus公司);蛋白电泳与转膜装置Mini ProteinⅢ和紫外分光光度计smartspecTM 3000(美国Bio-Rad公司);酶联免疫检测仪(芬兰Thermo Fisher科技公司);低温高速台式离心机(德国Eppendorf公司);超声波细胞粉碎机(宁波新芝科学仪器研究所)。
1.2 细胞培养
EC109细胞培养于含10%胎牛血清的DMEM培养基中,3 d传代1次,在37℃,95%湿度和5%CO2的条件下培养,12 h后用于实验。
1.3 MTT法测定细胞存活率
时效观察:每孔加入100 μl EC109细胞悬液(含1×105细胞)至96孔板中,培养12 h后弃原培养基,加入含腺苷终浓度2 mmol·L-1培养基继续孵育24,36,48和72 h,每组设5个复孔及调零孔;随后加20 μl MTT 5 g·L-1,作用 4 h 后弃培养基,加DMSO 150 μl,避光振荡10 min,用酶标仪490 nm 处检测吸光度(A),观察时效关系。另取96板,同前处理细胞,12 h 后加腺苷 0.5,1,2 和 4 mmol·L-1孵育培养,每组设5个复孔及调零孔,36 h后加20 μl MTT 5 g·L-1,后续处理同时效观察实验,观察量效关系。实验重复3次。细胞存活率(%)=A实验组/A对照组×100%。
1.4 TUNEL法测定细胞凋亡
把细胞接种于放置有盖玻片的6孔板中,培养12 h 后,分对照组和腺苷 0.5,1,2 和 4 mmol·L-1组,培养36 h。PBS洗2次,每次5 min,其余步骤按照试剂盒的说明进行。每张玻片400倍显微镜下随机选取10个视野,进行细胞分类并计数。凋亡细胞胞核呈褐色,正常细胞胞核呈淡蓝色。细胞凋亡率(%)=凋亡细胞数 /总细胞数 ×100%。实验重复3次。
1.5 免疫荧光检测细胞中内质网应激相关蛋白的表达及亚细胞定位
细胞爬片至6孔板,培养12 h,分别加入正常培养基和含腺苷终浓度为2 mmol·L-1的培养基,孵育36 h。弃培养基,室温下用4%多聚甲醛固定6 min,0.2%Triton-X 100 穿孔5 min,2%BSA 封闭30 min。分别加入抗GRP78,胱天蛋白酶4,胱天蛋白酶 3,CHOP和 NF-κB及 β 肌动蛋白抗体(1∶100),4℃过夜,PBS洗3次。加入相应的荧光标记二抗(1∶50),室温60 min,DAPI染核10 min,进行荧光拍照。根据荧光强度调节曝光时间(同组曝光时间相同)。应用SimplePCI图像软件将胞浆和胞核荧光图像进行融合,与正常对照组进行对比并分别做好标记,荧光颗粒即为阳性表达,观察该蛋白是否出现表达并进行亚细胞定位[5-7]。
1.6 Western印迹法检测内质网应激相关蛋白的表达
取5瓶25cm2长满80%的EC109细胞,分对照组和药物处理组,分别加腺苷0~4.0 mmol·L-1的培养基。孵育36 h,弃培养基,冷PBS洗3次。加含蛋白酶抑制剂PMSF的裂解液150 μl,冰上作用20 min。收集细胞,超声裂解30循环。4℃,13400×g离心10 min,收集上清,存于-80℃。取等量蛋白(100 μg)上样,SDS-聚丙烯酰胺凝胶电泳,湿式法转膜。分别加入抗GRP78、胱天蛋白酶 4、胱天蛋白酶 3、CHOP、NF-κB和 β 肌动蛋白抗体(1∶400),4℃ 过夜,TBS洗膜3次;加入相应二抗(1∶4000)孵育1~2 h,TBS洗膜3次;使用ABC试剂盒混合液(A液∶B液∶PBS=1∶1∶500)孵育 30 min,再次 TBS洗膜 3 次,ECL法发光,暗室曝光。采用凝胶分析软件Quantity One(美国Bio-Rad公司)进行半定量分析,各电泳条带积分吸光度(integrated absorbance,IA)与内参照β肌动蛋白IA的比值表示各蛋白的相对表达量。实验重复3次。
1.7 统计学分析
2 结果
2.1 腺苷对EC109细胞存活的影响
腺苷 2 mmol·L-1与 EC109 细胞作用 24,36,48和72 h,细胞存活率呈时间依赖性下降(r=0.9192,P<0.01)(图1A)。72 h时细胞存活率最低,但由于干扰因素较多,除细胞凋亡外还伴有部分坏死,因此后续实验选用36 h作为药效观察时间。腺苷0.5,1,2 和4 mmol·L-1处理 EC109 细胞 36 h,随药物浓度增加,细胞存活率呈浓度依赖性降低(r=0.8252,P <0.01)(图1B)。
2.2 腺苷对EC109细胞凋亡的影响
腺苷 0.5,1,2 和 4 mmol·L-1处理 EC109 细胞36 h,所有腺苷处理组均出现凋亡细胞(图2)。400倍显微镜下,每组随机选取10个视野进行细胞分类并计数。由表1结果表明,随腺苷浓度升高,细胞凋亡率明显升高(r=0.874,P <0.05)。
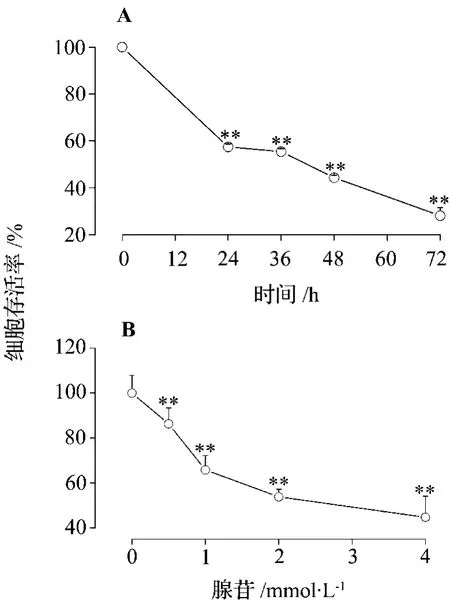
图1 腺苷对EC109细胞存活的影响.A:腺苷2 mmol·L-1与EC109细胞作用不同时间;B:不同浓度腺苷与EC109细胞作用36 h.**P <0.01,与正常对照组比较.Fig.1 Effect of adenosine on EC109 cell survival.
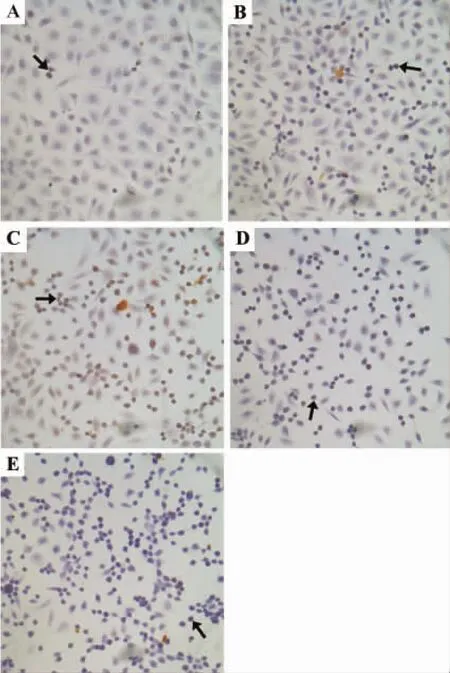
图2 腺苷与EC109细胞孵育36 h对细胞凋亡的影响(TUNEL ×400).A:正常对照;B,C,D 和E:腺苷0.5,1,2和4 mmol·L-1.箭头所指为凋亡细胞.Fig.2 Effect of adenosine on apoptosis of EC109 cells after cultured for 36 h(TUNEL ×400).

表1 腺苷对EC109细胞凋亡的影响Tab.1 Effect of adenosine on apoptosis of EC109 cells
2.3 腺苷对EC109细胞内质网应激相关蛋白的表达及亚细胞定位的影响
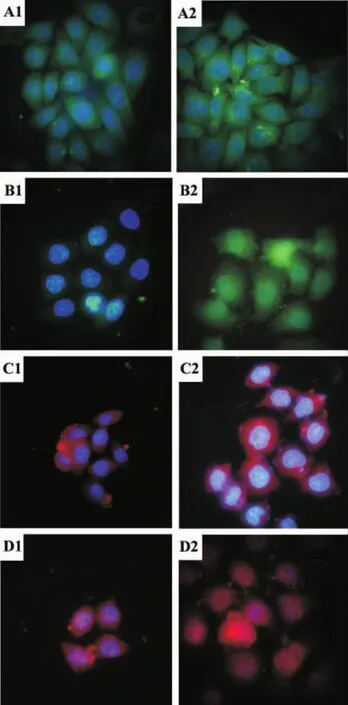
图3 腺苷对EC109细胞葡萄糖调节蛋白78(GRP78)(A),胱天蛋白酶4(B),胱天蛋白酶3(C),转录因子CHOP(D)表达与亚细胞定位的影响 (免疫荧光,×1000).1.正常对照组;2.腺苷处理组,腺苷2 mmol·L-1作用细胞36 h.Fig.3 Effect of adenosine on expression and subcellular locations of glucose regulated protein 78(GRP78)(A),caspase4(B),caspase3(C)and CHOP(D)in EC109cells after cultured for 36 h(Immunofluorescence staining ×1000).
由图3所示,腺苷2 mmol·L-1与EC109细胞作用36 h,对照组细胞胞浆中出现GRP78的表达,腺苷处理组表达增多;胱天蛋白酶4,胱天蛋白酶3和CHOP在对照组细胞胞浆中无表达,而腺苷处理组胞浆和细胞核均出现表达;表明胱天蛋白酶4,胱天蛋白酶3和CHOP蛋白发生核移位。由此提示,腺苷与EC109细胞作用后内质网应激通路被激活。
2.4 腺苷对EC109细胞内质网应激相关蛋白的表达
Western印迹法检测结果(图4,表2)表明,腺苷0.5,1,2 和 4 mmol·L-1与 EC109 细胞作用 36 h,GRP78、胱天蛋白酶 4、胱天蛋白酶 3、CHOP和NF-κB蛋白表达均较对照组升高(P<0.05);随腺苷浓度升高,上述蛋白的表达均呈浓度依赖性增加(rGRP78=0.9471,r胱天蛋白酶4=0.8977,r胱天蛋白酶3=0.968,rCHOP=0.9762,rNF-κB=0.9471);提示腺苷可激活EC109细胞内质网应激死亡通路。
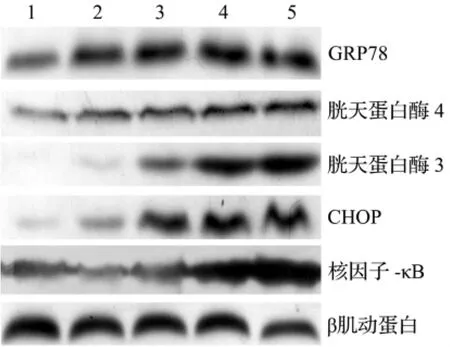
图4 腺苷与EC109细胞作用36 h对内质网应激相关蛋白表达的影响.泳道1~5分别为腺苷0,0.5,1,2和4 mmol·L-1组.Fig.4 Effect of adenosine on expressions of endoplasmic reticulum stressrelated proteinsin EC109 cellsafter cultured for 36 h.
3 讨论
Maaser等[8]报道,腺苷可抑制食管癌 Kyse-140细胞生长,但其机制尚未阐明。本研究结果表明,腺苷能降低食管癌EC109细胞的存活率,并呈时间和浓度依赖性。另外,腺苷亦可浓度依赖性地促进EC109细胞凋亡。
内质网是细胞内重要的细胞器,是调节蛋白质合成及合成后折叠和聚集的场所,是调节细胞应激反应及细胞钙水平的部位。在多种生理或病理条件下,当细胞受到药物、射线导致基因损伤等各种刺激时会引起未折叠蛋白或错误折叠蛋白在内质网聚集,称为内质网应激。内质网应激可以分为2个阶段,早期的非折叠蛋白反应(unfolded protein response,UPR)[9]及晚期的诱导凋亡。内质网通过UPR以保护由内质网应激所引起的细胞损伤,恢复细胞功能。一旦损伤过于严重,内环境稳定不能及时得到恢复,则内质网应激信号由促生存向促凋亡方向转换。这些作用既能为受损细胞提供修复机会,又能最大限度地清除过度损伤的细胞,以维护机体的生理平衡和内环境的稳定[10-11]。UPR主要由内质网分子伴侣 GRP78蛋白所介导。本研究用免疫荧光法检测结果表明,正常对照组EC109细胞胞浆中出现GRP78的表达,腺苷处理组表达增多;Western印迹法检测亦发现,腺苷处理EC109细胞后GRP78的表达亦较正常对照组明显增加,并呈现浓度依赖性;由此表明,经腺苷处理后EC109细胞发生了内质网应激反应。
一般认为,内质网应激可通过胱天蛋白酶4及CHOP等途径激活下游基因,最终通过效应胱天蛋白酶3而引发细胞凋亡。CHOP也称为GADD153,是一种核转录因子,可抑制Bcl-2的启动,在正常的细胞中低表达[12]。CHOP/GADD153基因可因内质网应激而激活,并伴mRNA及蛋白水平表达升高[13]。据报道,UPR 可上调 CHOP/GADDI53,通过减少Bcl-2蛋白表达而提高线粒体对促凋亡因子的敏感性[14-15]。CHOP通过活化胱天蛋白酶9前体、启动胱天蛋白酶级联反应最终诱导细胞凋亡[16]。胱天蛋白酶4则可直接活化下游效应基因胱天蛋白酶3触发凋亡[17-18]。本研究通过免疫荧光法检测,观察到腺苷处理后胱天蛋白酶4、胱天蛋白酶3及CHOP均明显增加,并发现从胞浆转入胞核;蛋白质免疫印迹法检测亦发现,胱天蛋白酶4、胱天蛋白酶3及CHOP的表达均随腺苷浓度的增加而增加。据报道,内质网应激时激活的CHOP/GADD153表达增加,而且其表达水平与细胞凋亡率成正比[19]。本研究亦观察到腺苷处理后EC109细胞随药物浓度升高而凋亡率增加,与上述结果一致,表明CHOP、胱天蛋白酶4和胱天蛋白酶3活化即内质网通路参与了腺苷诱导细胞凋亡过程。已有研究报道腺苷对肝癌HepG2细胞增殖亦有抑制作用,而且与内质网凋亡通路有关[5]。本研究提示,腺苷对食管鳞状上皮癌细胞亦有类似作用,这扩大了对腺苷药物作用范围的认识。
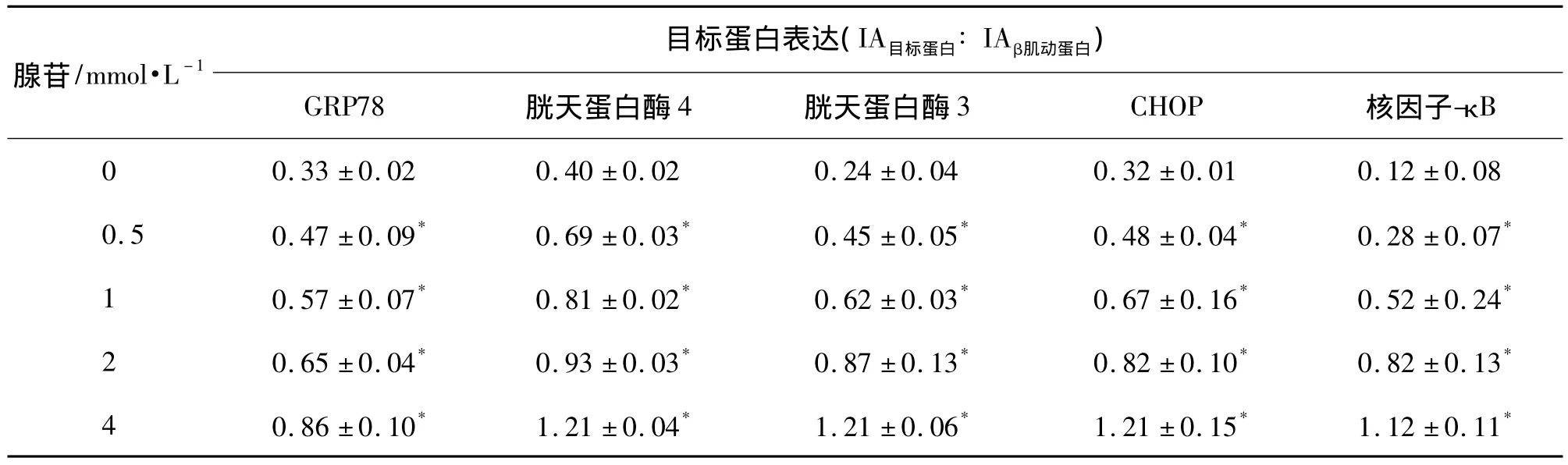
表2 腺苷与EC109细胞作用36 h对内质网应激相关蛋白表达的影响Tab.2 Effect of adenosine on expressions of endoplasmic reticulum stress related proteins in EC109 cells after cultured for 36 h
NF-κB在调节细胞凋亡方面的作用是复杂的,有些研究显示其促进细胞生存[20-21],有些则提示其促进细胞凋亡[22]。本研究结果表明,腺苷在引起内质网应激时NF-κB被明显激活,并且呈浓度依赖性,进一步提示内质网通路参与了腺苷诱导细胞凋亡的过程。
[1]Luo C,Yi B,Tao G,Li M,Chen Z,Tang W,et al.Adenosine A3 receptor agonist reduces early brain injury in subarachnoid haemorrhage[J].Neuroreport,2010,21(13):892-896.
[2]Kim H,Kang JW,Lee S,Choi WJ,Jeong LS,Yang Y,et al. A3 adenosine receptor antagonist, truncated thio-Cl-IB-MECA,induces apoptosis in T24 human bladder cancer cells[J].Anticancer Res,2010,30(7):2823-2830.
[3]Taha R,Seidman E,Mailhot G,Boudreau F,Gendron FP,Beaulieu JF,et al.Oxidative stress and mitochondrial functions in the intestinal Caco-2/15 cell line[J].PLoS One,2010,5(7):e11817.
[4]Wu LF,Li GP,Feng JL,Pu ZJ.Molecular mechanisms of adenosine-induced apoptosis in human HepG2 cells[J].Acta Pharmacol Sin,2006,27(4):477-484.
[5]叶艳清,李国平,蒲泽锦,黄官友,冯家琳,韦碧柳,等.腺苷通过内质网应激途径诱导HepG2细胞凋亡的研究[J].中国药理学通报,2010,26(5):596-601.
[6]胡乐鹏,夏志平,徐翠平,刘存霞,李志萍,李 勇,等.狂犬病病毒SRV-9株对小鼠脑神经原代细胞的感染及毒力观察[J].中国兽医科学,2011,41(1):5-8.
[7]魏 巍,高 岚,张菲菲,崔礼鑫,谢 欣.人趋化因子受体CCR6在HEK293细胞内的稳定表达及其功能分析[J].细胞与分子免疫学杂志,2011,27(1):33-35,39.
[8]Maaser K,Höpfner M,Kap H,Sutter AP,Barthel B,von Lampe B,et al.Extracellular nucleotides inhibit growth of human oesophageal cancer cells via P2Y(2)-receptors[J].Br J Cancer,2002,86(4):636-644.
[9]Ma Y,Hendershot LM.The role of the unfolded protein response in tumour development:friend or foe[J]?Nat Rev Cancer,2004,4(12):966-977.
[10]Sundar Rajan S,Srinivasan V,Balasubramanyam M,Tatu U.Endoplasmic reticulum(ER)stress and diabetes[J].Indian J Med Res,2007,125(3):411-424.
[11]Li J,Lee B,Lee AS.Endoplasmic reticulum stress-induced apoptosis:multiple pathways and activation of p53-up-regulated modulator of apoptosis(PUMA)and NOXA by p53[J].J Biol Chem,2006,281(11):7260-7270.
[12]McCullough KD, Martindale JL, Klotz LO,Aw TY,Holbrook NJ.Gadd153 sensitizes cells to endoplasmic reticulum stress by down-regulating Bcl2 and perturbing the cellular redox state[J].Mol Cell Biol,2001,21(4):1249-1259.
[13]Price BD,Calderwood SK.Gadd45 and Gadd153 messenger RNA levels are increased during hypoxia and after exposure of cells to agents which elevate the levels of the glucose-regulated proteins[J].Cancer Res,1992,52(13):3814-3817.
[14]Häcki J,Egger L,Monney L,Conus S,Rossé T,Fellay I,et al.Apoptotic crosstalk between the endoplasmic reticulum and mitochondria controlled by Bcl-2[J].Oncogene,2000,19(19):2286-2295.
[15]Milhavet O, Martindale JL, Camandola S,Chan SL,Gary DS,Cheng A,et al.Involvement of Gadd153 in the pathogenic action of presenilin-1 mutations[J].J Neurochem,2002,83(3):673-681.
[16]Ma J,Qiu Y,Yang L,Peng L,Xia Z,Hou LN,et al.Desipramine induces apoptosis in rat glioma cells via endoplasmic reticulum stress-dependent CHOP pathway[J].J Neurooncol,2011,101(1):41-48.
[17]Kerbiriou M,Teng L,Benz N,Trouvé P,Férec C.The calpain,caspase 12,caspase 3 cascade leading to apoptosis is altered in F508del-CFTR expressing cells[J].PLoS One,2009,4(12):e8436.
[18]Rao RV, Hermel E, Castro-Obregon S, del Rio G,Ellerby LM,Ellerby HM,et al.Coupling endoplasmic reticulum stress to the cell death program.Mechanism of caspase activation[J].J Biol Chem,2001,276(36):33869-33874.
[19]Althausen S,Paschen W.Homocysteine-induced changes in mRNA levels of genes coding for cytoplasmic-and endoplasmic reticulum-resident stress proteins in neuronal cell cultures[J].Brain Res Mol Brain Res,2000,84(1-2):32-40.
[20]Koulich E,Nguyen T,Johnson K,Giardina C,D'mello S.NF-kappaB is involved in the survival of cerebellar granule neurons:association of IkappaBbeta[correction of Ikappabeta]phosphorylation with cell survival[J].J Neurochem,2001,76(4):1188-1198.
[21]Wu LF,Li GP,Su JD,Pu ZJ,Feng JL,Ye YQ,et al.Involvement of NF-kappaB activation in the apoptosis induced by extracellular adenosine in human hepatocellular carcinoma HepG2 cells[J].Biochem Cell Biol,2010,88(4):705-714.
[22]Mattson MP,Culmsee C,Yu Z,Camandola S.Roles of nuclear factor kappaB in neuronal survival and plasticity[J].J Neurochem,2000,74(2):443-456.

