负压创面治疗技术早期应用对软组织爆炸伤创面作用的研究
钱玉鑫 芦立轩 侯强 江华 张文俊 刘安堂
爆炸伤导致软组织缺损严重,伤道周围及深面存有泥沙、爆炸物碎屑、毛发等异物,清创后感染发生率高[1];爆炸伤患者严重创伤后免疫反应受到抑制,容易出现严重感染及其他并发症[2]。负压创面治疗技术(NPWT)自上世纪90年代以来,已被证实具有较强的预防和控制感染能力,并能促进肉芽生长。本研究通过动态观察组织内细菌量及组织学观察肉芽生长情况,探讨NPWT早期应用对于控制软组织爆炸伤创面感染及促进肉芽生长的作用。
1 材料和方法
1.1 材料
健康家猪(n=5),第三军医大学野战外科研究所动物中心提供,体质量30~35 Kg,雌雄不限;NPWT敷料由医用聚氨酯海绵(孔径400~600 μm,厚度2 cm,大小10 cm×15 cm)、三通接头(GL-200)、引流管医用贴膜(3M)、负压泵(YB-DX230型电动吸引器,上海医疗器械工业公司)构成。
1.2 实验方法
1.2.1 猪软组织爆炸伤模型建立
采用两根600 mg瞬发纸质电雷管并列致伤,间距2 cm。皮肤与爆炸源之间垫放0.5 cm厚海绵,固定后人员撤离,电起爆致伤。致伤部位选择肌肉丰满处,臀部致伤位置为髂前上棘后侧4 cm,肩胛部致伤位置距背中线10 cm。每只动物致伤4个部位(双侧臀部和双侧肩胛部),每次致伤1个部位。
1.2.2 动物清创治疗及分组
3只家猪随机分为一侧NPWT组,对侧为纱布敷料组,每组6个创面;另选取两只家猪形成的6个创面设为暴露组。致伤后6 h,暴露组送回动物房固定饲养,NPWT组及纱布敷料组行创面清创。去除表面坏死组织,搔刮至组织新鲜出血。双氧水、洗必泰、生理盐水冲洗创面,消毒创面周围正常皮肤。按实验分组进行创面包扎。纱布组:外层凡士林纱布、内层无菌干纱布覆盖,并将纱布固定于周围皮肤。NPWT组:制备、安放NPWT敷料,调节负压至-125 mmHg,检查贴膜的气密性。
1.2.3 大体观察
观察创面色泽、肿胀情况、分泌物的颜色及数量,并拍照留档。
1.2.4 组织学观察
伤后6 h和治疗后第3、5、7天,自创面中心取10 mm×10 mm×10 mm大小组织块,福尔马林固定,石蜡包埋,5 μm厚度制片,常规HE染色,显微镜观察组织损伤、炎症浸润及肉芽生长情况。
1.2.5 创面组织细菌计数
伤后6 h和治疗后第3、5、7天取材。取材前生理盐水纱布擦拭创面,除去渗液及坏死组织,以无菌方法取创面中央组织,大小约2 mm×2 mm×2 mm,称重后玻璃匀浆器制成1.0 mL的匀浆液,按l:l0进行不同比例稀释,于各梯度取0.5 mL标本稀释液接种于琼脂平板上,37℃孵育24 h,计数平板上的细菌菌落。每克组织内的细菌数=菌落数×稀释倍数/标本重量,单位cfu/g(cfu:colony-forming unit,菌落形成单位)。
1.2.6 动物饲养
清创后动物自制五孔板固定笼内饲养。每日肌注青霉素40 000 U/Kg。
1.3 统计方法
2 结果
2.1 创面大体观察
伤后第3天:NPWT组局部可见新生肉芽组织,创面湿润,分泌物少(图1A)。纱布组组织水肿,创面基底凹凸不平,创面可见坏死肌肉组织,表面少量脓性分泌物(图1B)。暴露组创周红肿明显,创面内渗液,异味明显;创缘可见1~2 cm皮缘发黑,呈烧灼样损伤;创面基底局部肌肉外露,质软色暗红,夹之不收缩,切割不出血(图1C)。
伤后第5天:NPWT组创面肉芽新鲜,色红,稍水肿,触之易出血(图2A)。纱布组创面深度较前稍加深,局部肌肉组织坏死,少部分肉芽生长,苍白水肿(图2B)。暴露组创面较前扩大,痂皮未见溶解;创面渗液多,异味明显,创周红肿(图2C)。
伤后第7天:NPWT组渗液少,创面内肉芽致密,组织无明显水肿(图3A)。纱布组肉芽面积较前稍增大,渗液较第5天减少(图3B)。暴露组局部痂皮溶解,下方可见少量肉芽组织,水肿质脆,表面有脓性分泌物,量多伴恶臭,创缘红肿(图3C)。
2.2 创面组织细菌计数
伤后第3天:NPWT组可见炎性细胞浸润,成纤维细胞增生,细胞水肿减退(图4A)。纱布组可见炎性细胞浸润较明显,肌细胞间有少量成纤维细胞增生(图4B)。暴露组可见大量炎性细胞浸润,部分肌纤维出现溶解坏死(图4C)。
伤后第5天:NPWT组新生肉芽鲜红,成纤维细胞增多,可见新生的微毛细血管(图5A)。纱布组炎性浸润明显,肌细胞周围较多成纤维细胞,未见微毛细血管形成,无明显肉芽生长(图5B)。暴露组组织水肿明显,肌细胞碎裂溶解,伴有大量炎性细胞浸润(图5C)。
伤后第7天:NPWT组肉芽组织致密,炎性细胞少,可见成形血管(图6A)。纱布组肉芽组织疏松,可见微毛细血管形成(图6B)。暴露组大片肌细胞溶解坏死,呈空泡状,细胞结构消失,炎症明显(图6C)。
2.3 创面组织细菌计数
治疗前各组间细菌数无明显差异。治疗后各时间段NPWT组细菌计数均较纱布组、暴露组数值小,统计学差异显著(表1)。NPWT治疗后第3天后计数为(3.282±0.336)×105cfu/g,以后随时间延长计数不再增加;第5天细菌计数降至感染临界水平以下。纱布组第5天细菌计数达到峰值,后缓慢下降。暴露组细菌计数逐渐增高,第7天达到109cfu/g水平,感染严重(图7)。
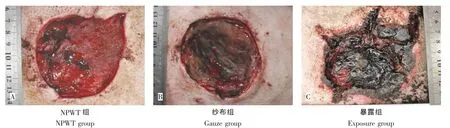
图1 治疗后第3天创面大体观Fig.1The gross observation 3 days after treatment

图2 治疗后第5天创面大体观Fig.2The gross observation 5 days after treatment

图3 治疗后第7天创面大体观Fig.3The gross observation 7 days after treatment

图4 治疗后第3天创面组织HE染色(400×)Fig.4HE staining observation 3 days after treatment(400×)
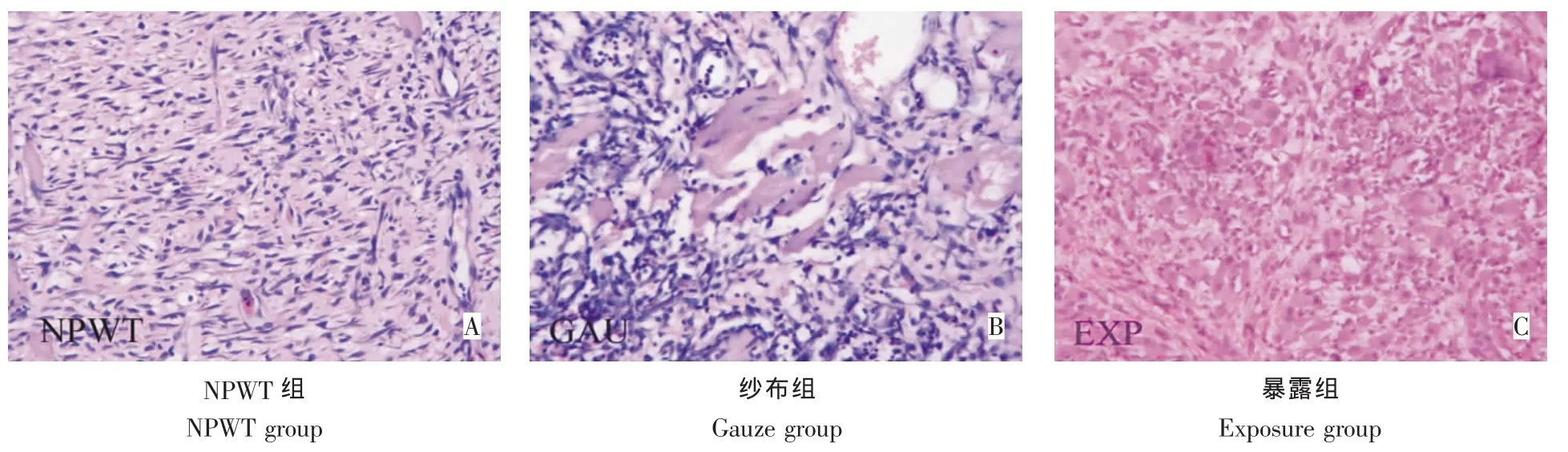
图5 治疗后第5天创面组织HE染色(200×)Fig.5HE staining observation 5 days after treatment(200×)

图6 治疗后第7天创面组织HE染色(200×)Fig.6HE staining observation 7 days after treatment(200×)

图7 创面组织细菌计数Fig.7Wound organization bacterial count
表1 不同时间点各组细菌计数(±s,×105cfu/g)Table 1Bacterial counts of specimens from each group at different time points(±s,×105cfu/g)

表1 不同时间点各组细菌计数(±s,×105cfu/g)Table 1Bacterial counts of specimens from each group at different time points(±s,×105cfu/g)
NPWT group(n=6)Gauze group(n=6)Exposure group(n=6)6 hours0.095±0.0150.101±0.0170.102±0.015 3 days after treatment3.282±0.33652.320±5.362268.263±28.416 5 days after treatment0.539±0.07593.457±7.4041 479.266±142.044 7 days after treatment0.096±0.02146.621±4.49110 197.759±941.823
3 讨论
上世纪50年代开始,细菌计数被认为能直观并准确地反映创面感染程度,并进而预测组织愈合情况。细菌计数达到105cfu/g被视为是感染的临界值[3]。爆炸伤组织损伤严重,创面缺乏正常皮肤的屏障作用,水、蛋白质丢失,创面细菌感染率较高。控制感染有3个主要手段:清创、创面冲洗、特异性抗生素应用。自NPWT发明以来,大量研究发现,NPWT治疗可以降低细菌负荷[4-5]。也有部分研究观察到治疗过程中细菌计数升高,但创面临床情况改善[6]。针对这种伤口愈合而细菌负荷并未降低的现象,Moues等[7]推测,相对于细菌的数目而言,细菌的种类、性质、毒力以及机体对抗感染的能力更为重要。美军已经逐渐将NPWT运用到战伤救治中,将创面与周围战场、病室环境相隔离,有效保持创面清洁并减少创面感染。Leininger等[8]运用NPWT治疗88例高能爆炸所致软组织创面,无创面感染及并发症发生。Geiger等[9]对合并广泛软组织和骨质缺损(Ⅲ/Ⅳ级开放性骨折)的68名伊战伤员,运用NPWT进行创面准备,减少了急、慢性骨髓炎的发生。
本实验显示,NPWT早期治疗爆炸伤创面,能抑制细菌增殖,降低组织细菌负荷。各时间段NPWT组细菌计数均较纱布组、暴露组数值小。NPWT组治疗后第3天后计数为(3.282±0.336)×105cfu/g,后随时间延长,计数不再增加;第5天细菌计数降至感染临界值水平以下。NPWT早期治疗,能有效控制爆炸伤创面细菌增殖的作用机制,其可能机制是:①贴膜的屏障作用,NPWT使创面与周围环境相隔离,有效保持创面清洁并减少创面感染。与平原地区相比,高原环境下细菌增殖速度减缓,细菌计数达到107cfu/g时才出现感染,可能与低氧环境有关[10]。②负压的虹吸作用将细菌、渗液及坏死物质从创面清除,组织细菌量减少,减少条件性致病菌增殖[11]。负压产生的吸引力量减少了细菌向深面组织的侵袭,抑制了感染扩散。③减少第三间隙内液体,减轻创面水肿。软组织爆炸伤损伤严重,坏死物质及渗出多,组织水肿明显,循环阻塞引起细胞持续性坏死及组织继发性感染。NPWT治疗有效减轻组织水肿,缩短毛细血管与修复细胞之间的距离,增加氧和营养的转运,白细胞更容易外渗到达微生物定殖区域,提高了组织的抗感染能力[12]。④NPWT治疗后,组织细菌负荷减轻,避免了过度炎症反应。适度的炎症促使创面自炎症期转入为增殖期变化,肉芽组织形成,创周上皮组织向创面内迁移,增强了创面的屏障作用。
伊拉克战争中,美军已广泛应用NPWT早期治疗皮肤软组织战创伤,文献报道应用后可以减轻医护人员工作量,提高治疗效果。Morykwas等[5]证实,与湿纱布敷料相比,应用NPWT治疗家猪创面肉芽形成的体积可以增加约60%;进一步的研究表明,负压在125 mmHg时肉芽生长效果较25 mmHg或500 mmHg要好[13]。本研究通过观察爆炸伤创面肉芽生长的情况,发现NPWT组肉芽形成较其他两组更早。治疗后第3天,NPWT镜下即表现出成纤维细胞增生,水肿明显减轻;第5天时NPWT组新生肉芽鲜红,并可以见多个微毛细血管形成,而纱布组仅有少量肉芽生长;第7天时NPWT组肉芽组织致密,成形血管形成。NPWT早期治疗促进肉芽生长的作用,可能与以下因素有关:①负压作用减轻组织水肿,改善创面的供血、供氧,负压治疗后组织氧含量上升,增强细胞分化能力,并且提高成纤维细胞的增殖和迁移,调控胶原生成。②负压吸引的机械性牵张作用。细胞受到表面张力才能响应细胞因子变化发生分裂和增殖;未受牵拉时,细胞外形呈球状,细胞周期停止,并出现凋亡趋势[14]。NPWT导致创面微变形,这种变化使细胞骨架中细胞整合素发生断裂,触发了细胞内第二信使的释放(如前列腺素,磷酸肌醇,蛋白激酶C,细胞内钙),引起细胞生长、增殖和分化[15]。负压张力作用下,细胞伸展5%~20%时可以促进细胞增殖[15],毛细血管芽定向生长。③负压吸引促进创面内修复性生长因子分泌,降低创面内抑制性因子水平。NPWT能够提高创面组织内VEGF、FGF-2以及PDGF的表达[16]。VEGF、FGF-2已被证实是最强的血管新生刺激因子,VEGF主要促进毛细血管形成,FGF-2则倾向于促进小动脉形成。两者在血管新生的不同阶段起作用,共同作用可以更好地促进血管新生。FGF-2、PDGF均具有趋化及增殖作用,促进创面修复。同时,负压作用可将抑制成纤维细胞及内皮细胞的增殖的多种细胞因子、金属蛋白酶以及胶原酶,从创面中引流清除,从而使修复性生长因子更好地发挥作用。④控制感染,促进组织由炎症期向增殖期转变。感染可延长炎症反应期,妨碍肉芽组织形成。
NPWT早期应用治疗猪爆炸伤软组织缺损,能有效抑制创面细菌增殖,减轻细菌负荷,避免创面过度炎症反应;并可早期启动爆炸伤软组织创面细胞增殖过程,促进肉芽组织生长。因此,在爆炸伤伤软组织缺损创面的早期治疗中具有积极的意义。
[1]Radonic V,Giunio L,Boric T,et al.Antipersonnel mine injuries in Southern Croatia[J].Mil Med,2004,69(4):313-319.
[2]Yun HC,Branstetter JG,Murray CK.Osteomyelitis in military personnel wounded in Iraq and Afghanistan[J].J Trauma,2008,64(2 Suppl):S163-168.
[3]Robson MC.Wound infection.A failure of wound healing caused by an imbalance of bacteria[J].Surg Clin North Am,1997,77(3):637-650.
[4]Campton-Johnston S,Wilson J.Infected wound management:advanced technologies,moisture-retentive dressings,and diehard methods[J].Crit Care Nurs Q,2001,24(2):64-77.
[5]Morykwas MJ,Argenta LC,Shelton-Brown EI,et al.Vacuum assisted closure:a new method for wound control and treatment:animal studies and basic foundation[J].Ann Plast Surg,1997,38(6):553-562.
[6]Weed T,Ratliff C,Drake DB.Quantifying bacterial bioburden during negative pressure wound therapy:does the wound VAC enhance bacterial clearance[J]?Ann Plast Surg,2004,52(3):276-279.
[7]Moues CM,Vos MC,van den Bemd GJ,et al.Bacterial load in relation to vacuum-assisted closure wound therapy:a prospective randomized trial[J].Wound Repair Regen 2004;12(1):11-17.
[8]Leininger BE,Rasmussen TE,Smith DL,et al.Experience with wound VAC and delayed primary closure of contaminated soft tissue injuries in Iraq[J].J Trauma,2006,61(5):1207-1211.
[9]Geiger S,McCormick F,Chou R,et al.War wounds:lessons learned from Operation Iraqi Freedom[J].Plast Reconstr Surg,2008,122(1):146-153.
[10]何代平,李素芝,殷作明,等.高原和内地枪弹伤后细菌感染的对比研究[J].中华医院感染学杂志,2006,16(2):l77-179
[11]Kiyokawa K,Takahashi N,Rikimaru H,et al.New continuous negative-pressure and irrigation treatment for infected wounds and intractable ulcers[J].Plast Reconstr Surg,2007,120(5):1257-1265.
[12]Webb LX.New techniques in wound management:vacuum-assisted wound closure[J].J Am Acad Orthop Surg,2002,10(5):303-311.
[13]Morykwas MJ,Faler BJ,Pearce DJ,et al.Effects of varying levels of subatmospheric pressure on the rate of granulation tissue formation in experimental wounds in swine[J].Ann Plast Surg,2001,47(5):547-551.
[14]Chen CS,Mrksich M,Huang S,et al.Micropatterned surfaces for control of cell shape,position,and function[J].Biotechnol Prog,1998,14(3):356-363.
[15]Saxena V,Hwang CW,Huang S,et al.Vacuum-assisted closure:microdeformations of wounds and cell proliferation[J].Plast Reconstr Surg,2004,114(5):1086-1096.
[16]Erba P,Ogawa R,Ackermann M,et al.Angiogenesis in wounds treated by microdeformational wound therapy[J].Ann Surg,2011,253(2):402-409.

