不同年龄段牙髓组织比例及牙髓干细胞分布的实验研究
邹慧儒 YANG Xuebin Steven Brookes 秦宗长 杨 敏 何淑萍 辛 宇 张兰成
不同年龄段牙髓组织比例及牙髓干细胞分布的实验研究
邹慧儒 YANG Xuebin Steven Brookes 秦宗长 杨 敏 何淑萍 辛 宇 张兰成
目的 通过观察不同年龄段前磨牙及第三磨牙牙髓占牙齿的比例,及干细胞分布情况,评估牙齿组织工程临床适宜的选材标本。方法 临床收集不同年龄段因正畸或其他原因拔除的无龋坏、无牙周疾病等的健康前磨牙及第三磨牙,分别称重牙齿及牙髓并计算比例。扫描电镜观察牙髓表面形态。脱钙后病理切片观察,牙髓组织内成牙本质细胞层完整与否,观察细胞与纤维成分比例;阿尔新蓝-希尔红染色,偏振光显微镜观察有无双折射现象;免疫组化染色观察,间充质干细胞特异性标记物STRO-1以及成牙本质相关蛋白牙本质涎蛋白DSP的表达情况,评估牙髓干细胞在牙髓组织中的分布情况。结果 随着年龄的增长,前磨牙及第三磨牙牙髓占牙齿比例逐渐缩小,11~20岁年龄段与31~40岁、41~50岁,以及50岁以上年龄段比较,有统计学差异。扫描电镜下可见摘除的牙髓组织类似树桩,有些区域比较平滑,有些区域表面有不规则突起。牙髓组织内存在双折射。STRO-1阳性表达细胞在牙髓组织中散在分布,在血管周围较密集。DSP表达则主要集中在牙本质区域及成牙本质细胞内,牙髓内仅有少量表达。结论 随着年龄的增长,牙髓逐渐萎缩,牙髓干细胞的分布集中于血管周围,在牙髓组织内散在分布,未分化的牙髓干细胞不表达成牙本质相关蛋白DSP。
人牙髓组织 牙髓干细胞 分布 STRO-1 牙本质涎蛋白
牙髓干细胞 (Dental pulp stem cells,DPSCs)是一组在乳牙和恒牙牙髓中都存在的成体干细胞(Adult stem cells,ASCs)。研究表明,牙髓干细胞可以分化成骨、软骨、肌肉、神经,以及形成牙髓牙本质复合体等,可以作为机体多个脏器或组织再生所需的组织工程种子细胞来源[1-4]。牙髓内广泛存在着牙髓干细胞,但是牙髓干细胞在不同年龄段的牙髓内的分布情况尚不清楚。本实验旨在收集不同年龄段的健康前磨牙及第三磨牙,采集牙髓组织,测算牙髓占牙齿比例,观察牙髓组织形态、细胞及纤维构成,通过检测干细胞相关标记物STRO-1和成牙本质细胞相关蛋白牙本质涎蛋白 (Dentine sialoprotein,DSP)的表达,检测在不同年龄段的牙髓组织内牙髓干细胞的分布情况。
1 材料和方法
1.1 材料
利兹大学口腔医院及天津市口腔医院口腔外科门诊因正畸或其他原因拔除的健康前磨牙及第三磨牙的新鲜标本。
1.2 主要试剂和仪器
STRO-1、DSP鼠抗人单克隆抗体(SantaCruz,USA)及免疫组化染色试剂盒(EnVision System,Japan);电子称重仪、组织切片机、偏振光显微镜、扫描电子显微镜。
1.3 牙髓占牙齿比例测定
收集不同年龄段 (11~20岁、21~30岁、31~40岁、41~50岁,以及50岁以上)因正畸或其他原因拔除的无龋坏、无牙周疾病等的健康前磨牙或第三磨牙,清理干净牙齿表面污秽以及颈部牙龈或根面牙周膜附着之后,称重牙齿并记录,打开髓腔取出牙髓称重记录。分别称取3次,记录平均值,并计算牙髓占牙齿比例。汇总结果,对不同年龄段牙髓占牙齿比例进行统计学分析。
1.4 扫描电镜观察
牙齿离体后立即用生理盐水清洗,打开髓腔取出牙髓,10%中性福尔马林液固定24 h;50%~100%乙醇系列脱水:50%乙醇30 min,60%乙醇30 min,70%乙醇30 min,80%乙醇30 min,90%乙醇30 min,100%乙醇3次,每次30 min,空气干燥过夜;喷金镀膜,扫描电镜观察牙髓表面超微形态。
1.5 组织学观察
牙齿离体后生理盐水清洗,10%中性福尔马林液固定24 h;14%EDTA(pH7.0)脱钙2~3个月,X线片证实牙齿组织脱钙完全;50%~100%乙醇系列脱水(同前),之后浸入二甲苯2次,每次60 min;石蜡浸润2次,每次60 min;石蜡包埋,切片(厚度4 μm),HE染色,观察牙髓组织内成牙本质细胞层完整与否、细胞与纤维构成情况;阿尔新蓝-希尔红染色,偏振光显微镜观察有无双折射现象。
1.6 免疫组化染色
牙齿标本切片烘干,脱蜡,蒸馏水洗2次,2%辣根过氧化物酶作用20 min,PBS洗5 min,高压锅法暴露抗原,5%羊血清封闭20 min,PBS洗5 min,加入一抗STRO-1(1∶200),DSP(1∶400)孵育1 h,PBS洗5 min,采用EnVision System。EnVision A液30 min,PBS洗5 min,EnVision B+C液5 min,观察显色反应。清水冲洗,苏木素复染2 min,DPX封片,显微镜下观察STRO-1及DSP表达情况。
2 结果
2.1 牙髓占牙齿比例
不同年龄段牙髓占牙齿比例由1.056%~4.826%不等,其中11~20岁第三磨牙牙髓占牙齿比例最高,为(4.826±0.017)%;50岁以上年龄段前磨牙牙髓占牙齿比例最低,为(1.056±0.044)%。对不同年龄段前磨牙及第三磨牙分组进行统计学分析结果显示,11~20岁与21~30岁年龄段前磨牙牙髓占牙齿比例比较,P>0.05;11~20岁与31岁之后的各年龄段前磨牙牙髓占牙齿比例相比,P<0.001;11~20岁与21~30岁第三磨牙牙髓占牙齿比例比较,P<0.01;11~20岁与31岁之后的各年龄段第三磨牙牙髓占牙齿比例比较,P<0.001。随着年龄的增加,牙髓占牙齿比例逐渐减少,但是40~50岁与50岁以上前磨牙牙髓占牙齿比例比较,P>0.05,40~50岁与 50岁以上第三磨牙牙髓占牙齿比例比较,P<0.05(图1)。
2.2 扫描电镜观察
扫描电镜观察可见,部分牙髓类似树桩,有些区域比较平滑,有些区域表面有不规则突起,可能是成牙本质细胞突起的近髓断端;还可以观察到细长的管状结构疑似牙髓细小分支(图2)。
2.3 牙髓组织学观察
HE染色可见冠部牙髓残留成牙本质细胞,但是成牙本质细胞突起不完全(图3)。冠方牙髓组织中细胞成分较多,纤维成分较少;根部牙髓组织中细胞成分较少,纤维成分较多。阿尔新蓝-希尔红染色示牙本质呈红色,成牙本质细胞层及部分牙髓组织呈蓝色,部分牙髓呈纤维结构,呈红色。偏振光显微镜可见牙本质及部分牙髓呈双折射现象(图4)。
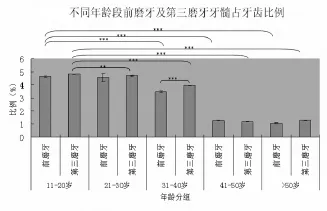
图1 不同年龄段前磨牙及第三磨牙牙髓占牙齿比例(**:P<0.01;***:P<0.001)Fig.1 Dental pulp/tooth ratio of premolars and third molars from different age groups(**:P<0.01;***:P<0.001)

图2 扫描电镜下摘除的牙髓表面形态(标尺:200 μm)Fig.2 The surface morphology of the extracted dental pulp tissue(scale bar:200 μm)
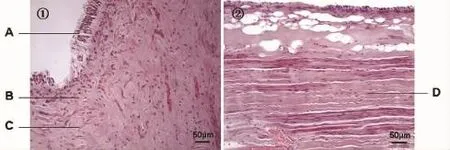
图3 冠方及根部牙髓组织(HE染色,200×)Fig.3 Coronal and radical pulp tissues(HE staining,200×)

图4 牙髓组织偏振光显微镜下观察(阿尔新蓝-希尔红染色,200×)Fig.3 Dental pulp tissue observation under the polarized light microscope(Alcian blue/Sirus red staining,200×)
2.4 牙髓干细胞的分布
STRO-1阳性表达细胞在牙髓组织中散在分布,在血管周围较密集,提示近血管周围存在较多的干细胞。DSP表达则主要集中在牙本质区域及成牙本质细胞内,牙髓内仅有少量表达(图5)。
3 讨论
牙髓位于由牙本质围成的牙髓腔内,由细胞、细胞间质和细胞间液组成。牙髓的细胞成分包括成牙本质细胞、成纤维细胞和防御细胞等。2000年,Gronthos等[5]首次体外成功分离培养了人牙髓干细胞,提示牙髓组织中还存在保持未分化状态的成体干细胞,这些细胞具有高度增殖分化潜能。相对于胚胎干细胞的研究,成体干细胞研究不涉及相关伦理问题及取材限制等,可以取自患者,经诱导分化后再移植回患者体内,不存在免疫排斥问题[6-8]。因此,成体干细胞的研究具有广阔前景。但是,随着供体年龄的增长,成体干细胞是否存在数量及活性上的变化,是否影响到将来临床应用的效果,这些问题都有待进一步研究。本实验收集了门诊因正畸或其他原因拔除的健康前磨牙及第三磨牙,并按照年龄段分组,统计结果显示,50岁以上年龄段牙髓占牙齿比例很小,这可能是因为随着年龄增长,继发性牙本质不断形成,牙髓腔逐渐变小。该结果提示取年轻患者的牙齿供体可以获得较多的牙髓组织。
在许多组织中,成体干细胞与组织前体细胞常常难以区分。多数学者认为,在牙髓组织中,成体干细胞,即牙髓干细胞,可以生成该组织所有的分化细胞类型,包括成牙本质细胞、神经元细胞、防御细胞等;而前体细胞只能分化成特定的功能细胞[9]。目前的技术手段还不能准确地鉴别成体干细胞和前体细胞。形态学上,牙髓干细胞比较小,有不明显的胞浆突,通常位于小血管及毛细血管周围[10]。在牙髓干细胞的研究过程中,STRO-1常被视为牙髓干细胞未分化的标记物,而DSP常常作为成牙本质细胞分化的特异分子标记物[11-14]。有研究结果表明,在未经诱导的牙髓干细胞中,DSP只有少量弱阳性表达,诱导其向成牙本质细胞方向分化以后,可以出现阳性表达[15]。D’Souza等[16]证实,DSP出现于牙本质矿化前的年轻成牙本质细胞中,与早期分泌的前期牙本质伴随出现;DSP在成熟的前期牙本质中表达增多,而在牙本质形成过程中,牙髓基质以及其他组织和细胞中则不表达。尽管近些年来有些学者在骨、软骨等组织提取物中检测到DSP的存在,表明这些组织中也有少量的DSP表达,但是表达水平与在牙本质中相比是极其微量的[17-19]。因此,目前仍然将DSP作为成牙本质细胞特异性标记物来进行相关检测。本实验中,STRO-1表达阳性的细胞主要集中在牙髓组织血管周围;而DSP表达阳性的细胞主要是成牙本质细胞,以及近成牙本质细胞层区域的牙髓组织。STRO-1阳性细胞不表达DSP,而DSP阳性细胞不表达STRO-1,这一结果也验证了STRO-1表达阳性代表的牙髓干细胞与DSP表达阳性代表的成牙本质细胞或成牙本质前体细胞在牙髓组织中的分布情况。
对牙髓干细胞在牙髓组织中的分布一直存在着不同的认识,有研究比较了人牙冠髓与根髓培养细胞的特性,从培养成功率、细胞贴壁率、细胞活性、增殖特性、细胞形态以及细胞诱导矿化能力等多方面探讨了牙髓干细胞在牙髓组织中的定位。结果发现,培养的根髓细胞相比冠髓细胞具有较高的成功率及贴壁率,较强的细胞活性,以及相同的增殖活性;根髓细胞相比冠髓细胞,形态更具有原始性,更易诱导矿化[9]。本实验发现冠髓细胞排列疏松错落,根髓细胞排列条理有序,在组织形态上显示出差异。冠髓残留有成牙本质细胞,但是该成牙本质细胞不完全,细长的成牙本质细胞突起部分缺失,通过扫描电镜及组织学染色先后得到证实。牙髓某些区域偏振光显微镜下呈现双折射现象,而某些区域则没有双折射现象,提示牙髓组织结构性质不均一。今后需要继续深入研究牙髓组织结构特点以及细胞的功能与活性。
本实验通过检测STRO-1及DSP在牙髓组织内的表达,为牙齿组织工程供体研究提供了牙髓组织及牙髓干细胞分布等相关信息,为供体选择提供了一定的依据,具有积极的理论意义和潜在的临床参考价值。
[1] Alliot-Licht B,Bluteau G,Magne D,et al.Dexamethasone stimulates differentiation of odontoblast-like cells in human dental pulp cultures[J].Cell Tissue Res,2005,321(3):391-400.
[2] Yuan GH,Yang GB,Wu LA,et al.Potential role of dentin sialoprotein by inducing dental pulp mesenchymal stem cell differentiation and mineralization for dental tissue repair[J].Dent Hypotheses,2010,1(2):69-75.
[3] Lee SH,Ryu JS,Lee JW,et al.Comparison of ganglioside expression between human adipose-and dental pulp-derived stem cell differentiation into osteoblasts[J].Arch Pharm Res,2010,33(4): 585-591.
[4] Arthur A,Rychkov G,Shi S,et al.Adult human dental pulp stem cells differentiate toward functionally active neurons under appropriate environmental cues[J].Stem Cells,2008,26(7):1787-1795.
[5] Gronthos S,Mankani M,Brahim J,et al.Postnatal human dental pulp stem cells(DPSCs)in vitro and in vivo[J].Proc Natl Acad Sci USA,2000,97(25):13625-13630.
[6] de Wert G,Mummery C.Human embryonic stem cells:research,ethics and policy[J].Hum Reprod,2003,18(4):672-682.
[7] Taura D,Noguchi M,Sone M,et al.Adipogenic differentiation of human induced pluripotent stem cells:comparison with that of human embryonic stem cells[J].FEBS Lett,2009,583(6):1029-1033.
[8] Nakashima M,Iohara K,Sugiyama M.Human dental pulp stem cells with highly angiogenic and neurogenic potential for possible use in pulp regeneration[J].Cytokine Growth Factor Rev,2009,20 (5-6):435-440.
[9] 刘少华,魏奉才,孙善珍,等.牙髓培养细胞特性与牙髓干细胞定位[J].上海口腔医学,2004,13(2):106-109.
[10] 王亦菁,宋九余,段娇红,等.牙髓干细胞在牙髓组织中分布的研究[J].临床口腔医学杂志,2009,25(8):462-464.
[11] Gronthos S,Arthur A,Bartold PM,et al.A method to isolate and culture expand human dental pulp stem cells[J].Methods Mol Biol, 2011,698:107-121.
[12] Yu J,He H,Tang C,et al.Differentiation potential of STRO-1+ dental pulp stem cells changes during cell passaging[J].BMC Cell Biol,2010,11(1):32.
[13] Wang J,Ma H,Jin X,et al.The effect of scaffold architecture on odontogenic differentiation of human dental pulp stem cells[J]. Biomaterials,2011,32(31):7822-7830.
[14] 杨雪超,樊明文.成体人牙髓干细胞的分离与鉴定[J].中华口腔医学杂志,2005;3(5):244-247.
[15] Chen S,Chen L,Jahangiri A,et al.Expression and processing of small integrin-binding ligand N-linked glycoproteins in mouse odontoblastic cells[J].Arch Oral Biol,2008,53(9):879-889.
[16] D'Souza RN,Cavender A,Sunavala G,et al.Gene expression patterns of murine dentin matrix protein 1(Dmp1)and dentin sialophosphoprotein(DSPP)suggest distinct developmental functions in vivo [J].J Bone Miner Res,1997,12(12):2040-2049.
[17] Prasad M,Butler WT,Qin C.Dentin sialophosphoprotein in biomineralization[J].Connect Tissue Res,2010,51(5):404-417.
[18] Yamakoshi Y.Dentinogenesis and dentin sialophosphoprotein (DSPP)[J].J Oral Biosci,2009,51(3):134-142.
[19] Verdelis K,Ling Y,Sreenath T,et al.DSPP effects on in vivo bone mineralization[J].Bone,2008,43(6):983-990.
Experimental Study on Dental Pulp Tissue Proportion and Stem Cell Distribution of Dental Pulp Tissue in Different Age Groups
ZOU Huiru1,2,YANG Xuebin2,Steven Brookes2,QIN Zongchang1,YANG Min1,HE Shuping1,XIN Yu1, ZHANG Lancheng1.1 Tianjin Stomatological Hospital,Nankai University,Tianjin 300041,China;2.Leeds Dental Institute, University of Leeds,Leeds LS2 9LU,UK.Corresponding author:ZHANG Lancheng(E-mail:lenchong_zhong@sina.com.cn).
Objective To investigate the pulp/tooth ratio and distribution of stem cells of dental pulp tissue in premolars and third molars from different age groups and assess the selection of clinical specimens for dental tissue engineering. Methods Healthy premolars and third molars of different ages were collected during removal due to orthodontic or other reasons.Both the teeth and pulp tissues were weighed and dental pulp/tooth ratio were calculated.The surface morphology of the extracted dental pulp tissue was observed under SEM.After fixed and decalcified,premolars and third molars were embedded and cut for HE staining.Then the slides were observed under the microscope to check the integrity of odontoblast cell layer and the cell/fiber distribution.Alcian blue/Sirus red staining was used and slides were observed under the polarized light microscope to check birefringence.Immunohistochemical staining was used to observe specific mesenchymal stem cell markers STRO-1 and dentin sialoprotein-DSP expression to assess the distribution of dental pulp stem cells in dental pulp tissue.Results The pulp/tooth ratio was gradually reduced with age.SEM showed the “stump-like”pulp tissue with relatively smooth in some regions and irregular protrusions in other regions.There were birefringence in the pulp tissue. STRO-1 positive cells were scattered in dental pulp tissue,and concentrated around blood vessels.DSP expression was mainly concentrated in the region of dentin and odontoblasts.Conclusion The pulp tissue shrinks with age.Dental pulpstem cells are scattered in the pulp tissue and distributed mainly around the blood vessels.Undifferentiated dental pulp stem cells do not express odontoblast-related.
Human dental pulp tissue;Dental pulp stem cells;Distribution;STRO-1;Dentin sialoprotein
Q813.1+1
A
1673-0364(2011)06-0306-05
2011年9月5日;
2011年10月12日)
10.3969/j.issn.1673-0364.2011.06.002
300041 天津市 南开大学附属口腔医院,天津市口腔医院(邹慧儒,秦宗长,杨敏,何淑萍,辛宇,张兰成);Leeds Dental Institute,University of Leeds,Leeds LS2 9LU,UK.(利兹大学口腔研究所)(邹慧儒,YANG Xuebin,Steven Brookes)。
张兰成(E-mail:lenchong_zhong@sina.com.cn)。

