肝脏孤立性坏死结节的CT、MRI表现与病理对照研究
林光武 王立侠 嵇 鸣
肝脏孤立性坏死结节(solitary necrotic nodule of the liver,SNN)是一种罕见的肝脏良性病变,1983年由Shepherd等[1]首次报道。由于SNN病变中含有大量凝固性坏死物质,影像学检查及穿刺活检极易误诊为肝脏转移性或原发性肿瘤[2-3]。为此,笔者搜集29例经CT、MRI检查的SNN病例,探讨SNN的病理分型、各型的CT和MRI表现及其诊断价值和病理基础,以提高对该病的认识。
方 法
1.病例资料
搜集2004年5月至 2011年3月行CT、MR检查并经手术病理证实的29例SNN,其中男性18例(62%),女性11例(38%),年龄 43~70岁,中位年龄51岁。19例患者无临床症状,经查体发现;6例患者因右上腹不适,超声检查时发现;4例因卵巢囊性病变就诊时发现。实验室检查:所有病例甲胎蛋白、乙肝表面抗原均为阴性,肝功能、血白细胞计数正常。全部病例均经MRI检查,其中15例经CT检查。
2.检查设备及参数
2.1 CT检查(15例):采用GE LightspeedUltra多层螺旋CT扫描机,检查前4~6h禁食、禁饮,扫描前口服阳性对比剂或水500~800 ml,或用少量水服入产气粉6g。患者取仰卧位,扫描范围由左膈顶至双肾下极平面,层厚 1.25mm,重建层厚5mm,螺距0.875:1,电压120kV,电流230mA。增强扫描用高压注射器以3ml/s的速度经肘静脉注射非离子型对比剂(300mgI/ml)100ml,于注药后 25s、55~60s、90s扫描,获得肝动脉期、门静脉期、平衡期图像,同时在adw 4.2工作站行多平面重建(MPR)。
2.2 MRI检查 (29例):采用GE公司的Signa Excite 3.0T HD磁共振扫描仪,使用8通道体部包裹线圈(8ws TORSOPA coil)行全肝MR平扫和3D LAVA动态增强扫描。MRI平扫序列包括BH Ax T1WI FSPGR Dual:2D模式,TR 250ms,TE 2.5ms,翻转角 80°,带宽83.3Hz,FOV 38×38,相位FOV 0.9,矩阵 288×192,NEX 0.8,频率方向为R/L,层厚8mm,间距 0.8mm,扫描22层,1次采集,扫描时间为19s。Ax fs T2RTr和Ax T2RT:FSE-XL序列,2D模式,T2WI脂肪抑制应用化学饱和法。TR6000~7000ms,T E100~130ms,回波链长度17~20,带宽31.25~62.5Hz,FOV38×32,相位FOV0.75,矩阵288×224,NEX2.00,频率方向为 R/L,层厚 8.0mm,间距0.8mm,扫描22层,1次采集,扫描时间为 140~170s。采用LAVA序列行动态强扫描:3D模式,T R2.7ms,TE1.3ms,Asset 2.5ph,翻转角 12°,带宽125.00Hz,FOV44×36,矩阵为280×180,相位FOV0.95,频率方向为S/I,横断位全肝扫描40层,层厚4.4mm(重建 2.2mm),扫描时间为 7s,重建72层图像。观察BH LAVA Fast(LAVA蒙片)扫描范围及图像质量,如扫描野及图像质量均符合扫描标准即复制LAVA蒙片扫描参数,用高压注射器以0.1 mmol/kg体重的剂量(总量不超过20ml)、3ml/s的速度快速注入,后再注入相同量的盐水冲洗,扫描时相为动脉期(25~35s)、门脉期(60~70s)、延迟期(5~10min)。
3.SNN诊断
按文献[4]行SNN病理分型如下:①单纯凝固性坏死型:病理上为单纯凝固性坏死,外围以薄层纤维包膜。②伴液化性坏死型:病理上以凝固性坏死为主,中心可见裂隙状液化性坏死,外围以薄层纤维包膜。③多结节融合型:病理显示为多个坏死结节融合,病灶以凝固性坏死为主,结节间可见纤维分隔及外围薄层纤维包膜。此型与伴液化性坏死型有交叉,但作者把病灶内可见分隔,呈多结节融合,不管病灶内有无液化性坏死均划为多结节融合型。
结 果
MR检查SNN共计29例,单纯凝固性坏死14例,伴液化性坏死5例,多结节融合型10例,其中15例有CT检查资料(CT:单纯凝固性坏死8例,伴液化性坏死3例,多结节融合型4例)。其病理、CT、MRI表现如下。
1.病理
本组29例均为单发孤立病灶,右叶23例,左叶6例。直径1.0~4.7cm,平均3.0cm。切面呈灰黄色或土黄色结节。镜下病灶内为单纯凝固性坏死14例(图1);5例较大单发结节病灶内可见裂隙状液化性坏死(图2);10例病灶呈多结节融合,6例病灶内可见裂隙状液化坏死(图3)。所有病灶边缘均有薄层纤维组织包裹,周围纤维包膜内有淋巴细胞、浆细胞、嗜酸性粒细胞及少数中性粒细胞浸润。28例结节外周的肝组织未见异常,1例结节外周的肝组织可见脂肪变性。所有病灶内细菌学检查及抗酸染色均为阴性,无肝硬化背景。
2.CT
CT图像上15个病灶均显示,其中13个病灶位于肝表浅部位,2个病灶位于肝叶深部。病灶直径0.8~4.3cm,CT显示与病理接近。CT平扫病灶呈境界清楚的圆形低密度,增强扫描病灶无强化,10个病灶周围包膜呈延迟强化。病理分型及CT表现见表1。
3.MRI
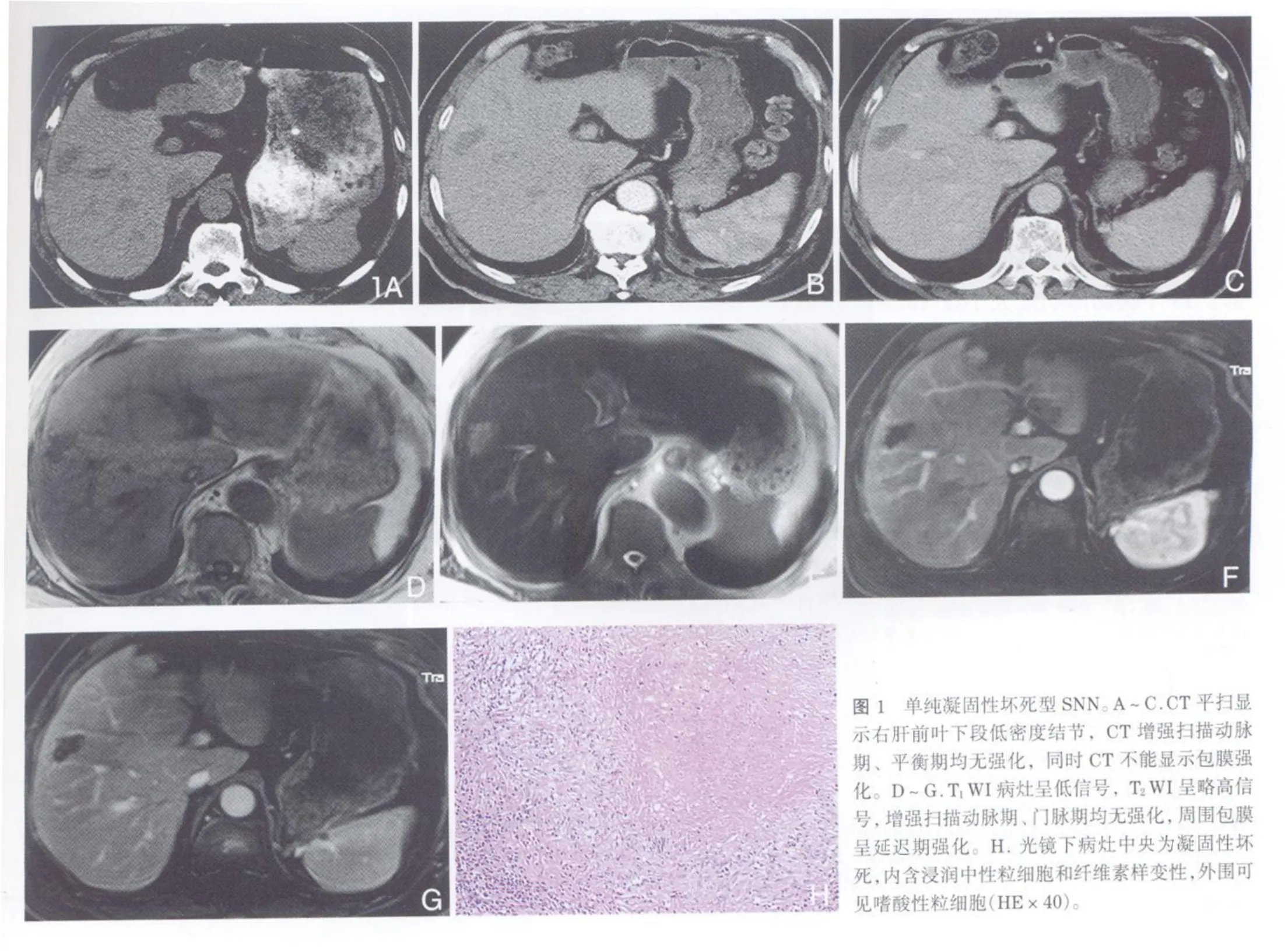
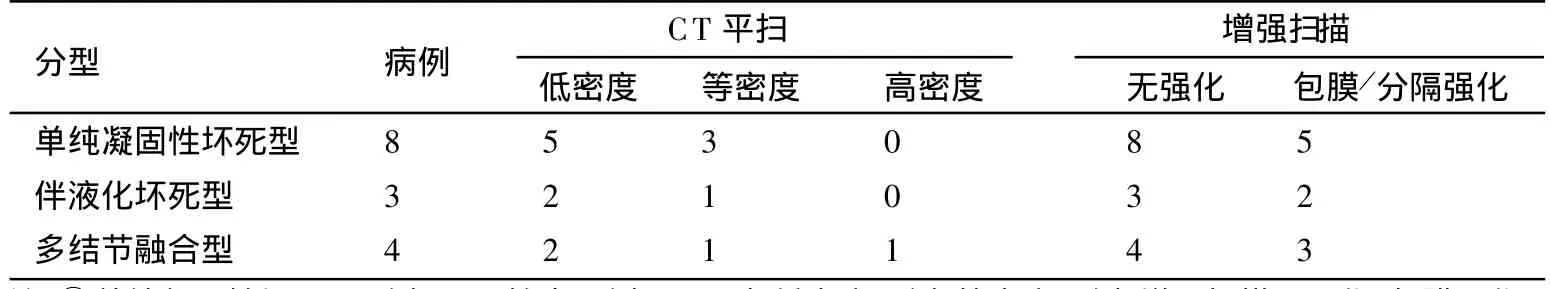
表1 SNN的病理类型和CT表现
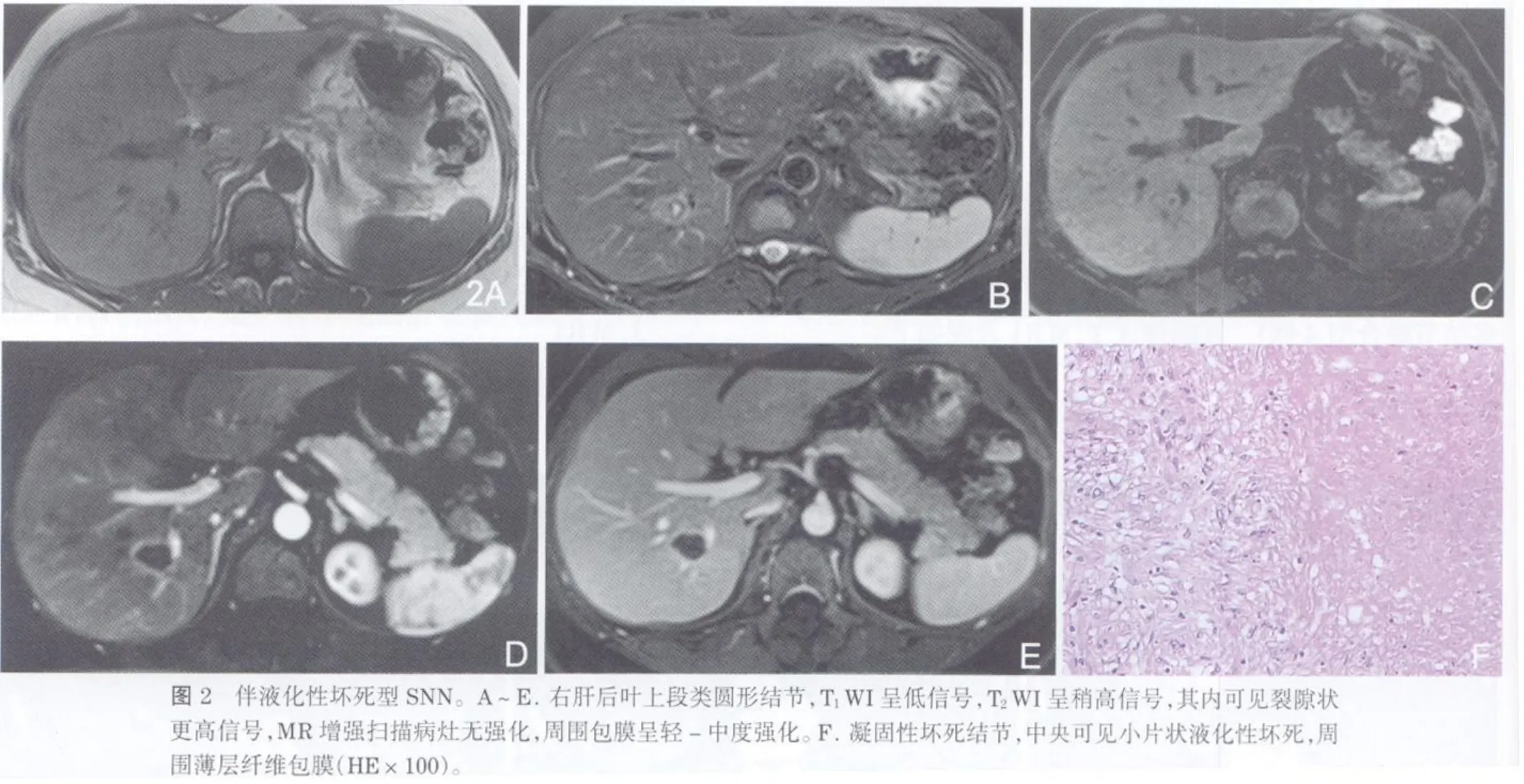
MR平扫显示了全部29个病灶,25个病灶位于肝表浅部位,距包膜小于2cm,4个病变位于肝叶深部。19个类圆形病灶大小在1.2~3.6cm,6个不规则形病灶大小在1.7~4.7cm。MRI显示的病灶范围与病理标本基本吻合。在T1WI上病变呈边界清楚的相对于肝实质的略低信号,强度相当于肌肉与脾脏组织之间,>3cm的6个病灶内可见点片状更低信号。在T2WI上病灶全部为等或相对低信号,11个病灶内还可见点片状高信号,10个病灶内有分隔,呈多结节融合。Gd-DTPA动态增强病灶在动脉期、门脉期及延迟期均无强化,尤其是门脉期,在强化明显的肝实质对比下病灶显示清晰、边界清楚,29个病灶在静脉期及延迟期上均有细环状轻-中度强化的包膜。各型SNN的M R平扫及增强扫描表现见表2。
4.CT、MRI对SNN病变细节显示情况(见表3)
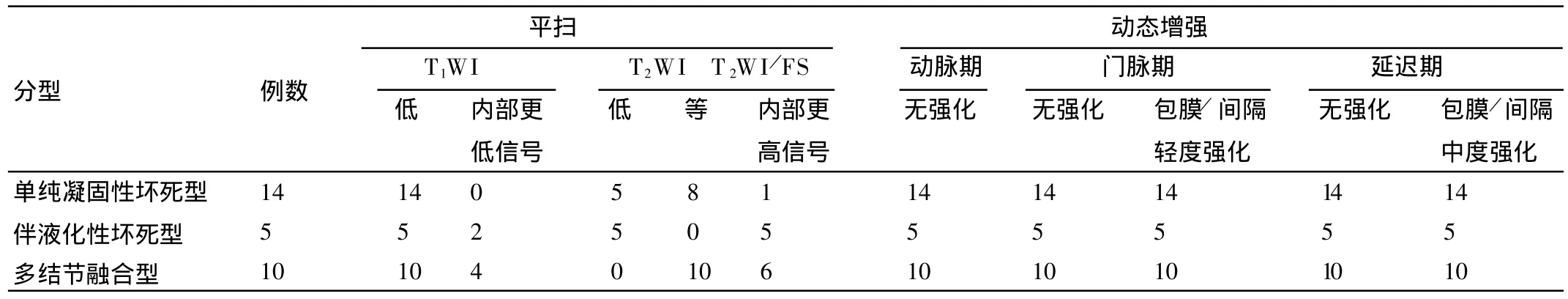
表2 SNN的病理类型和MRI表现
4.1 液化性坏死判定(总共有11例伴有液化性坏死):伴液化性坏死型SNN共5例,MR的T2WI均能显示,T1WI不能确定,CT检查3例均不能判定;多结节融合型SNN中有6例伴有液化性坏死,MR的T2WI均能显示,T1WI不能确定,CT检查4例中有2例有液化性坏死均不能确定。
4.2 包膜强化判定:总共29例SNN,MRI增强扫描延迟期均能观察包膜呈轻-中度强化,CT检查15例,只有10例增强扫描显示包膜,其中5例不能很好显示包膜。
4.3 分隔判定:多结节融合型有分隔,MRI增强扫描10例均能观察到,CT检查4例,有1例不能完全显示分隔。
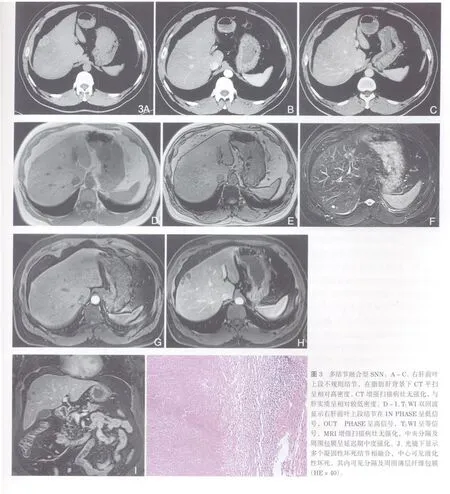
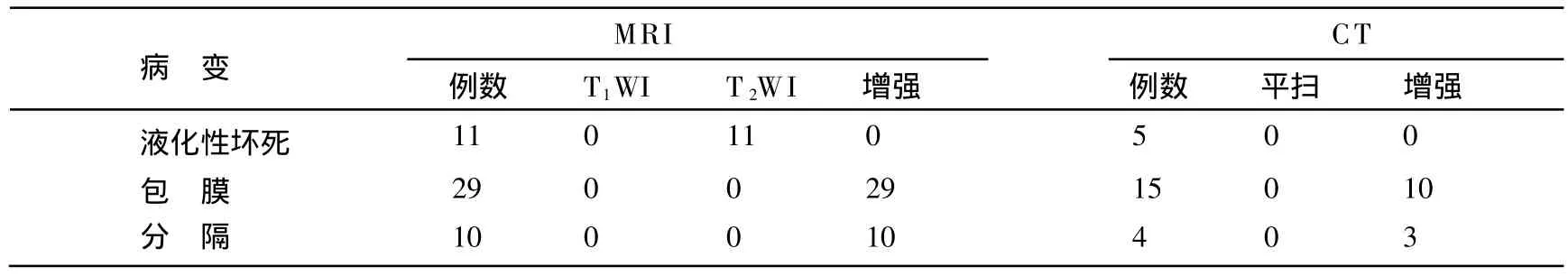
表3 CT、MRI对SNN病变细节显示情况比较
讨 论
1.概述
SNN发病高峰年龄在50~70岁,男性多于女性,病变大多位于肝右叶表面,肝左叶及肝叶深部少见[5]。临床一般无症状,根据文献报道及本组资料显示,几乎所有病例都是在尸检、手术和影像学检查时偶然发现。大部分病例无乙肝病史和肝硬化背景,无肝癌迹象,AFP及抗酸染色呈阴性,肝功能正常。大体上肝脏孤立性坏死结节多为单发结节,少数也可呈多个结节融合,切面呈灰白色或灰黄色,边界清楚,质地均匀,较大结节中有时可见液化性坏死,结节周围可见纤细的纤维包膜。组织学检查呈凝固性或伴液化性坏死结节,坏死周围为致密的纤维包膜,有时坏死中可见小钙化灶[6]。
有关本病的病因及发病机制尚不明确[6-11],Shepherd等[1]根据其报道的病例中有寄生虫感染病史,认为该病可能是寄生虫感染导致的,但本组22例均无寄生虫感染史。Shepherd等[1]和T sui等[7]研究还发现,几乎所有的孤立性坏死结节都位于肝右叶表面,而右叶表面是最容易受到创伤的部位,因而认为肝脏孤立性坏死结节可能是由创伤引起的,本组29例中,有25例位于肝叶表浅部位,与文献报道相符。然而Berry等[9]和Koea等[10]在肝脏孤立性坏死结节内发现了“营养血管”,认为该病可能是小血管瘤的最后硬化阶段,本文29例病变中均未见到 “营养血管”。结合近年文献[6-11],作者推测SNN可能是由于感染、创伤或免疫等原因造成的肝组织凝固性坏死,继而出现机体防御反应,纤维包裹凝固坏死局限化形成。
2.各型SNN的CT、MR表现及其病理基础
2.1 单纯凝固性坏死型:本组共14例,CT平扫呈低密度,MRI的T1WI、T2WI均呈低、等或稍高信号,增强扫描各期均无强化,周围包膜呈延迟强化,与多数文献一致[4,12]。病理上为单纯凝固性坏死,外围有薄层纤维包膜。陆建平等[12]认为SNN在MRI的T2WI信号强度取决于病灶脱水程度,但通常在T2WI上不出现如原发、继发性肝癌或其他恶性肿瘤的相对高信号,正是这种长T1短T2信号反映了凝固性坏死的病理特点,与本组及大部分文献资料报道一致。
2.2 伴液化性坏死型:本组仅5例MRI病例,但文献[13]报道此型在较大SNN病灶中并不少见,病灶在T1WI上为低信号,其内有小片状更低信号;T2WI病灶以等信号为主,内部可见小片状高信号;增强后病灶无强化,纤维包膜在门脉期及延迟期呈现轻-中度强化。病理上以凝固性坏死为主,中心可见裂隙状液化性坏死,外围有薄层纤维包膜。文献资料显示[4,12],病灶内小片状液化性坏死在CT上发现率低于MRI所见,当病灶相对较大(>2.5cm)时,在MRI的T1WI上可见病灶内有点状或小片状更低信号,在T2WI上尤为特殊,病灶状如“红枣”的切面观,中央或偏心的“核”代表液化性坏死呈高信号,外周部分的“肉”代表凝固坏死呈低-等信号,因此只要仔细辨认,T2WI上可以发现反映液化性坏死的点片状较高或明显高信号,其显示率明显高于T1WI和CT,故MRI较CT对液化坏死型有更高的诊断价值。
2.3 多结节融合型:CT平扫呈不规则低密度灶结节,MRI平扫T1WI上为低信号,其内可见低或等信号分隔;T2WI病灶以低信号为主,其内可见分隔状等或略高信号;CT、MRI多期动态增强扫描显示多个结节融合,病灶实质部分无强化,其内分隔及周围包膜呈轻-中度强化,完整显示病变以门脉期或平衡期最佳[4,12,14]。病理上呈多个坏死结节融合,病灶以凝固性坏死为主,部分较大结节内可见小片状液化性坏死,结节间可见纤维分隔及外围薄层纤维包膜。本组10例多结节融合型SNN,其中CT 检查4例,其影像表现与文献一致[4,12,14]。本组1例多结节融合型病例,由于存在肝脂肪变性,在CT平扫上病灶呈高密度结节,但在T1WI双回波和动态增强扫描可明确诊断(图3)。CT与M R比较,MRI的T2WI能更好观察到病灶的脱水程度、有无合并液化性坏死,MR动态增强能更好发现病灶内部分隔以及病灶周围纤维包膜情况[13-14]。本组4例CT资料显示周围包膜及内部分隔仅3例,低于M R所见,与文献相符。文献[12]认为多结节融合型SNN可能为肝脏炎性假瘤的特殊亚型或发展过程之一,但从SNN的病理及其影像诊断角度看均明显不同,故笔者认为应区别对待。
3.鉴别诊断
SNN是肝脏罕见的良性病变,临床症状和实验室检查对诊断均无太大帮助,影像学检查发现病灶不难,关键是定性诊断[4,12]。把单纯型和伴液化坏死型SNN误诊为少血供或乏血供的转移瘤或原发性肝癌(通常是胆管细胞癌),主要原因是对此病的认识不够深入,增强检查方法不够规范[4,12]。当病灶在CT平扫呈不规则的低密度结节,MRI的T2WI上呈中-高信号,动态增强CT、MRI显示病灶呈边缘模糊的轻度强化,则倾向为后者,排除SNN。原发性或转移性肝癌在注射酒精后,内部凝固坏死的信号改变及增强后表现酷似SNN,明确的病史是鉴别诊断的关键,酒精在癌灶内弥散不完全、坏死不彻底,边缘部残存肿瘤组织在T2WI上呈不规则环状中-高信号,增强后病灶呈“快进、快出”或不规则强化,可以进行鉴别。多结节融合型SNN易误诊为感染性病变,但感染性病变边界常不清楚,T2WI上尤为明显,再加上有感染相关病史,诊断较易。质量较好的MRI检查能很好地显示SNN病灶,平扫中以屏气梯度回波序列的准T1WI为最佳,增强后强化的肝实质与无强化的病灶形成鲜明对比,显示更理想。另外使用CT多期动态增强或MRI屏气的快速梯度回波序列作Gd-DT PA动态增强扫描十分必要,无论是动脉期、门静脉期还是延迟相,病灶呈无强化的乏血供特征,加之延迟强化的细环状包膜,使诊断更为可靠[4,12]。
综上所述,CT、MRI是诊断SNN的重要方法,CT尤其是CT动态增强扫描能显示病变,但显示其内部细节较难;MRI具有较好的软组织分辨力,T2WI/FS能有效区分其内部的裂隙样液化坏死,同时MRI动态增强较CT能更好显示内部间隔和周围包膜,故在多结节融合型和伴液化坏死型诊断方面明显优于CT。
1.Shepherd NA,Lee G.Solitarynecrotic nodules of the liver simulatinghepatic metastasis.J Clin Pathol,1983,36:1181-1183
2.Chang SC,Eun YC,Jin SJ,et al.Spontaneous regression of a solitary necrotic nodule of the liver.Hepatol Int,2010,4:649-652
3.De Luca M,Luigi B,FormisanoC,et al.Solitarynecrotic nodule of the liver misinterpreted asmalignant lesion:considerations on two cases.J Surg Oncol,2000,74:219-222
4.林光武,欧阳汉,周纯武.肝脏孤立性坏死结节的MR表现 .中华放射学杂志,2007,41:1073-1076
5.Zhou YM,Li B,Xu F,et al.Clinical features of solitary necrotic nodule of liver.HepatobiliaryPancreat Dis Int,2008,7:485-489
6.李冬洁,黄文斌,周晓军,等.肝孤立性坏死结节临床病理研究.诊断病理学杂志,2005,12:342-344
7.Tsuji WMS,Yuen RWS,Chow LTC,et al.Solitary necrotic nodule of the liver:parasitic origin?J Clin Pathol,1992,45:975-978
8.Sundaresan M,Lyons B,Akosa AB.“Solitary” necrotic nodules of the liver:an aetiology reaffirmed.Gut,1991,32:1378-1380
9.BerryGL.Solitary “necrotic nodule” of the liver:aprobable pathogenesis.J Clin Pathol,1985,38:1278-1280
10.Koea J,Taylor G,Mller M,et al.Solitary necrotic nodule of the liver:a riddle that is diffcult to answer.J Gstrointest Surg,2003,7:627-630
11.Clouston AD,Walker NI,Prociv P.Parasitic origin of a solitary necrotic nodule of the liver.J Clin Pathol,1993,46:578
12.陆建平,王 一,王 飞,等.肝脏孤立性坏死结节的影像和病理对照.中华放射学杂志,1998,32:406-409
13.Iwase K,Higaki J,Yoon HE,et al.Solitary necrotic nodule of the liver.J Hepatobiliary Pancreat Surg,2002,9:120-124
14.Alfieri S,CarrieroC,Doglietto GB,et al.Solitarynecrotic nodule of the liver:diagnosis and treatment.Hepatogastroenterology,1997,44:1210-1211

