家兔在发育过程中外侧腓肠肌内MyHCs变化与诱发电位的关系*
朱道立, 宋旭甦 , 徐大刚
(南通大学生命科学学院,江苏 南通 226007∥上海交通大学医学院,上海 200025)
骨骼肌纤维是由各式各样的肌原纤维构成的,具有独特的结构蛋白和代谢酶联合表达特点,ATPase染色确定I、IIA、IIX及IIB型肌纤维型通常由肌球蛋白重链异构体(MyHCs)所确定。MyHCs是肌原纤维粗丝的重要结构蛋白质,它能将化学能量转变成机械能以供肌肉收缩。诱发电位[1-2]的产生受多种因素的影响,如电压、电流强度、刺激频率、刺激范围等。根据家兔腓肠肌外侧头的起止点、肌束排列、肌运动终板分布及神经分布的特征[3],可明确分为内侧亚体、中间亚体和外侧亚体3个肌亚体。根据蛋白质相对分子质量大小的不同,通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳[4](sodium dodecyl sulphate-polyacrylamide gel electrophoresis,SDS-PAGE)识别肌球蛋白重链异构体的分布。以家兔外侧腓肠肌为实验对象,深入研究其各肌亚体的生理生化特征,以充实骨骼肌运动机能的基础研究资料。
1 材料和方法
1.1 材料的准备
1.1.1 家兔肌肉样品的准备 分别取生后1、2、4、8、16、24周健康家兔(OryctolaguscuniculusdomesticaChina,由南通大学实验动物中心提供)各6只,雌雄不拘,以φ=20%氨基甲酸乙酯腹腔麻醉(每kg体质量1 g),再用大体解剖法分别暴露外侧腓肠肌各肌亚体。
1.1.2 设备与仪器 微机化生理实验系统(Doctor-95 Super Lab.)与双针形刺激电极及打印机;垂直电泳槽与电泳仪(DYY-Ⅲ28A型,北京六一仪器厂)、高速冷冻离心机(CR22E日本HITACHI产品)、冷冻切片机(Leica,CM3000 型 德国产)及液氮罐等。
1.1.3 药品试剂 丙烯酰胺、N,N’-甲叉双丙烯酰胺、叠氮钠、过硫酸铵、四甲基乙二胺(TEMED)、琼脂糖、甘氨酸、巯基乙醇、硝酸银、φ=20%氨基甲酸乙酯、巴比妥钠、氯化钴、硫化铵等均为国产分析纯。十二烷基硫酸钠(SDS)、高相对分子质量标准蛋白质(Marker)、腺苷三磷酸酶系Sigma公司产品。
1.2 操作方法
1.2.1 电刺激仪器的连接与参数的设置 引导电极与前置放大器输入端连接,输出端连接电脑。刺激电极连接刺激器输出。给出信号记录参数:采样周期0.05~0.2 ms,增益2000,滤波1 k,时间常数0.1,刺激宽度1.48 ms,Amp-8.35 v。
1.2.2 肌肉蛋白质样品的准备 取出家兔外侧腓肠肌各肌亚体,分别切碎后与液氮一起在研钵中碾磨成粉末状,置放于高速冷冻离心机内,4 ℃,12 000 r/min,5 min。离心后取上清液,保存在-20 ℃冰箱内。 先后配制十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)小孔梯度凝胶[5]、制胶、加样及电泳,双胺银染色法和照相。
1.2.3 组织切片的制作 在大鼠后肢取外侧腓肠肌各肌亚体,以正常状态的肌肉长度固定在小木板上,迅速置于液氮保存30 min。然后取出肌条置放恒冷切片箱内,-20 ℃条件下切片厚度10 μm,室温干燥30 min。做腺苷三磷酸(ATP)酶酸预孵、碱预孵法组织化学染色[6]。
2 结 果
2.1 外侧腓肠肌的诱发电位
分别以家兔外侧腓肠肌各亚体为研究对象,探讨每个亚体在生后不同年龄阶段接受刺激后所产生的诱发电位差异。从图1看到,成年后刺激产生诱发电位波动都较大,持续时间和频率也较幼年长,而幼年波形相对较简单,波动平缓,波形稳定性较好。成年16周和24周家兔棘波清晰可见。同时从峰值电压上看,中间亚体在刺激时各年龄组峰值电压基本相同,而外侧亚体和内侧亚体分别有变化,与各亚体肌纤维型构成比例有很大关系,随着年龄增大,肌肉结构变得复杂。

图1 家兔外侧腓肠肌各亚体不同年龄组诱发电位图
2.2 肌肉蛋白质SDS-PAGE电泳
图2显示应用SDS-PAGE电泳对家兔外侧腓肠肌(外侧亚体,中间亚体,内侧亚体)电泳图谱确定4种MyHCs。由于其相对分子质量大小的差异,从而导致迁移率不同,在腓肠肌各亚体均分别观察到MyHCsⅡa,MyHCs Ⅱd(Ⅱx),MyHCsⅡb和 MyHCsⅠ。
2.3 腺苷三磷酸酶组织化学染色
在肌动球蛋白腺苷三磷酸酶组织化学碱法(pH10.3)染色切片上,外侧腓肠肌外侧亚体、中间亚体及内侧亚体肌纤维分为I型、IIA型、IIX(IID)型、IIB型。I型肌纤维细,染色浅;IIA型肌纤维中等,染色深;IIX(IID)型肌纤维最细,染色最浅;IIB型肌纤维最粗,染色居中等。经过肌动球蛋白腺苷三磷酸酶组织化学酸法(pH4.6)染色切片上能分出深染呈黑色直径小I型纤维,浅染而直径中等IIA型纤维,染色最深而直径最小IIX(IID)型纤维及呈褐色直径最大IIB型纤维(图3、4、5)。在生后发育期间,外侧腓肠肌各亚体肌纤维构成比例和横切面积见表1。

图2 家兔外侧腓肠肌内侧亚体不同年龄组肌球蛋白重链异构体银染SDS-PAGE电泳图
3 讨 论
3.1 诱发电位的特性与可能的机制
家兔外侧腓肠肌外侧亚体、中间亚体及内侧亚体在生后不同年龄阶段以幼年波形简单平稳。随着生后年龄增加,刺激产生诱发电位波动逐渐变得复杂多变,持续时间和频率也较幼年长,成年16周和24周家兔棘波清晰可见。尤以内侧亚体诱发电位波形比中间亚体棘波显现复杂,而中间亚体比外侧亚体更复杂,随着年龄增大,肌肉结构变得复杂。与各亚体肌纤维型构成比例有很大关系。诱发电位是人工或自然的特异刺激所引起中枢神经系统电位变化。它不同于自发电位。诱发电位M波振幅一般看做神经肌肉接头部动作电位或者终板电位复合电位幅度,而最大M波振幅值用来评价神经肌肉接头部神经递质储存和释放能力。本研究采用电刺激外侧腓肠肌各肌亚体,引起肌肉兴奋-收缩耦联而导致肌亚体产生诱发电位。Mmax则发生变化。H波(Hoffmann reflex)是肌纤维受到刺激时,刺激冲动经由Ⅰa感觉神经传入纤维传至脊髓内并使脊髓α运动神经元发生兴奋而诱发产生的单突触性反射电位。由于M波变化容易对H波振幅大小产生影响,近年来更多学者认为,Hmax与Mmax比值(H/Mmax)的变化,更能直接反映脊髓α运动神经元兴奋性的变化[7]。

图3 家兔外侧腓肠肌外侧亚体腺苷三磷酸酶(ATPase)酸碱法组织化学染色(X40-400)
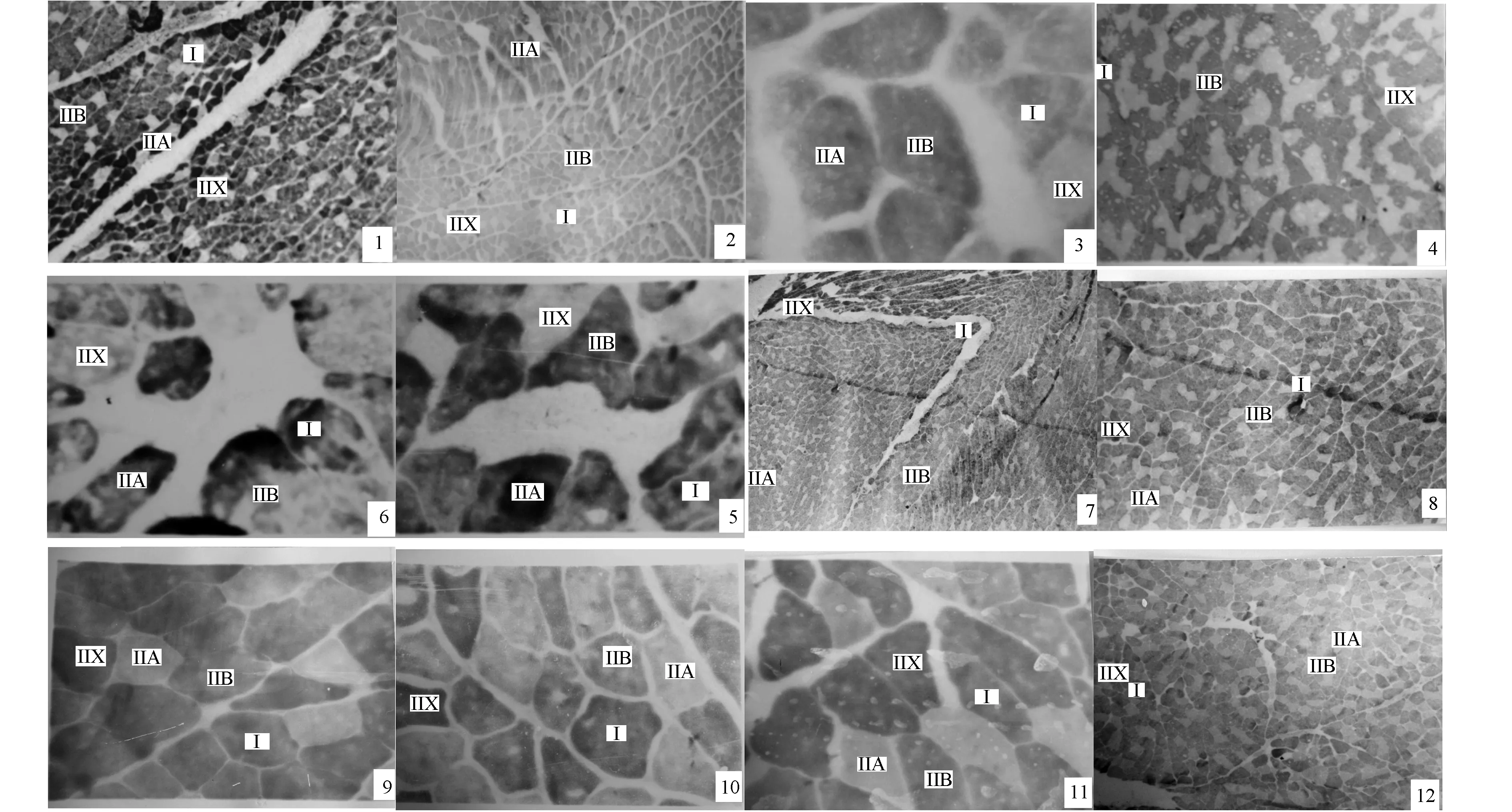
图4 家兔外侧腓肠肌中间亚体腺苷三磷酸酶(ATPase)酸碱法组织化学染色(X40-400)

图5 家兔外侧腓肠肌内侧亚体腺苷三磷酸酶(ATPase)酸碱法组织化学染色(X40-400)
表1 外侧腓肠肌生后发育期间各亚体内肌纤维构成和横切面积1)
Table 1 The relative frequency and cross-sectional fiber area of different fiber types at each subvolume of the lateral gastrocnemius during postnatal developments

亚体Subvolume 年龄AgesType IFrequency/%Area/μm2(X±S)Type IIAFrequency/%Area/μm2(X±S)Type IIBFrequency/%Area/μm2(X±S)Type IIXFrequency/%Area/μm2(X±S)Medial Subvolume of LG1周17.4±4.1344.9±2121.2±3.1411.5±1950.3±7.8474.8±1311.1±2.7315.3±162周16.1±4.4435.4±1722.7±3.2523.7±2851.5±9.3605.5±279.7±2.6376.6±231月15.6±3.0596.2±2923.3±2.4679.8±3252.8±10.5817.8±548.3±2.4495.4±262月13.7±3.6790.4±3524.5±4.1930.5±6454.0±9.41 195±977.8±1.5648.6±354月12.7±2.5962.0±8324.6±5.71 247±9156.1±10.21 479±1376.6±1.9862.7±676月9.1±2.31394±12125.2±6.61803±13761.2±12.12 600±1424.5±1.91 032±112Intermediate Subvolume of LG1周17.4±7.7353.0±1722.5±3.7414.2±1549.9±9.2511.5±2810.2±2.8295.5±192周15.7±6.5411.5±2523.7±3.8504.6±2350.9±8.8696.6±369.7±2.6365.5±291月14.5±5.3566.7±3224.8±3.1665.8±4751.9±9.8789.6±518.8±2.3465.5±332月13.1±5.3760.9±5525.8±3.6905±11453.4±8.01 107±967.7±2.2625.5±494月11.7±2.5939.1±8126.2±5.21 216±11755.9±10.71 450±1266.2±1.5845.5±586月9.2±3.71148±8528.2±6.51743±12158.2±12.92 439±1484.4±2.7954.2±92Lateral Subvolume of LG1周20.5±6.6332.3±1920.8±3.2403.4±2149.1±8.9450.6±189.6±3.1288.3±172周19.1±5.5390.6±2321.4±3.4485.5±2650.8±7.1546.3±218.7±2.5338.3±281月18.1±4.6508.5±5922.5±4.8623.5±3852.4±9.8731.4±677.0±2.3437.4±252月17.5±2.7745.2±6023.2±3.2925.9±5953.1±10.21 124±756.2±3.1604.3±374月15.8±2.8909.5±5823.5±4.91 121.9±6955.7±12.61 385±985.0±3.7802.8±656月12.0±2.81070±8224.5±5.11 658±13159.5±13.72 243±1494.0±2.3942.8±75
1)Three type fibers compared:p<0.05, difference is notable;Three subvolumes of LG compared:p<0.05, difference is notable
3.2 肌球蛋白和肌动蛋白运动的作用机理
肌球蛋白作为细胞骨架分子马达,是一种多功能蛋白质,其主要功能是为肌肉收缩提供力量,在哺乳动物骨骼肌已鉴定出11种MyHCs异构体,即:①胚胎型MyHCs;②新生儿型MyHCs;③α-心肌型MyHCs;④β-心肌型MyHCs (在骨骼肌表达为慢缩Ⅰ型MyHCs);⑤快缩Ⅱa型MyHCs;⑥快缩Ⅱd/Ⅱx型MyHCs;⑦快缩Ⅱb型MyHCs;⑧眼外肌型MyHCs;⑨颚型MyHCs或咀嚼型;⑩ 喉型MyHCs -ⅡL;喉型MyHCs -ⅠL。具有经典摆动横桥模型(classic swinging crossbridge model)至今仍被教科书所采用。随着研究手段创新,产生新的肌丝滑动学说,具有代表性和影响力是摆动杆臂模型(swinging ever arm model)和线形马达模型(linear motor model)学说,肌球蛋白产生力3个代表模型。线性马达学说提出,肌球蛋白头部象一个马达,肌动蛋白丝沿其直线滑动[8]。纤丝滑动学说(sliding filament theory)认为肌肉收缩是肌动蛋白细丝与肌球蛋白粗丝相互滑动结果较为科学合理。在家兔生后发育期间,外侧腓肠肌外侧亚体、中间亚体及内侧亚体MyHCsⅡa,MyHCsⅡd(Ⅱx),MyHCsⅡb和MyHCsⅠ从大相对分子质量到小相对分子质量依次展示,大约分布在200 000左右。幼年时期,四型亚基的染色较为淡漠,随着年龄增加变得更为清晰明确。
3.3 肌纤维的组成及作用差异
根据肌纤维ATP酶染色方法[9]将肌纤维分为I型和II型,II型纤维又进一步分为ABC3种异构体。I型纤维收缩速度慢,相当于慢肌纤维,II型纤维收缩的速度快,相当于快肌纤维,II型纤维中,IIB的收缩速度快于IIA,IIC即IIX纤维则介于IIA和IIB之间。根据基因蛋白划分和肌肉收缩蛋白中肌球蛋白重链基因表达,在成年哺乳动物骨骼肌已鉴定11种MyHCs,其中MyHCsI、MyHCsIIa、MyHCsIIx(或MyHCsIId)、MyHCsIIb广泛分布各种骨骼肌,其它MyHCs仅在特异骨骼肌中表达[9]。研究显示,MyHCs表达由慢向快的转化过程与由快向慢转化方向相反:MyHCsI←→MyHCsIIa←→MyHCsIId←→MyHCsIIb[10]。IIB和IIA型纤维构成比例在各亚体从生后1周到24周逐渐增多,而I和IIX型纤维构成比例在各亚体从生后1周到24周逐渐减少;横切面积在各亚体从生后随年龄增长显著增粗。肌纤维构成与肌功能需要相适应,发育促使外侧腓肠肌各亚体逐渐发育成为以IIB型纤维为主快肌,充分说明肌肉存在功能性分化。而IIB型纤维构成比例在内侧亚体(61.2±12.1)%>外侧亚体(59.5±13.7)%>中间亚体(58.2±12.9)%,在外侧腓肠肌提速运动发挥重要作用。
参考文献:
[1] PENSINI M,MARTIN A. Effect of voluntary contraction intensity on the H-reflex and V-wave responses[J]. Neuroscience Letters,2004,367(4):369-374.
[2] 朱道立,陈佩林,叶辉,等. 家兔与大鼠腓肠肌的生后发育比较[J]. 动物学报,2003,49(6):646-655.
[3] BURKE RE,LEVINE DN,ZAIC FE,et al. Physiological type and histochemical profile in motor units of the cat gastrocnemius[J]. Science,1971,174(8):709-712.
[4] COSTA Nd,BLACKLEY R,ALZUBERRI H,et al. Quantifying the temporospatial expression of postnatal porcine skeletal myosin heavy chain genes[J]. Journal Histochemistry Cytochemistry,2002,50(4):353-364.
[5] 陈毓荃. 生物化学实验方法和技术[M]. 北京:科学出版社,2002:16-27.
[6] FUENTES I,COBOS AR,SEGADE LAG. Muscle fiber types and their distribution in the biceps and triceps brachii of the rat and rabbit[J]. Journal Anatomy,1998,192(3):203-210.
[7] GUETTE M,GONDIN J,MARTIN A. Morning to evening changes in the electrical and mechanical properties of human soleus motor units activated by H reflex and M wave[J]. European Journal Applied Physiology,2005,95(4):377-381.
[8] ANDRUCHOV O,WANG Y,ANDRUCHOVA O,et al. Functional properties of skinned rabbit skeletal and cardiac muscle preparations containing α-cardiac myosin heavy chain[J]. Pflugers Archive,2004,4147(1):11-18.
[9] SPANGONBURG E E,BOOTH F W. Molecular regulation of individual skeletal muscle fibre types[J]. Acta Physiology Scandinavian,2003,178(5):413-424.
[10] PETTE D,STARON R S. Transitions of muscle fiber phenotypic profiles[J]. Histochemistry Cell Biology,2001,115(4):359-372.

