高锰酸钾氧化去除水中三氯生动力学研究
徐勇鹏,杨静琨,2,王在刚
(1.哈尔滨工业大学城市水资源与水环境国家重点实验室,150090 哈尔滨,xuyongpeng123@163.com;2.华南理工大学建筑设计研究院,510640 广州;3.哈尔滨市国际工程咨询中心,150018 哈尔滨)
高锰酸钾氧化去除水中三氯生动力学研究
徐勇鹏1,杨静琨1,2,王在刚3
(1.哈尔滨工业大学城市水资源与水环境国家重点实验室,150090 哈尔滨,xuyongpeng123@163.com;2.华南理工大学建筑设计研究院,510640 广州;3.哈尔滨市国际工程咨询中心,150018 哈尔滨)
为了揭示高锰酸钾氧化去除水中三氯生的动力学规律,通过烧杯试验研究得出高锰酸钾氧化三氯生的反应速率常数,同时探讨高锰酸钾浓度、pH、温度等因素对反应速率常数的影响.试验结果表明:不同高锰酸钾浓度下,三氯生能够被迅速氧化,氧化三氯生的反应符合二级反应动力学,二级反应动力学常数K=0.331 6 mL·s-1·mol-1.pH对反应速率常数有显著影响,在pH为5、7时,K分别达到最小值和最大值.高锰酸钾氧化三氯生的反应速率随着反应温度的增加而增加,该反应表观活化能Ea为32.35 kJ·mol-1,说明该反应在一般水处理条件下较容易发生.高锰酸钾是一种快速、高效去除水中三氯生的氧化剂.
高锰酸钾;三氯生;动力学;pH;温度
三氯生(2,4,4'-三氯 -2'-羟基二苯醚,Triclosan)作为一种广谱杀菌消毒物质,广泛应用于香皂、漱口水、化妆品、洗涤用品等个人护理品及塑料餐具、鞋等日常生活用品中.在医用器械的消毒以及纺织品出厂前的消毒、抗菌处理中也有应用.最近美国地质勘探局调查地表径流中新型有机污染物的结果表明,三氯生的平均质量浓度为0.14 μg/L,是最常发现的新型有机污染物之一.另有报道在城市污水、地表水,沉淀物中以及鱼中均检测到三氯生及其甲基衍生物[1-4].三氯生的长期残留性、生物蓄积性和高毒性,易生成消毒副产物,且在光照和受热时容易形成二噁英,对生态系统安全和人体健康将产生严重的危害,已成为国内外水处理领域内研究的热点内容之一[5-7].
高锰酸钾作为一种绿色的强氧化剂,可以有效控制水中的色度、臭味、消毒副产物[8-10],同时是去除水中有机还原性污染物普遍采用的药剂,其工艺简单,可操作性较强,易于在水厂中实施[11].本文对高锰酸钾氧化三氯生的过程进行了研究,测定了三氯生与高锰酸钾的反应速率常数,并探讨了高锰酸钾质量浓度、pH、温度等条件对降解过程的影响.
1 试验
1.1 试验装置
IDEA SCIENCE公司生产的MIXdrive 15磁力搅拌器;安捷伦公司生产的型号1200高效液相色谱仪;雷磁PHS-3C精密pH计.
1.2 化学试剂
试验所用三氯生为色谱纯,由Sigma Aldrich生产,质量分数99%),用去离子水(电阻率≥18 kΩ·m)配成1 mmol/L的储备液于棕色瓶中,使用时根据需要稀释;高锰酸钾及硫代硫酸钠(分析纯,质量分数大于99.5%,购自天津市百世化工有限公司);用于配制缓冲溶液的磷酸盐、硼酸/硼砂(分析纯,质量分数大于99%,购自天津市博迪化工有限公司);其他化学试剂均为分析纯.
1.3 试验过程
试验在25 mL琥珀色旋盖小瓶中进行,反应小瓶的温度控制在所需值,在水浴磁力搅拌器中连续中速搅拌.向每个小瓶中加入一定量pH缓冲液,保持溶液反应前后的pH值在所需范围.向含有10 μmol/L的三氯生溶液中投加一定量的高锰酸钾,在设定的时间间隔取样,然后用硫代硫酸钠中止反应,样品经处理后进行分析.
1.4 试验方法
三氯生用高效 HPLC检测,色谱柱采用ZorbaxXDB-C18柱(色谱柱尺寸为φ4.6 mm×250 mm,填充剂粒径为5 μm),检测器采用UV检测器,波长为220 nm,柱温为30℃.2 mol/L的甲醇与乙酸流动相,组成体积比为3∶1,流速为1 mL/min.进样量为 100 μL,外标法测定[1].
2 结果与讨论
2.1 高锰酸钾氧化三氯生的效果
在三氯生初始浓度为 10 μmol/L,温度为21℃,pH=7的条件下,考察高锰酸钾浓度对三氯生氧化速率的影响,氧化效果如图1.
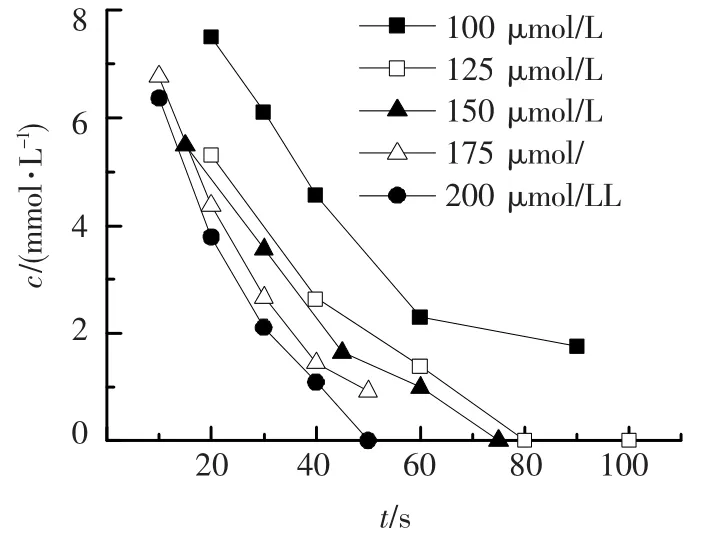
图1 不同高锰酸钾浓度对三氯生氧化的影响
如图1所示,高锰酸钾对三氯生的氧化去除效果非常明显.在高锰酸钾浓度为100 μmol/L条件下,氧化90 s后,三氯生的浓度由10 μmol/L下降到1.757 μmol/L,去除率为82.43%.随着高锰酸钾浓度的增加,三氯生的氧化降解速率加快.当高锰酸钾浓度为125 μmol/L时,氧化80 s后,三氯生浓度已经低于检测限.当高锰酸钾浓度为200 μmol/L时,氧化 50 s后三氯生即低于检测限.
2.2 高锰酸钾浓度对反应速率的影响
高锰酸钾氧化三氯生的过程可以表示为
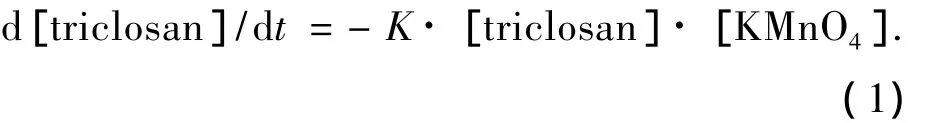
式中:K为反应速率常数,L/(s·mol);[KMnO4]为高锰酸钾浓度,mol/L;[triclosan]为三氯生浓度,mol/L.
当高锰酸钾的浓度为其相对于三氯生10倍的情况下,可以认为在反应过程中高锰酸钾的浓度基本不变,因此可得
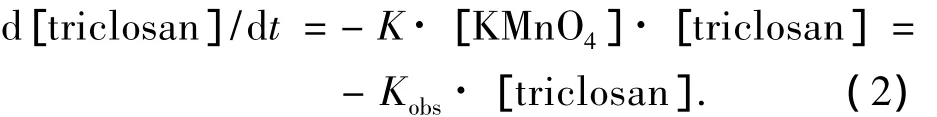
令K·[KMnO4]=Kobs(Kobs为假一级反应速率常数,s-1),测定不同时间段目标物浓度的变化,可以求出Kobs.不同高锰酸钾浓度条件下,三氯生的氧化降解的假一级反应动力学方程拟合结果见图2和表1.
将原有的二级反应整理得到了关于三氯生的假一级反应,Kobs为伪速率常数.将不同高锰酸钾浓度与假一级反应速率常数进行拟合,结果见图3.
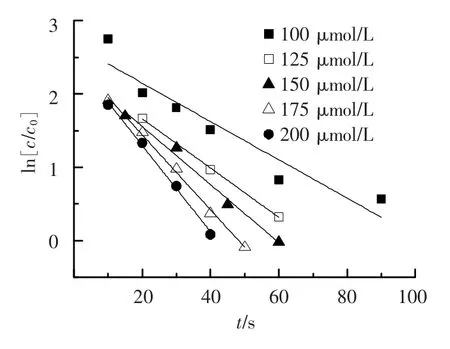
图2 不同浓度高锰酸钾氧化三氯生拟合曲线

图3 高锰酸钾浓度与假一级反应速率常数的关系
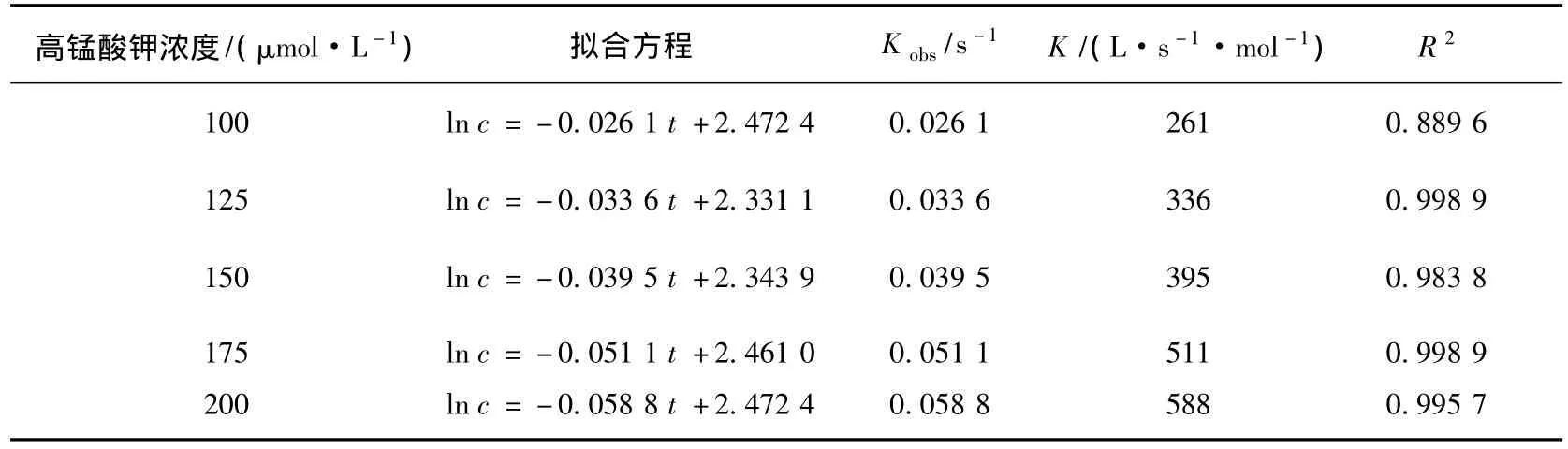
表1 不同高锰酸钾浓度条件下高锰酸钾氧化三氯生反应动力学参数
从图3可以看出,高锰酸钾浓度从100 μmol/L增加到200 μmol/L的过程中,假一级反应速率常数从 0.026 1 s-1增加到 0.058 8 s-1.高锰酸钾初始浓度和假一级反应速率常数存在线性关系,拟合为
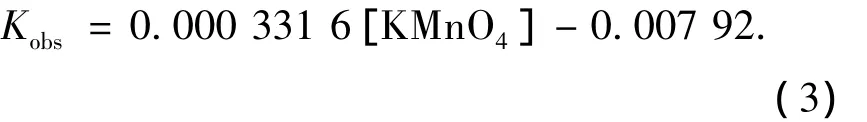
式(3)表明假一级反应速率常数随高锰酸钾浓度的增加而线性增加,说明高锰酸钾氧化三氯生的反应是二级反应,二级反应速率常数K=0.331 6 mL·s-1·mol-1.高锰酸钾氧化三氯生的本质是在液相中,高锰酸钾分子和三氯生分子发生有效碰撞,发生氧化反应,将三氯生氧化成其他物质,进而达到去除水中三氯生的目的.提高高锰酸钾投加浓度实质上提高了单位反应体积内的高锰酸钾分子数量,高锰酸钾分子数量的增加会使单位时间内高锰酸钾分子和三氯生分子发生有效碰撞的几率增加,反应速率也会随之提高.
2.3 pH对反应速率的影响
在三氯生初始浓度为10 μmol/L,高锰酸钾浓度为100 μmol/L,温度为21℃的条件下,试验考察了pH为4~9时反应速率的变化规律,pH值对反应速率的影响如图4、表2所示.从图4可以看出,pH是影响反应速率的重要因素.在pH<5时,反应缓慢,在pH=5时反应速率常数K达到最小;pH为5~7时,反应速率常数K随着pH的增加快速增加,在pH为7时达到最大值.pH继续提高,反应速率常数K随pH的增大开始缓慢降低.可见在弱酸性水中三氯生的氧化反应相对比较慢,而在弱碱性条件下要迅速得多.这与马军等[5]的研究结果趋势相同.目前,pH对高锰酸钾氧化三氯生的影响还没有合理的解释,本文推测出现上述结果的主要是因为在不同pH条件下,高锰酸钾多变的氧化还原电位以及高锰酸钾被还原生成的产物不同导致.
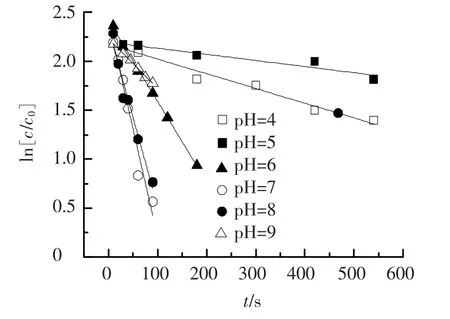
图4 不同pH条件下高锰酸钾氧化三氯生拟合曲线
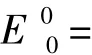
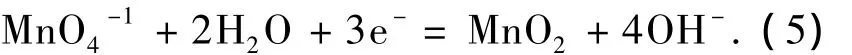
高锰酸钾在酸性条件下具有很强的氧化性,其标准氧化还原电位E0=1.51 V,反应式为
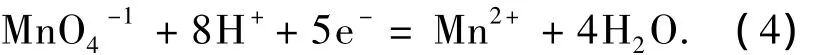
比较式(4)、(5)可知,与酸性条件下不同,高锰酸钾在中性条件下的最大特点是反应生成二氧化锰,由于二氧化锰在水中的溶解度很低,便以水合二氧化锰胶体的形式由水中析出.正是由于水和二氧化锰胶体的作用,使得高锰酸钾在中性条件下氧化三氯生具有很高的反应速率[12].

表2 不同pH条件下高锰酸钾氧化三氯生反应动力学参数
2.4 温度对反应速率的影响
反应温度对高锰酸钾氧化三氯生效果的影响见图5和表3.不同反应温度下,ln(c/c0)与温度θ的关系曲线经拟合得到各温度下反应的假一级反应速率常数Kobs值.由图5可以看出,高锰酸钾氧化三氯生的反应速率随着反应温度的增加而增加.反应温度升高使反应物分子平均动能增大,分子间的碰撞次数也随之增多,同时反应温度升高会使更多的分子变为活化分子,增大了活化分子的百分率,这使得单位时间内有效碰撞次数增多,导致反应速率加快[13].
根据反应速率常数与温度关系的Arrhenius方程,做不同温度下ln K与θ-1关系曲线,可以求得表观活化能[14],如图6所示.表观活化能E为32.35 kJ·mol-1,一般化学反应的活化能为60~250 kJ·mol-1,而高锰酸钾氧化三氯生的表观活化能只有32.35 kJ·mol-1,略低于一般反应,说明该反应比较容易发生,反应速率比较快.
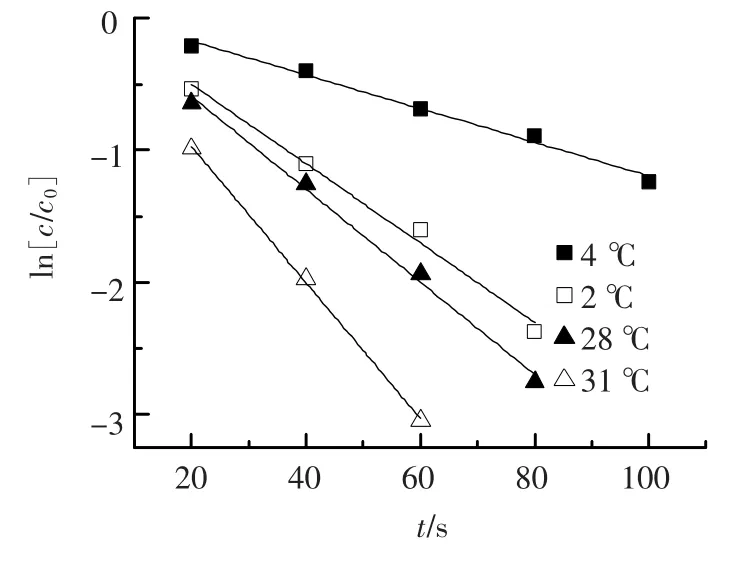
图5 不同温度条件下高锰酸钾氧化三氯生拟合曲线
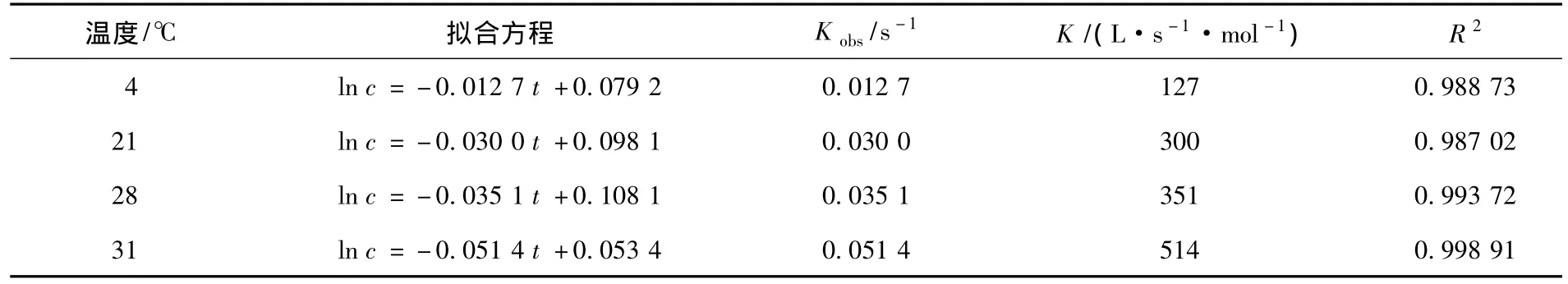
表3 不同温度条件下高锰酸钾氧化三氯生反应动力学参数
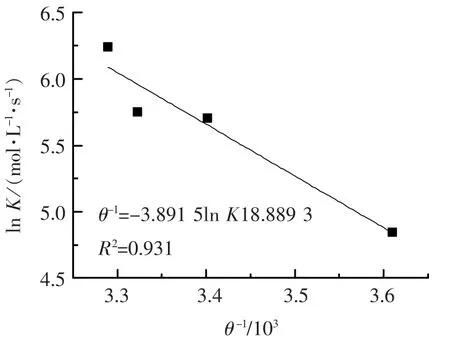
图6 温度与ln K关系曲线
3 结论
1)三氯生可被高锰酸钾迅速氧化,高锰酸钾浓度为200 μmol/L,氧化时间为50 s时,出水三氯生的浓度低于检测限.
2)在高锰酸钾过量的情况下,其反应为二级动力学反应.高锰酸钾浓度和假一级反应动力学常数Kobs存在线性关系,拟合方程为Kobs=0.000 3316[KMnO4]-0.00792(R2=0.9861),得出二级反应动力学常数 K=0.000 331 6 L·s-1·mol-1.
3)pH值对反应速率有显著影响,pH<5时K较小,反应速度较慢;pH为5~7时,K迅速增大,当pH值为7时达到最大,K=588 L·s-1·mol-1;pH>7后,K减小,反应速率降低.
4)高锰酸钾氧化三氯生的反应速率随着反应温度的增加而增加.用Arrhenius公式拟合得到反应的表观活化能为32.35 kJ·mol-1,说明该反应在一般水处理条件下比较容易发生,反应速率比较快.
[1]ZHANG Huichun,HUANG Chinghua.Oxidative transformation of triclosan and chlorophene by manganese oxides[J].Environmental Science & Technology,2003,37(11):2421-2430.
[2]周世兵,周雪飞,张亚雷,等.三氯生在水环境中的存在行为及迁移转化规律研究进展[J].环境污染与防治,2008,30(10):71-75.
[3]ZHAO Jianliang,YING Guangguo,LIU Yousheng.Occurrence and risks of triclosan and triclocarban in the Pearl River system,South China:from source to the receiving environment[J].Journal of Hazardous Materials,2010,179:215 -222.
[4]MILLER T,HEIDLER J,CHILLRUD S,et al.Fate of triclosan and evidence for reductive dechlorination of triclocarban in estuarine sediments[J].Environmental Science & Technology,2008,42(12):4570 -4576.
[5]JIANG Jin,PANG Suyan,MA Jun.Oxidation of triclosan by permanganate(Mn(VII)):importance of ligands and in situ formed manganese oxides[J].Environmental Science& Technology,2009,43(21):8326-8331.
[6]BUTH J,STEEN P,SUEPER C.Dioxin photoproducts of triclosan and its chlorinated derivatives in sediment cores[J].Environmental Science & Technology,2010,44(12):4545-4551.
[7]FISS E,RULE K,VIKESLAND P.Formation of chloroform and other chlorinated byproducts by chlorination of triclosan-containing products[J].Environmental Science& Technology,2007,41(7):2387-2394.
[8]马军,李圭白,陈忠林,等.高锰酸钾除微污染效能-GC/MS分析[J].中国给水排水,1999(5):13-17.
[9]马军,李圭白,李晓东.高锰酸钾的氧化助凝效能[J].中国给水排水,1992,8(4):4-9.
[10]杨开,李春森,莫孝翠,等.高锰酸钾氧化法去除地表水中的锰[J].中国给水排水,2003,19(8):61-62.
[11]刘尧,张晓健,戴吉胜,等.高锰酸钾氧化水中乙硫醇的动力学研究[J].环境科学,2008,29(5):1261-1265.
[12]李圭白,杨艳玲,马军,等.高锰酸钾去除天然水中微量有机污染物机理探讨[J].大连铁道学院学报,2003,19(8):61 -62.
[13]任广军,翟玉春,田彦文,等.用高锰酸钠氧化法去除水中的苯胺[J].东北大学学报:自然科学版,1998,19(2):1 -4.
[14]NAIK P,CHIMATADAR S,NANDIBEWOOR S.Kinetics and oxidation of fluoroquinoline antibacterial agent,norfloxacin,by alkaline permanganate:a mechanistic study[J].Ind Eng Chem Res,2009,48(5):2548-2555.
Kinetics on triclosan oxidation by potassium permanganate in drinking water
XU Yong-peng1,YANG Jing-kun1,2,WANG Zai-gang3
(1.State Key Laboratory of Urban Water Resource and Environment,Harbin Institute of Technology,150090 Harbin,China,xuyongpeng123@163.com;2.Architecture Design & Research Institute,South China University of Technology,510640 Guangzhou,China;3.Harbin International Engineering Consulting Center,150018 Harbin,China)
Jar tests were conducted to expose the kinetic law of triclosan oxidation by potassium permanganate in aquatic environment.The rate constant of the reaction was obtained,meanwhile,the factors influencing the value of K,such as potassium permanganate dosage,pH value and temperature,were investigated.The results showed that triclosan was rapidly oxidized by potassium permanganate in aqueous solution with different initial concentrations of potassium permanganate,and second-order reaction kinetics was observed between triclosan and potassium permanganate with second-order reaction rate constant K=0.331 6 mL·s-1·mol-1.The second-order reaction rate constant was influenced by pH values,and K reached its lowest and highest level at pH 5 and 7 respectively.The rate of oxidation increased with the temperature increasing,and the reaction activation energy Ea=32.35 kJ·mol-1,which revealed that the oxidation reaction between triclosan and potassium permanganate was feasible under usual water treatment condition.Therefore,potassium permanganate is a feasible oxidant which can removal the triclosan quickly and efficiently.
potassium permanganate;triclosan;kinetics;pH;temperature
TU991.2
A
0367-6234(2011)12-0048-05
2010-09-09.
国家自然科学基金资助项目(51108118);黑龙江省科技攻关项目(GB07C20202).
徐勇鹏(1976—),女,博士,副教授.
(编辑 魏希柱)

