基质金属蛋白酶与食管癌相关性的研究进展
罗昊
(乐山职业技术学院护理系,四川 乐山614000)
食管癌(Esophageal cancer,ECC)是世界上最常见的恶性肿瘤之一,恶性程度高,5年生存率不到15%。目前普遍认为食管癌是多因素作用、多基因参与、多阶段发展的疾病。环境因素是食管癌发生的原因之一,但暴露于相似环境因素的人群,只有少数人发病,提示个人对食管癌存在遗传易感性。MMPs是一类依赖金属离子锌(Zn2+)并以细胞外基作为水解底物的蛋白水解酶[1],在基膜和细胞外基质的降解过程中起着至关重要的作用,与食管癌的发生发展有一定关系。
1 MMPS的分类和结构
1962年,Gross和Lapiere发现第一种 MMP,迄今为止在人类至少发现有26余种MM Ps,按作用底物不同和内部同源性主要分为六大类:
1.1 胶原酶(Collagenases)
包括 MMP-1、MMP-8、MMP-13、MMP-18,主要降 解 Ⅰ 、Ⅱ、Ⅲ型等多种类型间质胶原和蛋白多糖的核心蛋白。MMP-2、MMP-14都有降解胶原酶的作用,但由于结构不同被划分到其他类。
1.2 明胶酶(Gelatinases)
包括 MMP-2和MMP-9,主要降解IV、V、XI型胶原,层粘蛋白以及蛋白多糖的核心蛋白等。最新的研究表明MMP-2能消化Ⅰ、Ⅱ、Ⅲ型胶原,而MMP-9缺乏这个能力[2-3]。
1.3 间质溶解素
包括 MMP-3、MMP-10、MMP-11,虽然具有与胶原酶相同的结构但是不能降解间质胶原,MMP-3和MMP-10结构和底物的特异性都较为相似,能降解大多数基质蛋白,MMP-10降解基质蛋白的能力较弱[4]。
1.4 溶解因子(Matrilysins)
包括MMP-7和MMP-26,MMP-7降解细胞外基质和细胞表面因子。MM P-26在一些正常细胞如子宫内膜和一些肿瘤细胞中表达,大部分存在细胞内,只能降解少数几种细胞外基质[5]。
1.5 膜型基质金属蛋白酶(MT-MMP)
包括 MTI-M MP(MMP-14)、MT2-MMP(MMP-15)、M T3-MMP(MMP-16)、(MMP-24)、MT4-MMP(MMP-17)、MMP-25,除能降解细胞外基质外,也能活化其他MMPs。
1.6 其他酶类
包括 MMP-18/19,MMP-20,MMP-23/24,目前作用不详[6]。
所有MMPs均由具有同源性的10个外显子和9个内含子组成,基质金属蛋白酶在结构(见图1)上有以下区域[7]:信号肽区域和酶原肽段区域;催化活性区域;羧基端区域;明胶结合区域;胶原同源区域;另外,膜型金属蛋白酶还有三个独特区域:在前肽区及催化区之间有一个含蛋白酶识别部位(RXKR)的结构区;在催化区域有一个含8个氨基酸的序列,其功能目前尚未明确;C末端的疏水跨膜区,该结构使其锚于细胞膜上,也因此而得名。
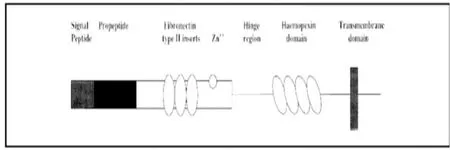
图1 MMPs家族的结构域
2 MMPS在肿瘤中的作用
MMPs的主要功能是对细胞外基质成分进行降解,这一特性为肿瘤细胞的侵袭转移创造了良好的条件,同时,这些细胞外基质分子降解后的片段又具有趋化作用,可促进肿瘤细胞移动。另外MMPs既可促进血管形成,也有抑制血管形成的作用:一方面降解ECM的组分,产生敏感的整合素结合位点,促进整合素信号转导或直接与内皮细胞内部受体A、B及C三结合促进其信号转导导有助于内皮细胞的存活和增殖;促进与ECM相关的血管形成因子的释放。另一方面,又从大前体细胞释放血管形成抑制因子。在肿瘤的发生发展中,前者起主导作用,为肿瘤细胞的生长和远处转移提供了微环境。早期的研究认为,MMPs只在肿瘤侵袭与转移中发挥重要作用;但是,最近的研究表明MMPs还参与了肿瘤发生发展过程中的其它许多步骤,包括肿瘤细胞的生长、分化、凋亡、肿瘤血管形成的调节以及免疫监视。
3 MMPS基因与食管癌
3.1 MMPS有关食管癌组织表达研究
目前,很多研究表明MMPS在恶性肿瘤组织有较高表达。Hmashita等[8]用RT-PCR方法研究51例食管鳞癌标本中的MMP-1 mRNA发现,MMP-1在肿瘤细胞中表达,而在正常食管粘膜细胞不表达;Samantaray等[9]应用免疫组化法检测58例食管鳞癌和44例远端的增生组织中MMP-2、MMP-9的表达,发现在食管癌组织及增生组织中MMP-2、MMP-9的表达明显高于正常组织,提示食管上皮增生是食管恶性肿瘤发生的早期事件。Shima[10]等实验发现 MMP-2、MM P-3在食管癌中高表达;Murray[11]等报道MMP-1与食管癌患者不良预后相关联。郭文忠[12]等人在研究血管内皮细胞生长因子和MMP-9在食管癌中的表达及低氧调节中,食管癌组织中MMP-9的表达显著高于癌旁组织,但MMP-9的表达与食管癌的血管形成、肿瘤的分化程度、淋巴结转移情况等无相关性,MMP-9基因表达水平不能预测食管癌的进展和转移潜能。Imai[13]等对早期食管癌研究发现,肿瘤细胞中MMP-7、MMP-9和M T1-MM P高表达,且与浸润深度、静脉转移密切相关,同时发现基质金属蛋白酶抑制物 TIMP-1表达减弱,检测食管肿瘤中MMP-2、MMP-3、MMP-7、MMP-9的阳性反应均位于肿瘤细胞胞浆和胞膜,表达明显高于癌旁正常组织。
3.2 MMPS有关食管癌的血清型研究
目前,有关食管鳞癌血清MMP含量变化的研究报道较少。Koyama[14]等用明胶电泳酶谱法对30例食管鳞癌病人进行血清MMP-9检测时发现,食管鳞癌患者血清MMP-9水平明显高于正常人,但并未发现其水平和肿瘤分期相关。提示MMP-9有望成为ESCC的肿瘤标志物,有关血清MMP-9水平的变化和病灶大小、临床特征、病理类型及预后推断中的应用有待于进一步研究。
3.3 MMPS有关食管鳞癌细胞株研究
Suzuki[15]等研究了五种食管癌细胞株(TE-series)中MMP-2,9的表达情况,结果显示其中四种细胞株(TE-5除外)均表达MMP-2和MMP-9,其中MMP-9在侵袭能力不同的细胞株之间的表达差异有统计学意义,提示MMP-9与食管癌的侵袭能力相关。
3.4 基因多态性与食管癌的相关性
近年来研究表明,MMPs在包括食管癌在内的多种肿瘤的发病机制中起着极为重要的作用,MM Ps成为肿瘤的候选易感基因,在对于多个MM P基因的启动子区域鉴定了一些单核苷酸多态性(Single nucleotide polymorphism,SNP)位点,这些多态性可能影响相应MMPs的表达,也有越来越多的证据显示这些遗传多态性可能在肿瘤的发生发展中导致个体间的差异[16-17]。
MMP-1(间质胶原酶)基因定位于染色体11q22-33,MMP-1可通过改变细胞的微环境作用于肿瘤发生的初始阶段,从而有利于肿瘤的形成,并参与多种肿瘤的侵袭及转移,较多的研究是针对M MP-1-1607 1G/2G,认为等位基因2G可能与肿瘤的发生或侵袭有关。这个观点已在乳腺癌、宫颈癌、肾细胞癌、结肠癌、肺癌等报道中得到证实。Jin等[18]对中国北方人群的研究结果显示MMP-1-1607 1G/2G的多态与食管鳞状细胞癌及贲门腺癌的发病风险无关,MM P-3-1612 5A/6A与MMP-9-1562C/T与乳腺癌[19]、胃癌[20]的易感性及预后有关。
MMP-3(间质溶素1)的基因位于染色体11q22,MMP-3基因启动子区上游–1171bp处存在着一个A核甘酸插入(5A/6A)多态性。对中国河北人群的研究显示,携带MMP-3 5A等位基因可增加吸烟个体患食管癌、非小细胞肺癌的易感性,并增加该两种肿瘤患者发生淋巴结转移的风险。Zhang[19]等研究证明,MMP-3启动子区-1171 bp处5A/6A SNP 5A等位基因能增加ESCC易感性和淋巴结转移的风险。MMP-3基因启动子区上游-1613bp处还存在着一个T核甘酸插入(5T/6T)多态性,减少m RNA的转录。Martin[21]等研究表明,MMP-3-1613bp的5T5T基因型的克隆氏病患者更容易并发狭窄。
MMP-9基因位于染色体20q12-q13,MMP-9 C/T多态位于启动子区转录起始点-1562bp处,为转录抑制因子的识别位点,C→T的改变破坏了抑制因子的识别结合序列,从而显著增加了启动子的活性[22],MMP-9 C-1562T与乳腺癌[23]、胃癌[24]的易感性及预后有关,并可能改变非肿瘤性疾病如冠状动脉疾病的易感性[25]。而在中国河北人群的研究中,并未发现MMP-9-1562 C/T多态性与非小细胞肺癌等肿瘤相关[26]。罗等对中国四川人群的研究中,MMP-9基因外显子上R279Q,P574R,R668Q多态性进行了研究,结果显示 MMP-9基因P574R中含有突变等位基因G的基因型GG、GG&CG的频率在健康对照组和病例组分布差异具有统计学意义。
4 问题与展望
通过查阅大量专业文献,我们发现由于MMPS SNP位点发现相对较晚,数目较少,目前,关于MMPS与食管癌的相关性研究主要集中在组织表达层面,而有关基因多态性与食管癌发生、发展和转移之间的相关性研究相对较少。但随着SNP的筛查技术和方法越来越简便,精确,高通量,SNP筛查水平的提高必将为食管癌的发生、发展、恶化、转移等各阶段的作用机制提供一个更微观的研究方法和思路。
由于食管癌是多基因、多阶段、进行性演变的过程,是多种基因变化累积或综合作用的结果。在医学研究中,必须积极寻找、研究食管癌相关基因,并通过分子生物学的基础研究来实现食管癌的早期筛查和临床治疗。
1 Rundhaug JE.Matrix metalloproteinases,angiogenesis,and cancer:commentary re:A.C.Lockhart et al.,Reduction of wound angiogenesis in patients treated with BMS-275291,a broad spectrum matrix metalloproteinase inhibitor.Clin.Cancer Res.,9:00-00,2003[J].Clin Cancer Res,2003,9(2):,551-554.
2 Aimes RT,Quigley JP.Matrix metalloproteinase-2 is an interstitial collagenase.Inhibitor-free enzyme catalyzes the cleavage of collagen fibrils and soluble native type I collagen generating the specific 3/4-and 1/4-length fragments[J].JBiol Chem,1995,270(11):5872-5876.
3 Patterson ML,Atkinson SJ,Knauper V,et al.Specific collagenolysis by gelatinase A,MMP-2,is determined by the hemopexin domain and not thefibronectin-like domain[J].FEBS Lett,2001,503(2-3):158-162.
4 Murphy G,Segain JP,O'Shea M,et al.The28-kDa N-terminal domain of mouse stromely sin-3 has the general properties of a weak metalloproteinase[J].J Biol Chem,1993,268(21):15435-15441.
5 Marchenko ND,Marchenko GN,Weinreb RN,et al.Beta-catenin regulates the gene of MMP-26,a novel metalloproteinase ex pressed both in carcinomasand normal epithelial cells[J].Int J Biochem Cell Biol,2004,36(5):942-956.
6 Kleiner DE,Stetler-Stevenson WG.Matrix metalloproteinases and metastasis[J].Cancer Chemother Pharmacol,1999,43(Suppl):S42-S51.
7 Mignatti P,Rifkin DB.Biology and biochemistry of proteinases in tumor invasion[J].Physiol Rev,1993,73(1):324-378.
8 Yanmashita K,Mori M,Kataoka A,et al.The Clinical significance of MMP-1 expression in esophageal carcinomas[J].Br J Cancer,2001,84(2):276-282.
9 Samantaray S,sharma R,Chattopadhyaya TK,et al.Increased expression of MM P-2 and MMP-9 in esophageal squamous cell Carcinoma[J].J Cancer Res Clin Oncol,2004,130(1):37-44.
10 Shaman I,Sasaguri Y,Kusukawa J,et al.Production of matrix metalloproteinase-2 and metalloproteinase-3 related to malignant behavior of esophageal carcinoma.A clinicopathologic study[J].Cancer,1992,70(12):2747-2753.
11 Murray GI,Duncan ME,O'Neil P,et al.Matrix metalloproteinase-1 is associated with poor prognosis in oesophageal cancer[J].J Pathol,1998,185(3):256-261.
12 郭文忠,冉宇靓,王贵齐,等.VEGF和 MMP-9在食管癌中的表达及低氧调节[J].中华肿瘤杂志,2002,24(1):48-51.
13 Imai K,Yokohama Y,Nakanishi I,et al.Matrix metalloproteinases-7 from human rectal carcinoma cell.A ctivation of the precursor,interaction with other matrix metallop roteinases and enzymic p roperties[J].JBiol Chem,1995,270(12):6691-6697.
14 Koyama H,Iwata H,Kuwabara Y,et al.Gelatinolytic activity of matrix metalloproteinase-2 and-9 in oesophageal carcinoma;a study using in situ zymography[J].Eur J Cancer,2000,36(16):2164-2170.
15 Mogg R,Batley J,Hanley S,et al.Characterization of the flanking regions of Zea mays microsatellites reveals a large number of useful sequence polymorp hisms.Theor Appl Genet,2002,105(4):532-543.
16 Zhou Y,Yu C,Miao X,et al.Functional haplotypes in the promoter of matrix metalloproteinase-2 and lung cancer susceptibility[J].Carcinogenesis,2005,26(6):1117-1121.
17 Zhang J,Jin X,Fang S,et al.The functional polymorphism in the matrix metallop roteinase-7 promoter increases susceptibility to esophageal squamous cell carcinoma,gastric cardiacadenocarcinoma and non-small cell lung carcinoma[J].Carcinogenesis,2005,26(10):1748-1753.
18 Jin X,Kuang G,Wei L Z,et al.No association of the matrix metalloproteinase 1 promoter polymorphism with susceptibility to esophageal squamous cell carcinoma and gastric cardiac adenocarcinoma in northern China[J].World J Gastroenterol,2005,11(16):2385-2389.
19 Zhang J,Jin X,Fang S,et al.The functional SNP in the matrix metalloproteinase-3 promoter modifies susceptibility and lymphatic metastasis in esophageal squamous cell carcinoma but not in gastric cardiac adenocarcinoma[J].Carcinogenesis,2004,25(12):2519-2524.
20 Fang S,Jin X,Wang R,et al.Poly morphisms in the MMP1 and MMP3 promoter and non-small cell lung carcinoma in North China[J].Carcinogenesis,2005,26(02):481-486.
21 Meijer MJ,Mieremet-Ooms MA,van Hogezand RA,et al.Role of matrix metalloproteinase,tissue inhibitor of metalloproteinase and tumor necrosis factor-αsingle nucleotide gene polymorphisms in inflammatory bowel disease[J].World J Gastroenterol,2007,13(21):2960-2966.
22 Morgan A R,Zhang B,Tapper W,et al.Haplotypic analysis of the MMP-9 gene in relation to coronary artery disease[J].J Mol Med,2003,81(5):321-326.
23 Grieu F,Li WQ,Iacopetta B.Genetic polymorphismsin the MM P-2 and MMP-9 genes and breast cancer phenotype[J].Breast Cancer Res Treat,2004,88(3):197-204.
24 Matsumura S,Oue N,Nakayama H,et al.A single nucleotide polymorphism in the MM P-9 promoter affects tumor progression and invasive phenotype of gastric cancer[J].J Cancer Res Clin Oncol,2005,131(1):19-25.
25 Morgan AR,Zhang B,Tapper W,et al.Haplotypic analysisof the MMP-9 gene in relation to coronary artery disease[J].J Mol Med,2003,81(5):321-326.
26 Wang Y,Fang S,Wei L,et al.No association between the C-1562T polymorphism in the promoter of matrix metalloproteinase-9 gene and non-small cell lung carcinoma[J].Lung Cancer,2005,49(2):19-25.

