妊娠期糖尿病患者内脏脂肪素水平与胰岛素抵抗的关系*
华绍芳 韩玉环 匡德凤
妊娠期糖尿病(GDM)指妊娠期发生的不同程度的糖耐量异常。胰岛素抵抗(IR)及潜在的胰岛β细胞功能不足可能是GDM发病的关键因素。脂肪细胞及其分泌因子在介导IR发生中的作用日益受到关注,内脏脂肪素(visfatin)是新近发现的一种脂肪细胞因子[1],其可能参与了肥胖及2型糖尿病等疾病的发生[2]。本研究通过检测妊娠期葡萄糖代谢异常患者血清visfatin水平,探讨其与胰岛素抵抗及GDM发生的相关性。
1 对象与方法
1.1 研究对象 选取2009年3月—12月在我院产科行剖宫产术终止妊娠的女性106例,均在孕24~28周,口服75 g葡萄糖行葡萄糖耐量试验(OGTT),排除有妊娠期高血压、肝肾疾病、多囊卵巢综合征及胎膜早破等疾病者,排除妊娠前患有糖尿病者。依据美国糖尿病学会(ADA)的标准分为妊娠期糖尿病(GDM,n=50)组、妊娠期糖耐量受损(GIGT,n=24)组和正常糖耐量(NGT,n=32)组。3组年龄、产次及孕周差别无统计学意义(P>0.05),见表1。
表1 3组年龄、产次及孕周比较 ±s)

表1 3组年龄、产次及孕周比较 ±s)
均P>0.05
组别GDM组GIGT组NGT组F n 50 24 32年龄(岁)30.58±5.19 30.67±4.04 29.34±3.35 0.903产次(次)1.28±0.45 1.13±0.34 1.22±0.42 1.112孕周(周)38.55±1.02 38.90±1.17 38.78±0.87 1.118
1.2 方法
1.2.1 临床资料收集 记录孕妇的身高、孕前及分娩时的体质量,计算体质量指数(BMI)。酶法检测总胆固醇(TC)和三酰甘油(TG)水平;高效液相色谱法检测糖化血红蛋白(HbA1c)水平。
1.2.2 血液指标检测 分娩当日空腹抽取肘正中静脉血5 mL,2 000 r/min,离心10 min。留取血清分装于冻存管内,-80℃冰箱贮存待测。静置30 min,2 000 r/min离心10 min后取上清。化学发光法检测空腹血清胰岛素(FINS)水平;氧化酶法检测空腹血浆葡萄糖(FPG)水平;双抗体夹心酶标免疫(ELISA)分析法检测血清visfatin水平。IR指数(HOMA-IR)=(FPG×FINS)/22.5。
1.3 统计学分析 采用SPSS 13.0统计软件包进行分析,计量资料用均数±标准差±s)表示,均数比较用单因素方差分析,组间两两比较采用SNK-q检验。两变量关系用Pear⁃son相关分析,逐步多元回归分析HOMA-IR影响因素,以P<0.05为差异有统计学意义。
2 结果
2.1 3组孕妇一般指标比较 3组孕妇孕前体质量差异无统计学意义(P>0.05),GDM组孕前BMI、孕晚期平均体质量及孕期体质量增加值均高于GIGT和NGT组,差异有统计学意义(P<0.05或P<0.01),见表2。
2.2 3组孕妇血清visfatin、FINS、IR指数及糖脂代谢指标比较 GDM组visfatin水平高于GIGT组和NGT组,GIGT组高于NGT组,差异均有统计学意义(P<0.05或P<0.01)。与NGT组比较,GDM及GIGT组均有较高的FINS水平(P<0.05或P<0.01),GDM组HOMA-IR、HbA1c、TC及TG水平均高于GIGT和NGT组,差异有统计学意义(均P<0.01),见表3。
表2 3组孕妇一般指标比较 ±s)
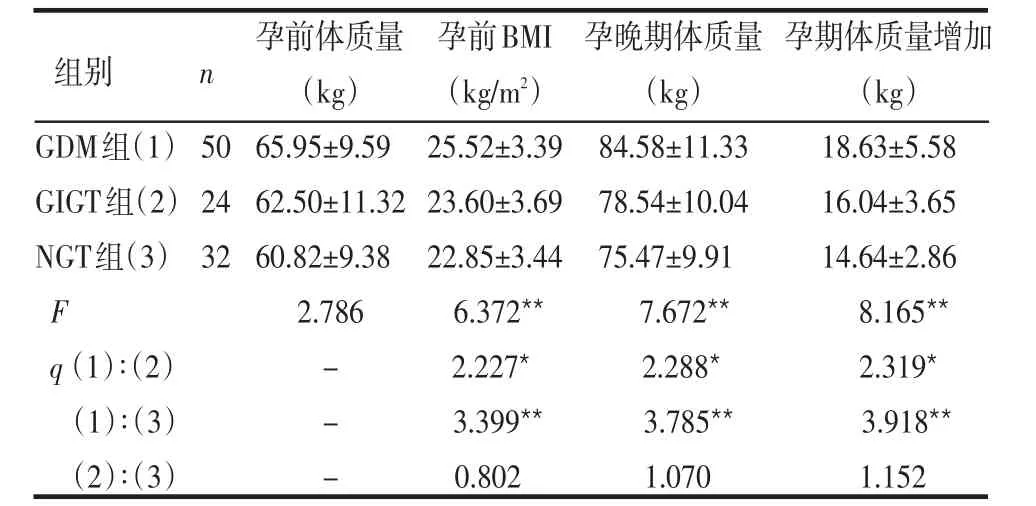
表2 3组孕妇一般指标比较 ±s)
*P<0.05,**P<0.01
GDM组(1)GIGT组(2)NGT组(3)F q(1)∶(2)(1)∶(3)(2)∶(3)50 24 32孕前体质量(kg)65.95±9.59 62.50±11.32 60.82±9.38 2.786---孕前BMI(kg/m2)25.52±3.39 23.60±3.69 22.85±3.44 6.372**2.227*3.399**0.802孕晚期体质量(kg)84.58±11.33 78.54±10.04 75.47±9.91 7.672**2.288*3.785**1.070孕期体质量增加(kg)18.63±5.58 16.04±3.65 14.64±2.86 8.165**2.319*3.918**1.152组别 n
表3 3组孕妇visfatin、FINS及糖脂代谢指标比较±s)
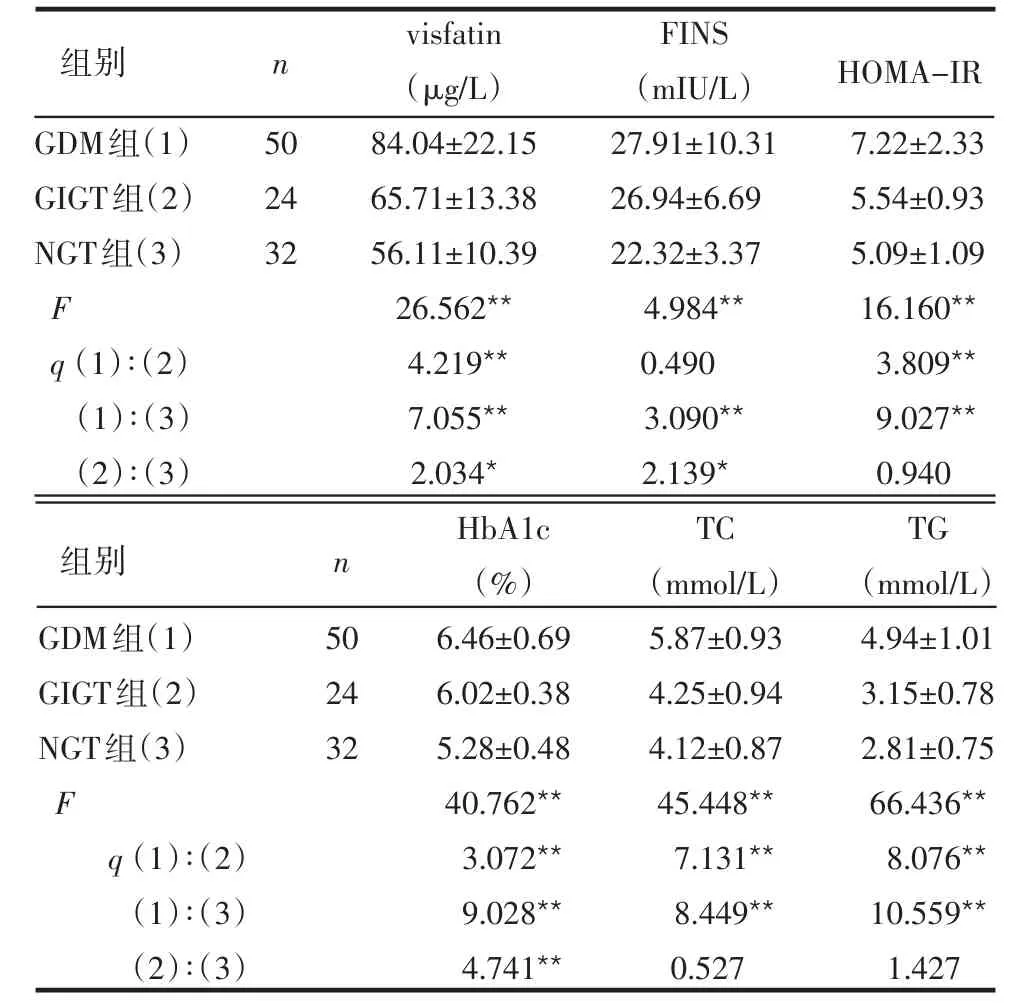
表3 3组孕妇visfatin、FINS及糖脂代谢指标比较±s)
*P<0.05,**P<0.01
GDM组(1)GIGT组(2)NGT组(3)F q(1)∶(2)(1)∶(3)(2)∶(3)50 24 32 visfatin(μg/L)84.04±22.15 65.71±13.38 56.11±10.39 26.562**4.219**7.055**2.034*FINS(mIU/L)27.91±10.31 26.94±6.69 22.32±3.37 4.984**0.490 3.090**2.139*7.22±2.33 5.54±0.93 5.09±1.09 16.160**3.809**9.027**0.940 HbA1c(%)6.46±0.69 6.02±0.38 5.28±0.48 40.762**3.072**9.028**4.741**TC(mmol/L)5.87±0.93 4.25±0.94 4.12±0.87 45.448**7.131**8.449**0.527 TG(mmol/L)4.94±1.01 3.15±0.78 2.81±0.75 66.436**8.076**10.559**1.427 GDM组(1)GIGT组(2)NGT组(3)F q(1)∶(2)(1)∶(3)(2)∶(3)50 24 32组别 n HOMA-IR组别 n
2.3 visfatin、HOMA-IR与临床指标的相关性 孕妇空腹血清visfatin与HOMA-IR呈正相关(r=0.738,P<0.01),visfatin、HOMA-IR与FINS、孕期体质量增加、HbA1c、TC和TG均呈正相关,与孕前BMI无相关,见表4。

表4 孕妇Visfatin、HOMA-IR与临床指标的相关性 (r)
2.4 影响HOMA-IR的因素研究 以HOMA-IR为因变量,以孕前BMI、孕期体质量增加、血清visfatin、FINS、TC、TG为自变量,进行多元线性逐步回归分析,结果进入方程的变量有血清FINS(β=0.503,P=0.001)、visfatin(β=0.379,P=0.001)及孕期体质量增加(β=0.158,P=0.005),是HOMA-IR的影响因素。
3 讨论
Burt于1956年首次提出妊娠期存在IR的观点,生理性IR有助于胎儿的营养供应;但GDM女性的IR程度和胰岛素分泌能力均高于正常女性,胰岛素分泌能力的增加不能改善IR的增加,外周组织对胰岛素敏感性的降低减少了母体组织对葡萄糖的吸收,从而导致高血糖的发生[3]。本研究显示,GDM患者FINS及HOMA-IR均高于糖耐量正常的妊娠女性,证实GDM患者存在IR和高胰岛素血症。母亲超重、肥胖及孕期体质量增长过快是公认的影响GDM的危险因素。本研究显示GDM患者孕期体质量平均增加明显高于糖耐量正常者,而孕期体质量增加值与HOMA-IR呈正相关。孕期肥胖或体质量增长过速可引起脂肪细胞因子瘦素的表达异常,从而增加胰岛素抵抗,高胰岛素血症会活化氨基酸转运系统,促进蛋白、脂肪合成和抑制脂肪分解,引发机体糖、脂、蛋白质等一系列代谢紊乱,导致GDM的发生[4]。本组GDM患者TC和TG水平均升高也证实了这一点。
脂肪组织是体内最大的能量储存库,妊娠过程中,脂肪细胞因子通过对物质代谢、能量供给等的调节使脂肪组织和生殖系统产生密切联系。新型脂肪细胞因子visfatin对脂肪组织具有自分泌和旁分泌的双重作用,有利于脂肪组织的分化和脂肪积累。其内分泌功能可以调节外周组织对胰岛素的敏感性;当特定组织visfatin的水平较高时,其旁分泌功能还可模拟胰岛素的功能[5]。visfatin异常高表达与内脏型肥胖、2型糖尿病等密切相关。Morgan等[6]研究发现妊娠女性血清visfatin水平显著高于未孕女性。也有研究发现高水平的visfatin可能参与了正常妊娠过程的IR[7]。Fasshauer等[8]的研究则提示高水平的visfatin可能通过增加IR及引发的炎症状态参与妊娠期高血压疾病的发生。Lewandowski等[9-10]的研究显示GDM患者visfatin水平升高,与本研究结果一致。有研究显示妊娠晚期女性大网膜组织visfatin mRNA表达水平与孕前BMI呈正相关[11];而本研究未发现两者呈相关性,但孕期体质量增加值与visfatin水平呈正相关,提示孕期营养过剩女性存在visfatin的过度表达。visfatin水平与HbA1c、TC及TG水平均呈正相关,提示高水平表达的visfatin可能参与了糖脂代谢的过程,从而引发GDM。本研究还显示血清visfatin、FINS及孕期体质量增加是影响HOMA-IR的因素,提示visfatin参与GDM的发生可能不完全是由胰岛素及其下游信号通路所介导的,但其具体机制的研究尚有待深入。
[1]Fukuhara A,Matsuda M,Nishizawa M,et al.Visfatin:a protein se⁃creted by visceral fat that mimics the effects of insulin[J].Science,2005,307(5708):426-430.
[2]Adeghate E.Visfatin:structure,function and relation to diabetes mellitus and other dysfunctions[J].Curr Med Chem,2008,15(18):1851-1862.
[3]Kopp W.Role of High-insulinogenie nutrition in the etiology of ges⁃tational diabetes mellitus[J].Med Hypotheses,2005,64(1):101-103.
[4]Ategbo JM,Grissa O,Yessoufou A,et al.Modulation of adipokines and cytokines in gestational diabetes and macrosomia[J].J Clin En⁃docrinol Metab,2006,91(10):4137-4143.
[5]Sethi JK,Vidal-Puig A.Visfatin:the missing link between intra-ab⁃dominal obesity and diabetes[J]?Trends Mol Med,2005,11(8):344-347.
[6]Morgan SA,Bringolf JB,Seidel ER.Visfatin expression is elevated in normal human pregnancy[J].Peptides,2008,29(8):1382-1389.
[7]Mastorakos G,Valsamakis G,Papatheodorou DC,et al.The role of adipocytokines in insulin resistance in normal pregnancy:Visfatin concentrations in early pregnancy predict insulin sensitivity[J].Clin Chem,2007,53(8):1477-1483.
[8]Fasshauer M,Waldeyer T,Seeger J,et al.Serum levels of the adipo⁃kine Visfatin are increased in pre-eclampsia[J].Clin Endocrinol(Oxf),2008,69(1):69-73.
[9]Lewandowski KC,Stojanovic N,Press M,et al.Elevated serum lev⁃els of Visfatin in gestational diabetes:a comparative study across various degrees of glucose tolerance[J].Diabetologia,2007,50(5):1033-1037.
[10]Krzyzanowska K,Krugluger W,Mittermayer F,et al.Increased Vis⁃fatin concentrations in women with gestational diabetes mellitus[J].Clin Sci(Lond),2006,110(5):605-609.
[11]梁艳,徐先明,王红声,等.内脏脂肪素mRNA表达变化与妊娠期糖尿病的相关性[J].中华妇产科杂志,2008,43(11):824-827.

