不同形式的氮源对活体外瘤胃氨氮释放和发酵参数的影响
东北农业大学动物科技学院 辛杭书 张永根
中国农业大学动物科技学院 孟庆翔*
美国兰科矿物质公司 Dirk E A
国际原料公司 刘庆平
氨是瘤胃微生物生长发育所必需的物质,而瘤胃中的氨来自于氨基酸的脱氨基和非蛋白氮(NPN)的降解。尿素作为一类含氮高、成本低、经济有效的非蛋白氮产品,被广泛应用于反刍动物生产中,但其降解过快(降解速度是微生物利用速度的4倍)及碳氮源发酵不同步是造成尿素利用率低的主要限制因素。所以,国内外研究学者千方百计的探讨如何达到尿素在瘤胃内缓释氨氮,或将尿素与谷物淀粉(Helmer等,1970)、糖蜜等通过加压加热处理生产各种复合尿素产品(Madhu Mohini和Gupta,1993),或将尿素进行包被处理(Galo 等,2003;Tedeschi等,2002),但将这些产品应用到实践中,效果并不一致。
Helmer等(1970)率先提出糊化淀粉尿素中变性的淀粉组分更容易被细菌和原虫利用,微生物蛋白产量比单用尿素与谷物混合饲喂时明显提高。我国畜牧工作者也对糊化尿素制备及实践应用进行研究,取得了较满意的效果(单达聪和熊六飞,2007;顾炳龙等,1996)。糊化淀粉尿素是在适合温度(121~176℃)及压力(28~35 kg/cm2或2744~3430 kPa)下,生成的淀粉与尿素的均匀混合物。而有学者提出,在颗粒料生产过程中的高温高压条件下,饲料原料中所含的尿素、胺盐等含氮有机化合物有可能部分聚合为“三聚氰胺”类的化合物(林建云,2008)。然而,糊化淀粉尿素中是否有可能含“三聚氰胺”尚未见报道。本试验选用普通尿素、糊化淀粉尿素、包被尿素(快速型和慢速型)和大豆分离蛋白,比较这五种不同形式氮源体外氨氮释放速度,并分别测定“三聚氰胺”的含量,为在反刍动物生产中安全合理使用尿素提供试验依据。
1 材料与方法
1.1 样品来源 玉米采自河北凯特饲料厂,品种为当地玉米,用锤片式粉碎机粗粉碎(孔径约为2 mm)后再用旋风磨(1.0 mm)进一步细粉碎,置于塑料封口袋中供下一步组分分析及配料使用。普通尿素为化学纯,糊化尿素为商品来源,蛋白质含量为74.8%;两种包被尿素均来自于美国Granco公司,以不能被瘤胃降解的聚氨基甲酸酯为包被材料,采用特殊的半透膜包被技术,主要成分含量为:尿素78%~96%,蜡质0.3%~0.5%,色素0% ~0.11%。
1.2 样品准备及试验设计 参考美国NRC肉牛营养需要,根据每种原料由氮素自动分析仪(Rapid N III,Elementar,Germany)测定的蛋白质含量配制成蛋白质含量为12.5%(干物质基础)的半纯合等氮日粮,以玉米作为主要碳源底物,添加不同形式的氮源即普通尿素(负对照)、包被尿素(快速和慢速)、糊化淀粉尿素和大豆分离蛋白,采用单因子试验设计,每种日粮设3个平行,整个试验在不同天内重复2次。
1.3 活体外发酵
1.3.1 活体外人工瘤胃产气量测定 采用Menke等 (1979)的活体外产气法进行体外试验。将0.2 g(精确至0.0001 g)的不同日粮放入100 mL人工瘤胃培养管(德国Häberle公司,有效体积100 mL,最小分度1 mL)中,39℃预热。于晨饲前通过瘤胃瘘管分别采集4头试验牛的瘤胃内容物,等体积混合后,以4层纱布过滤,并迅速加入装有经CO2饱和并预热39℃的缓冲液中,配制成混合培养液(瘤胃液与缓冲液配比为1∶2)。用自动加液器向各培养管加入30 mL混合培养液,迅速放入已预热(39℃)的活体外人工瘤胃培养箱中培养,一组培养管(三个)用于测定产气量,分别记录培养 1、2、3、4、5、6、8、10、12、16、20、24、28、32、36、40、44、48、56、64 h 和 72 h 各培养管活塞的刻度值(mL)。
同时,将各组底物进行另一批次3个重复的培养,测定24 h底物干物质的消化率。在39℃培养24 h后,将培养管中内容物全部倒入50 mL离心管中,5400 r/min离心15 min,沉淀烘干用于计算干物质消化率。上清液用于测定pH、挥发性脂肪酸(VFA)和NH3-N浓度等瘤胃发酵参数。活体外发酵试验重复2次进行。
1.3.2 主要检测指标及分析方法 分别在0、1、2、4、6、8、12、18 h 和 24 h 取发酵液,离心后-20 ℃下冷冻,供NH3-N的测定,并测定24 h的VFA含量和干物质消化率。pH值采用雷磁PHS-3C型精密pH计(数显读数精度0.01)发酵结束后迅速测定;NH3-N浓度测定采用 Broderick和 Kang(1980)的方法;VFA含量采用3420气相色谱仪(北京分析仪器厂)进行分析。取1mL分离液相,加入0.2 mL 25%(m/V)偏磷酸摇匀后冰浴超过30 min,10000 g离心10 min,取上清液用于色谱分析。色谱条件:PEG-20M+H3PO4玻璃填充柱,色谱柱为内径3 mm、长2 m;载气为氮气,流速45 mL/min,氢气流速35 mL/min,空气流速250 mL/min,氢焰离子检测器,柱温150℃,离子化室温度 220 ℃,灵敏度 107,衰减 4,进样量 0.6 μL;干物质测定采用国标GB/T 6435-1986;三聚氰胺的测定采用农业部标准NY/T 1372-2007。
1.4 统计处理 采用SAS(1996)统计软件进行两因子方差分析,计算0.2000 g日粮干物质活体外净产气量(72 h),并根据数学模型GP=B×[1-exp(-c × t)],利用 SAS(1996)统计软件中 NONLINEAR方法计算样本的动态产气参数,式中:GP为t时间点0.2000 g底物DM的产气量,mL;B为0.2000 g底物DM的理论最大产气量,mL;c为样本产气速度,h;t为活体外培养时间,h。
产气量、产气参数、干物质消化率及瘤胃发酵参数等各项检测指标均采用SAS统计分析软件(SAS,1999)中的广义线性模型(GLM)进行独立样本T检验。
2 结果与讨论
2.1 不同形式氮源对活体外瘤胃氨氮释放动态的影响 表1列出了活体外发酵中含不同形式氮源的日粮0~24 h氨氮浓度变化的结果。从表中可以看出,不同形式氮源显著影响0~12 h氨氮释放速度(P<0.05),其中两种包被尿素的氨氮浓度在各时间点均低于其他处理组。从整体趋势上看,所有处理组的氨态氮浓度在0~1 h上升,然后逐渐下降,在8 h(普通尿素组和糊化尿素组)或12 h(包被尿素组和大豆分离蛋白组)再次上升。糊化尿素组的氨态氮浓度均与普通尿素组相一致,未见显著差异,前人的一些研究也发现将糊化尿素添加到动物饲粮中,并没有明显改善瘤胃中氨氮的释放速度(Coppock等,1976),这可能与糊化尿素的制作原料的选用及生产方法不同有关。本试验中,未见其能显著减缓氨氮释放速度,也可能是糊化尿素制作过程中对玉米的糊化程度不足所致。而对于两种包被尿素,除在4 h时,快速释放包被尿素的氨氮浓度显著高于慢速释放包被尿素外 (P<0.0001),其余时间点均无明显影响,并且与大豆分离蛋白组氨氮的释放趋势相似。
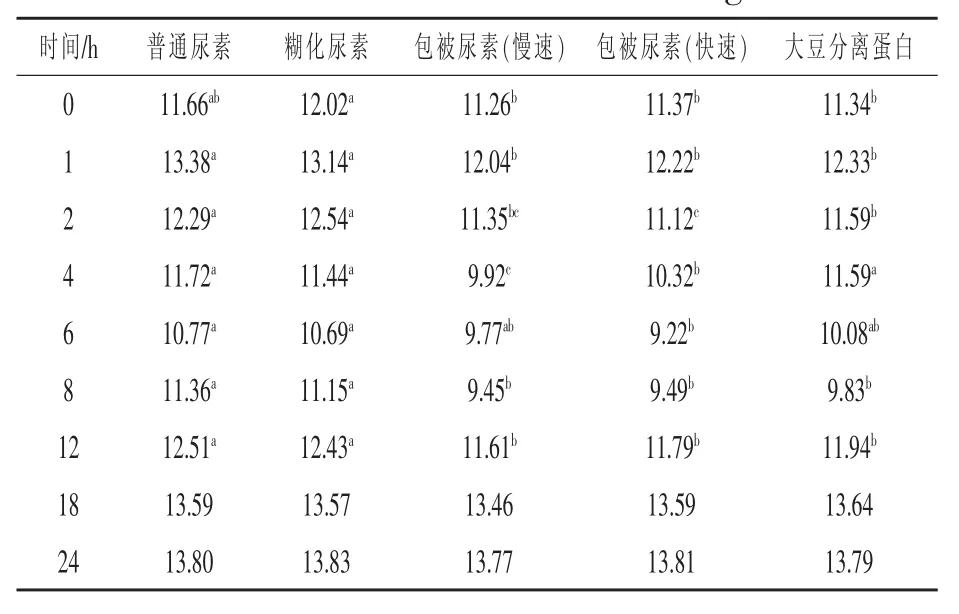
表1 不同形式氮源的活体外发酵氨氮浓度动态变化mg/100 mL
从表1可以看出,每种氮源处理日粮的氨氮浓度都先升高,再逐渐降到最低,然后再次上升,这可能是由于随着饲粮的发酵和微生物的利用所导致氮素的不足,从而使瘤胃液中微生物自身发生分解所致。
本试验中还分别对各种原料进行了“三聚氰胺”的测定,发现除了糊化尿素外,其他原料均未检出。而糊化尿素中的“三聚氰胺”检出量为24 mg/kg。林建云(2008)在探讨“颗粒饲料与三聚氰胺”时提出,颗粒配合饲料的造粒过程中很有可能产生三聚氰胺类物质,糊化尿素的生产同样也是在高温高压下将谷物淀粉、尿素及其他一些缓释剂混合糊化而成,与颗粒饲料的生产过程相似,所以很有可能是在糊化淀粉制作过程中促进了三聚氰胺的合成。但也有研究学者认为糊化淀粉的加工温度为80~125℃,压力为1.8~3.0 MPa,温度不够,没有催化剂,与三聚氰胺生产所需的条件不相吻合,不具备产生三聚氰胺的化学反应条件(李胜利,2008)。 林祥梅等(2008)采用灌胃方式给予小鼠三聚氰胺,结果发现,在日粮中添加三聚氰胺饲喂小鼠的全部不致死的最大剂量是5000 mg/kg。而本试验中糊化淀粉中三聚氰胺的含量远未达到此剂量,但对于糊化淀粉过程是否能产生三聚氰胺类化合物及其在饲料原料中使用安全性的机理性研究还尚未见报道,仍有待进一步探讨。
2.2 含不同形式氮源日粮对活体外发酵动态产气参数和发酵参数的影响 见表2。由表2显示,普通尿素组的72 h产气量在数值上比其他处理组低1.65~2.86 mL,但统计上差异并不显著(P>0.05),同样,产气速度、pH及24 h干物质消化率也未见明显变化。日粮发酵后的产气量及挥发酸总量主要与其中的碳水化合物含量有密切相关,五种处理日粮均以玉米为主要碳源,所以其产气量和总挥发酸含量均未见显著性差异。而对于各种挥发酸的摩尔比例,不同氮源显著影响发酵液中戊酸的含量,其中大豆分离蛋白组具有最高的戊酸含量 (1.34 mmol/100 mol总挥发性脂肪酸),包被缓释尿素 (慢速)组的戊酸含量最低(1.13 mmol/100 mol总挥发性脂肪酸),其他处理组居中。戊酸是瘤胃发酵过程中碳水化合物及氨基酸代谢的终产物,主要是赖氨酸和精氨酸这两种氨基酸的代谢,而有研究显示(张泽生等,2007),大豆分离蛋白中的赖氨酸和精氨酸的含量分别为47.9 mg/g和61.7 mg/g,而糊化尿素和包被缓释尿素几乎不含有氨基酸,这可能造成大豆分离蛋白组戊酸含量高的原因之一。
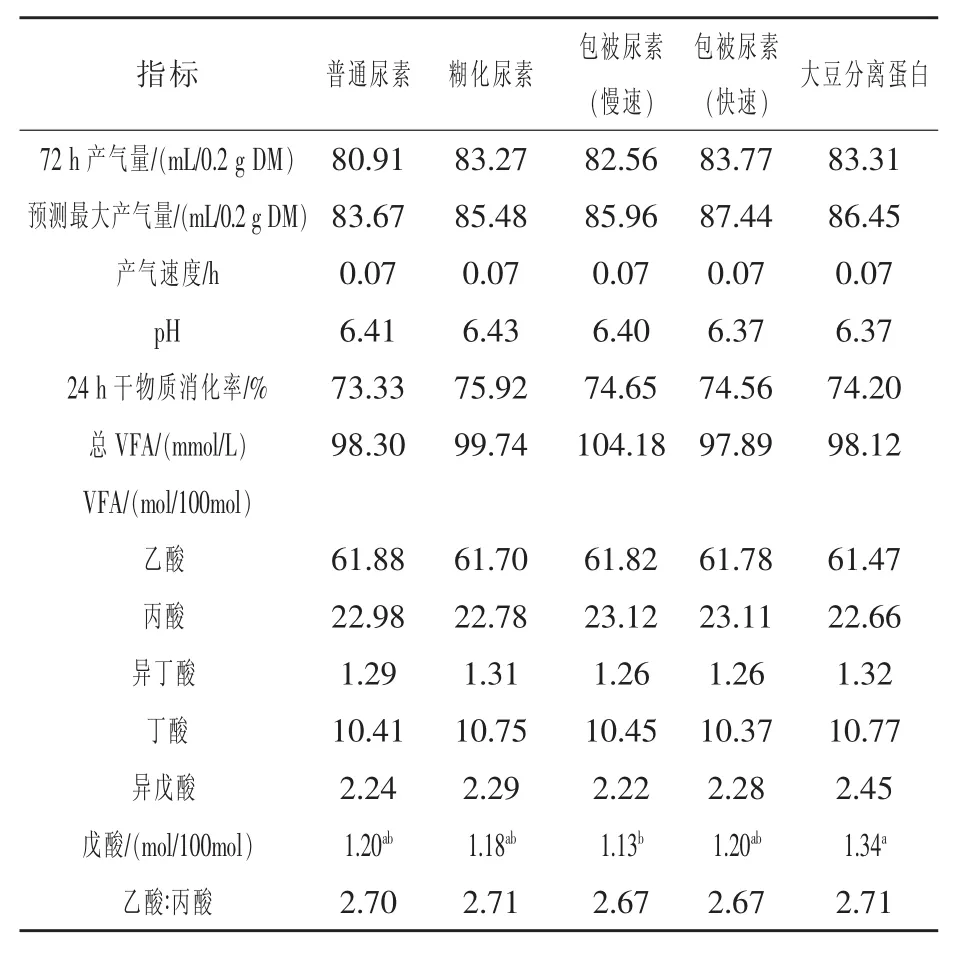
表2 不同形式氮源日粮活体外产气动态参数及发酵参数
3 结论
不同形式的氮源显著影响活体外瘤胃氨氮释放速度,两种包被尿素显著降低了瘤胃氨氮释放,与大豆分离蛋白相似,除在4 h时,快速释放包被尿素的氨氮浓度显著高于慢速释放包被尿素外,其余时间点均未见二者有显著的不同;糊化淀粉尿素并没有减缓氨氮的释放,并检测出其含有三聚氰胺,虽然其含量较低,但对其产生的机理及将其作为原料添加在动物饲粮中的安全性研究还有待进一步研究。
[1]单达聪,熊六飞.糊化淀粉尿素在圈养母羊日粮中的应用效果[J].中国草食动物,2007,5:19 ~ 21.
[2]顾炳龙,姚龙涛,丁晓明,等.糊化淀粉尿素对山羊消化代谢和增重的效果[J].中国畜牧杂志,1996,6:11 ~ 14.
[3]李胜利.三聚氰胺相关问题答疑(与饲料相关的问题)[Z].2008来自于网络http://lisheng0677.blog 163.com/.
[4]林建云.颗粒饲料中含三聚氰胺问题的探讨[Z].2008.来自于网络http://www.fjof.gov.cn/extra/col16/%E9%A2%97%E7%B2%92%E9%A5%B2%E6%96%99%E4%B8%AD%E5%90%AB%E4%B8%89%E8%81.
[5]林祥梅,王建峰,贾广乐,等.三聚氰胺的毒性研究[J].毒理学杂志,2008,22(3):216 ~ 218.
[6]张泽生,郭宝芹,刘素稳,等.2007.乳清浓缩蛋白和大豆分离蛋白的营养价值评价[J].大豆通报,2007,5:22 ~ 30.
[7]Broderick G A,Kang J H.Automated simultaneous determination of ammonia and amino acids in ruminal fluids,in vitro media[J].J Dairy Sci,1980,63:64 ~ 75.
[8]Coppock C E,Peplowski M A,Lake G B.Effect of urea form and method of feeding on rumen ammonia concentration[J].J Dairy Sci,1976,59 (6):1152~1156.
[9]Galo E,Emanuele S M,Sniffen C J,et al.Effects of a polymer-coated urea product on nitrogen metabolism in lactating Holstein dairy cattle[J].J Dairy Sci,2003,86:2154 ~ 2162.
[10]Helmer L G,Bartley E E,Deyoe C W,et al.Feed processing.V.Effect of an expansion-processed mixture of grain and urea (Starea)on nitrogen utilization in vitro[J].J Dairy Sci,1970,53:330 ~ 335.
[11]Helmer L G,Bartley E E,Deyoe C W.Feed processing Ⅵ Comparison of starea,urea and soybean as protein sources for lactating cows[J].J Dairy Sci,1970,53:883 ~ 887.
[12]Madhu Mohini,Gupta B N.Nutrient utilization in buffaloes fed paddy straw supplemented with block feeding on rumen metabolites and digesta flow rate in buffalo calves[J].J India Anim Nutr,1993,10:217 ~ 221.
[13]Menke K,Raab L,Salewski A,et al.The estimation of the digestibility and metabolizable energy content of ruminant feedingstuffs from the gas production when they are incubated with rumen liquor in vitro[J].J Agric Sci Camb,1979,93:217 ~ 222.
[14]Tedeschi L O,Baker M J,Ketchen D J,et al.Performance of growing and finishing cattle supplemented with a slow-release urea product and urea[J].Can J Anim Sci,2002,82:567 ~ 573.

