西南地区小果油茶群体遗传多样性的SRAP分析
杨 扬 ,洪亚辉,黄 勇,姚小华,王开良
(1.湖南农业大学细胞生物学实验室,湖南 长沙 410128;2.中国林科院亚热带林业研究所,浙江 富阳 311400;3.福建省林业科学研究院,福建 福州 350012)
小果油茶(Camellia meiocarpaHu.)又名江西子、小茶、鸡心子等,是山茶科山茶属植物,从其茶籽中提取的茶油是我国主要的木本食用油料。小果油茶主要分布在江西中南部、广西东北部、湖南东南部、湖北东南部、广东北部以及福建省的中南部和西北部[1]。由于多年来重采轻育,许多地区疏于管理,导致了小果油茶种植面积迅速缩小,“后继无林”现象十分突出。因此,加快小果油茶品种改良步伐,提高良种化水平,成为了当务之急。传统育种方式很难对一个或者多个性状进行有效的改良,环境效应又较易掩盖基因效应,因而育种者对目标性状的选择既费时又耗力。从分子水平上研究小果油茶的亲缘关系与遗传多样性就显得尤为重要。
目前遗传结构研究已成为保护遗传学研究的热点[2-4]。SRAP分子标记是由Li和Quiros[5]开发的一种基于PCR扩增的新型分子标记技术。它是一个评价遗传多样性、品种鉴定和系统发生的有效工具。目前从分子角度对油茶的研究还几乎处于空白,仅黄永芳等[6-7]利用RAPD、王保明等[8-11]利用ISSR,对不同油茶无性系的基因组DNA进行遗传多样性分析,结论是不同油茶无性系基因型间存在着丰富的遗传多样性。SRAP分子标记具有多态性高、检测手段简单、成本低廉等优点,在腊梅(Chim onanthus praecox(L.)Link)[12]、新疆野苹果(Malus sieversii)[13]、狗牙根(Cy nodon)[14]、老芒麦(El ymus sibi ricus)[15]等植物的遗传多样性研究应用较广。本试验使用SRAP技术对小果油茶种群的遗传多样性进行了初步研究,以了解中国小果油茶的遗传多样性的现状以及遗传多样性的变化规律,为小果油茶分类和良种选育提供一些科学依据。
1 材料与方法
1.1 材料
供试材料:小果油茶的新鲜幼嫩叶片,采样时单株间相距50 m以上,叶片用硅胶干燥保存。共采集6个不同群体的180份样品(表1)。

表1 小果油茶群体生长地基本状况
SRAP引物:根据Li和Quiros的SRAP引物设计原则设计引物,由上海生工生物工程技术服务有限公司合成引物。
1.2 方法
1.2.1 小果油茶总DNA的提取 采用改良CTAB[16]法提取小果油茶总DNA,在1%琼脂糖凝胶上检测DNA质量,紫外分光光度计检测DNA浓度,稀释至 50 ng/μL,-20℃保存备用。
1.2.2 SRAP-PCR扩增 在郑婷婷等[17]SRAP扩增条件的基础上,试验了各种不同的扩增条件,获得了最佳扩增反应体系和步骤。小果油茶20 μL的扩增体系:Taq 聚合酶量为 1.0 U,50 ng/μL 模板DNA, 2.5 mmol/L dNTPs,10 ×Buffer,50mmol/L Mg2+,10 mmol/L上游引物下游引物,不足部分由去离子水补足。
SRAP扩增在ABI 2720 Thermal Cycler PCR仪上进行。PCR扩增参见Li和Quiros[2]的方法,略有改动。扩增程序为:94℃预变性5 min;94℃变性1 min,35℃退火 1 min,72℃延伸 1 min,5 个循环;94℃变性 1 min,50℃退火 1 min,72℃延伸 1 min,35个循环;最后72℃延伸10 min,4℃保存。采用6%变性聚丙烯酰胺凝胶电泳检测PCR扩增产物,电泳结束后Na2CO3银染法染色显影,阴凉通风处干燥,进行扫描采集图像,观察分析条带。
1.2.3 数据统计分析 选取清晰可辨的电泳条带,有带记为“1”,无带记为“0”,得到原始 0,1 矩阵图。运用POPGENE3.2计算多态性条带(N)、多态位点百分率(P)、观测等位基因数(Na)、有效等位基因数(Ne)、Nei基因多样性指数(H)和 Shannon信息指数(I)、群体内总遗传多样性(Ht)、群体内遗传多样性 (Hs)、群体间遗传多样(Dst)、群体间遗传分化系数(Gst)和基因流动系数(Nm),Nei原则计算的 6个种群间的遗传一致度和遗传距离。基于遗传一致度矩阵运用NTSYS2.10进行UPGMA聚类分析。
2 结果与分析
2.1 扩增结果及多态性分析
从87对参试引物中筛选出重现性好、条带清晰可辨、多态性高的9对引物用于SRAP扩增(引物名称和序列见表2)。供试引物共扩增出了184个DNA片段,平均每个引物获得20.4个位点,其中多态性位点184个,占100%。各小果油茶的多态性位点比率分别是:龙胜群体为95.11%、三江群体为92.93%、融水群体为92.39%、黎平群体为94.57%、全州群体为79.89%、通道群体为91.30%。在9对引物组合之中Me8Em11扩增的位点最多,共36个;Me1Em1与Me1Em4扩增位点较少,计11个。这表明SRAP分子标记对小果油茶基因组扩增效果较好,能提供丰富的遗传信息位点,是进行小果油茶遗传多样性与遗传结构分析的有效工具。

表2 SRAP引物名称及序列
2.2 遗传多样性
图1显示了SRAP引物组合Me1Em4对小果油茶实生苗的基因组DNA扩增情况。
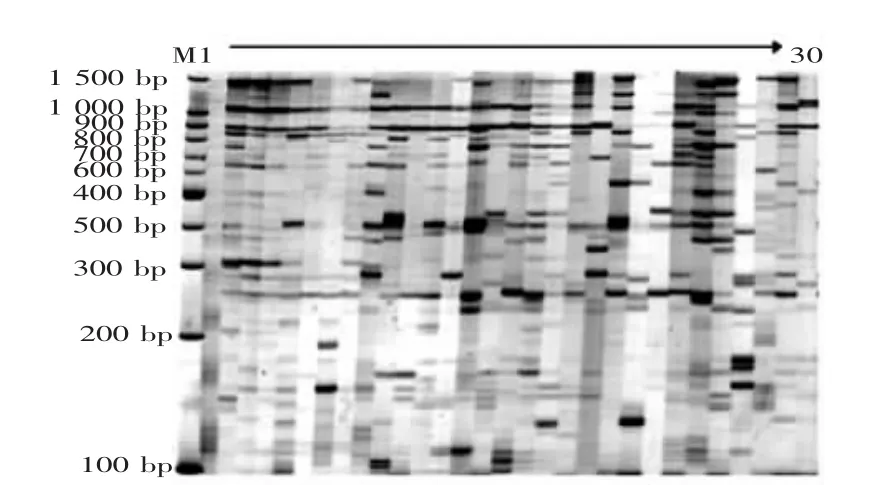
图1 引物组合Me1Em4对小果油茶基因组DNA的扩增图谱
如表3所示,9对SRAP引物共扩增出184个位点,其中多态性位点184个。由表3可知,6个群体内的遗传多样性程度存在较大的差异,180份小果油茶材料的的平均有效等位基因数为1.776 3,平均Nei基因多样性指数0.432 8,平均Shannon信息指数0.623 3。各群体间遗传多样性程度也存在一定差异,Nei基因多样性指数在0.318 7~0.381 4之间,Shannon信息指数在0.467 1~0.557 8之间。
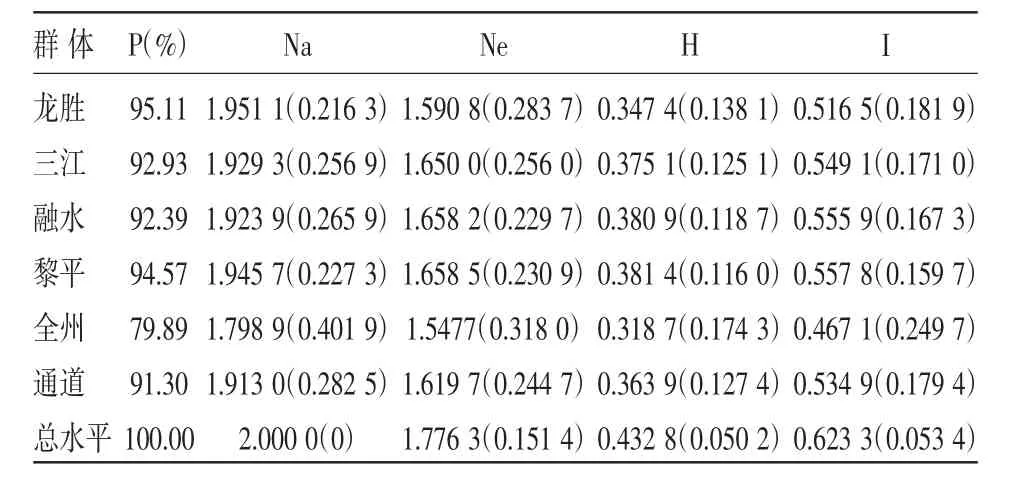
表3 小果油茶群体遗传多样性水平(括号内为标准差)
2.3 遗传分化系数与基因流
小果油茶群体总遗传多样性(Ht)为0.432 8,群体内遗传多样性(Hs)为0.361 2,群体间的遗传多样性(Dst)为0.071 6,群体内的的遗传多样性大于群体间的遗传多样性,表明小果油茶群体的遗传变异主要存在于群体内。小果油茶群体间的遗传分化系数为0.165 4,说明不同种源间遗传分化相对较低。群体物种水平上的基因流(Nm)为2.522 9[18],表明小果油茶不同群体之间有着频繁的基因交流。
2.4 遗传一致度和遗传距离
采用遗传一致度和遗传距离对群体之间相同之处和不同之处加以量化(表4)。小果油茶群体间的遗传相似性较大,I值为0.803 3~0.922 9,D值为0.080 3~0.219 0。其中三江群体与龙胜群体的遗传关系最近(I=0.922 9);全州群体与龙胜群体的遗传关系最远(D=0.219 0),其中全州群体与其他5个群体差异显著。
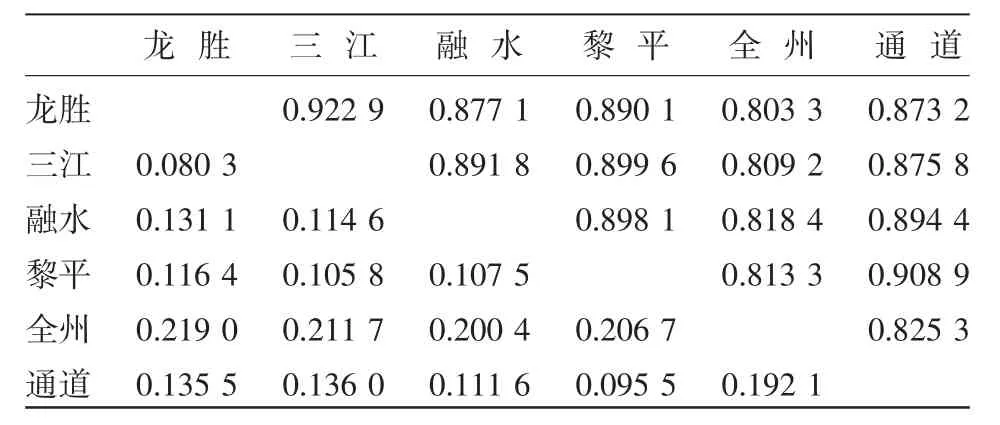
表4 小果油茶6个群体遗传一致度和遗传距离
2.5 聚类分析
根据小果油茶遗传一致度矩阵运用NTSYS2.10进行UPGMA聚类分析,从图2中看出,可以将6个群体归为3个类群:龙胜群体与三江群体聚成一类,黎平群体、通道群体与融水群体聚为一类,全州群体单独聚为一类。
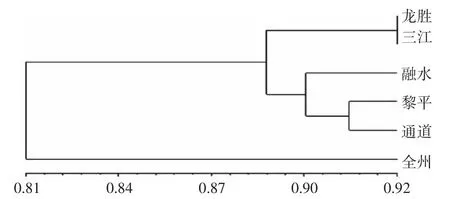
图2 6个小果油茶群体遗传一致度UPGMA聚类
3 讨论
3.1 小果油茶群体间的遗传分化
6个小果油茶群体的总遗传多样性(Ht)为0.432 8,说明在小果油茶全部个体间存在丰富的遗传多样性,个体间遗传变异显著。其中有16.14%的遗传变异存在于群体间,83.86%的遗传变异存在于群体之内,群体间的遗传分化系数(Gst)为0.165 4,明显低于远交物种和多年生物种的平均值(Gst=0.22和Gst=0.19)[19],表明小果油茶天然的遗传变异主要集中在群体内,群体间存在着一定的遗传分化,群体间的遗传变异不显著。
Hamrick等[20]认为基因流Nm大于1,就足以抵制遗传漂变的作用,同时防止了群体分化的发生。本试验小果油茶群体物种水平上的基因流(Nm)为2.522 9,表明群体之间存在着比较频繁的基因交流,有效地阻止了遗传漂变的发生,群体之间的遗传变异不明显。
小果油茶属于典型的虫媒传粉植物,而且历史上广泛分布于长江以南各省,为各群体之间的基因交流提供了有利条件。西南地区小果油茶分布区较为集中,主要分布在东经 108°~111°,北纬 25°~27°之间,各群体间的地理位置较近,有利于群体间的基因交流,导致西南地区的小果油茶群体亲缘关系比较相近。
3.2 小果油茶群体的遗传多样性特点
运用SRAP标记对小果油茶6个群体的遗传多样性进行研究,通过分析各群体的多态位点百分率,Nei基因多样性指数和Shannon信息指数,确定黎平群体和融水群体的遗传变异丰富,遗传变异最低的是全州群体。黎平县一直是小果油茶的主产区,当地种植面积广,本地农家品种丰富,小果油茶群体保护得较好,加之受外部条件影响较小,因此具有较高的遗传丰富度。融水群体是西南地区小果油茶分布纬度较小的群体,当地的小果油茶林实行的是粗放式管理,由于经济欠发达,也没有其他经济树种对小果油茶进行冲击,人为因素影响很小,群体丰富的遗传多样性得以保存。全州县毗邻湖南省,交通较为发达,与外省经济交流也较多。由于油茶效益不高,当地村民将油茶林砍伐代之以其他经济树种,全州地区的小果油茶急剧减少,严重破坏了当地小果油茶基因资源,导致遗传多样性降低。
3.3 小果油茶品种选育与保护策略
自然因素与人为因素造成生境恶劣程度若超过物种对生境适应的极限,就会导致该物种遗传多样性的丧失[21-22]。小果油茶在中国长江以南各省均有分布,大多数茶林距今已有30多年的历史,而且基本上为小果油茶实生苗繁育,群体遗传多样性丰富,对小果油茶的选育提供了良好的条件。但由于环境的变化,各地林业部门缺乏保护,特别是受到其他经济树种的冲击,导致大量小果油茶林被毁,基因资源遭到破坏,遗传多样性降低。
种质资源保存的主要依据是种内遗传多样性,因此了解物种遗传变异的空间分布格局对于制定科学的保护策略具有重要作用。在就地保护时,除了对所有种群进行必要的保护外,应选择遗传多样性程度高的群体进行重点保护。供试的6个群体的Nei基因多样性指数在0.318 7~0.381 4之间,表明总体上小果油茶群体具有丰富的遗传多样性,其中黎平群体与融水群体的遗传多样性最为丰富。在保护小果油茶种质资源时,应扩大收集范围,尽量保证其生态型或地理来源的多样性,这样才能最大限度地保护和利用其遗传多样性。
[1]庄瑞林.中国油茶(第2版)[M].北京:中国林业出版社,2008.
[2]Hassanien H A,Gilbey J.Genetic diversity and differentiation of Niletilap ia (O reochrom is niloticus)revealed by DNA microsatellites[J].Aquaculture Research,2005,36,(14):1450-1457.
[3]England P R,Usher A V,Whelan R J,et al.Microsatellite diversity and genetic structure of fragmented populations of the rare,fire-dependent shrub Grevillea m acleayana[J].Molecular Ecology,2002,11(6):967-977.
[4]Echt C S,Deverno L L,Anzidei M.Chlorop last microsatellites reveal population genetic diversity in red pine,Pinus resinosa Ait[J].Molecular Ecology,1998,7(3):307-316.
[5]Li G,Quiros C F.Sequence-related amplified polymorphism(SRAP),a new marker system based on a simple PCR reaction:It’s application to mapping and gene tagging in Brassica[J].Theoretical and Applied Genetics.2001.103:455-461.
[6]黄永芳,陈锡沐,庄雪影,等.油茶种质资源遗传多样性分析[J].林业科学,2006,42(4):38-43.
[7]闫 锋,崔秀辉,李清泉,等.谷子农艺性状的遗传多样性分析[J].湖南农业科学,2010,(2):8-9,12.
[8]王保明,陈永忠,谭晓风,等.应用ISSR分析油茶无性系的遗传多样性[J].东北林业大学学报,2008,36(6):19-23.
[9]乔小燕,吴华玲,陈 栋,等.广东仁化白毛茶优异株系遗传多样性的 EST-SSR 分析[J].广东农业科学,2010,37(11):57-59.
[10]杨 菁,迟德钊,吴昆仑,等.青海省栽培青稞SSR标记遗传多样性研究[J].安徽农业科学,2010,(8):4307-4309.
[11]戴罗杰,吴子恺,郝小琴,等.利用SSR标记划分微胚乳超高油玉米的杂种优势群[J].江西农业学报,2009,21(9):1-4.
[12]左丹丹,赵海涛,刘 春,等.腊梅天然群体遗传多样性的SRAP 标记分析[J].园艺学报,2009,36(8):1197-1202.
[13]张春雨,陈学森,林 群,等.新疆野苹果群体遗传结构和遗传多样性的 SRAP 分析[J].园艺学报,2009,36(1):7-14.
[14]凌 瑶,张新全,齐晓芳,等.西南五省区及非洲野生狗牙根种质基于SRAP标记的遗传多样性分析 [J].草业学报,2010,19(2):196-203.
[15]鄢家俊,白史且,张新全,等.青藏高原东南缘老芒麦自然居群遗传多样性的SRAP和SSR分析 [J].草业学报,2010,19(4):122-134.
[16]Doyle J J.Doyle J L Isolation of plant DNA from fresh tissue[J].Focus,1990,12:13-15.
[17]郑婷婷,林 萍,王开良,等.油茶SRAP-PCR反应体系的优化[J].林业科学研究,2010,23(2):302-307.
[18]Wirght S.The genetic structure of populations [J].AnnEugen,1951,15:323-350.
[19]Nybom H.Comparison of different nuclear DNA markers for estimating intraspecific genetic diversity in plants[J].Molecular E-cology,2004,13(5):1143-1155.
[20]Hamrick J L,Godt M J W,Sherman B S.Gene flow among plant populations:Evidence from genetic markers[A].Hoch D C,Stephnon A G.Experimental and Molecular App roaches to Plant Biosystematics[C].Missouri Botanical Garden,1995,215-232.
[21]李景秀,管开云,扬鸿森,等.云南紫金牛属植物资源调查研究[J].广西植物,2009,29(2):236-241.
[22]Lande R.Genetics and demography in biological conservation[J].Science,1988,241:1455-1460.

