用超微细胞化学定位技术揭示ATP酶在紫茎泽兰高温适应性中的作用
贺俊英,朱云枝,宋小玲,强 胜南京农业大学杂草研究室,江苏南京0095;内蒙古师范大学生命科学与技术学院,内蒙古呼和浩特000
ATP酶广泛分布于生物有机体内,它同各种膜体系和细胞器有着密切的联系,是质膜的束缚酶,且与植物细胞的能量代谢、物质吸收和运输等过程有关 (Arango et al.,2003;Serrano,1989;Luan,2003);ATP酶也参与几乎所有生命体系的能量转换过程,因而其活性定位被认为是研究细胞功能和生理代谢状态的重要手段(Hall et al.,1982;Zhang et al.,2006)。ATP酶还与植物对温度(高温和低温)、盐、重金属、除草剂、CO2、O3、水分胁迫等逆境的生理反应密切相关,说明ATP酶可能直接参与植物的抗逆反应生理过程(周瑞莲和王海鸥,1999;马新明等,2006;潘秋红等,2007;柯文山等,2007;郭丹等,2007;赵志磊等,2007;李雪梅等,2008;韩建秋,2010)。近年来,有关ATP酶活性和耐热性的研究逐渐受到学者们的关注。一些研究表明,不同植物在高温胁迫下,ATP酶呈现不同的变化规律。如花生Arachis hypogaea L.幼苗ATP酶先升后降(宰学明等,2007);水稻Oryza sativa L.耐热型品种根系质膜ATP酶活性升高,热敏感型品种活性降低(石庆华等,2006);高温诱导豌豆Pisum sativum L.叶片质膜H+-ATP酶升高,并可能在信号传递中起作用(潘秋红等,2007);前期经低温锻炼,在高温胁迫下葡萄Vitis vinifera L.的Ca2+-ATP酶活性明显提高(Zhang et al.,2006),另外,葡萄幼苗经过38℃高温锻炼后,其叶片质膜H+-ATP酶活性明显增强(刘杨等,2009)。但是,通过ATP酶的细胞化学定位技术揭示外来入侵植物对高温生态适应性的研究尚未见报道。
紫茎泽兰 Eupatorium adenophorum(Spreng.)属菊科泽兰属,是一种世界性的恶性杂草,现已分布于我国的云南、四川、广西、贵州和湖北等省(市),造成其广泛危害的重要原因之一就是其具有较强的入侵性,而入侵性与其生态适应性相关。苏秀红等(2005)利用人工模拟法,对采自云南、广西、四川和贵州等省18个地区的紫茎泽兰种群进行抗高温比较,筛选出对高温(40℃)有较强抗性的元江种群和较敏感的大理种群,并进一步通过比较研究揭示了它们抗性生理指标的差异。为了更直观地比较研究种群间在抗热性生理方面的差异,本文采用磷酸铅沉淀的电镜细胞化学方法,以上述2个抗性差异最大的种群为材料,研究经高温胁迫后ATP酶的活性及定位,以揭示高温抗性响应在细胞学上的表现特征,进而为阐明与紫茎泽兰适应性相关的入侵机理积累基础资料。
1 材料与方法
1.1 试验材料
选取对高温有较强抗性的元江种群和较敏感的大理种群,将其种子播于口径为10 cm的盆钵中,并置于培养室萌发(12D∶12L),用保鲜膜保湿,待幼苗高度为1 cm左右时移入一次性口杯(土壤基质为土∶草炭=3∶1)继续生长,待幼苗生长至5~6对真叶时进行高温处理。
1.2 试验设计
分别选取生长健壮、具有6对真叶且长势相同的抗性、敏感种群幼苗置于X-Z智能人工气候箱中进行高温处理,温度为40℃,处理时间为0、6、12、24 h,湿度保持在80%。处理后分别取样,取样部位为从顶端开始的第2对叶片。每个处理设3个重复,每个重复10株。以在培养室自然生长状态下(温度25℃、湿度80%)的幼苗为对照。
1.3 ATP酶定位试验方法
试验主要参照苏金为和王湘平(2002)及田国伟和申家恒(1996)的方法。将所选叶片中部、叶脉两侧对称部位,用双面刀片切成1.5 mm×3.0 mm左右的长方形小块,其长边与叶脉的方向平行。立即投入用50 mmol·L-1二甲砷酸钠缓冲液(pH 7.2)配制的2.5%戊二醛和4%多聚甲醛混合液中于4℃下固定2 h。固定完成后,先用二甲砷酸钠缓冲液冲洗2次,每次1 h,再用50 mmol·L-1Tris-顺丁烯二酸缓冲液(pH 7.2)冲洗 2次,每次30 min。然后将材料转移到修改的Wachstein-Meisel酶反应液[50 mmol·L-1Tris-顺丁烯二酸缓冲液(pH 7.2)中含 5'-ATP 2 mmol·L-1、硝酸铅 3 mmol·L-1、MgSO45 mmol·L-1]中,在 22 ℃ 恒温条件下孵育2 h。为了防止假阳性,每个处理均设对照:(1)反应液中不加5'-ATP;(2)反应液中加入10 mmol·L-1NaF抑制剂。酶反应结束后,先用二甲砷酸钠缓冲液清洗3次,每次15 min;再用该缓冲液配制的2%锇酸固定液于4℃下固定过夜;然后用重蒸水清洗3次,每次1 h。再经丙酮系列脱水,Epon 812包埋;LKB型超薄切片机切片,厚度500 nm;不经染色直接在H-800型电子显微镜下观察并拍照。
2 结果与分析
2.1 ATP酶定位原理
ATP酶若分布在细胞中,遇到其底物和铅即可产生磷酸铅沉淀(正反应),呈电子密度致密的点状或线状。本试验观察发现,所有不加酶底物和加入酶抑制剂的对照反应中均未产生磷酸铅的电子致密点(图1A、B),而正反应中都有不同程度的磷酸铅电子致密点分布,说明电子致密点是ATP酶的真实反应。
2.2 抗性、敏感种群ATP酶细胞化学定位的差异
抗性、敏感种群未经过40℃高温处理的对照样叶片中均有ATP酶的活性分布,主要定位于细胞壁,且二者之间的分布量没有明显的差异(图1C、D)。叶绿体的结构清晰完整。
经过高温处理6 h时,抗性、敏感种群ATP酶在细胞壁上的分布量均比对照稍多(图1E、F),但二者差异仍不太明显,只是抗性种群的细胞膜上出现零星的分布(图1E)。2个种群叶绿体的超微结构也均正常。
经过高温处理12 h时,抗性种群ATP酶反应强烈,在细胞壁上的分布大大增多,呈致密的线条状,同时在细胞膜上也有大量分布(图1G),叶绿体的超微结构仍完整;此时敏感种群ATP酶反应则很微弱,只在细胞壁上有少量的定位分布,比其对照和处理6 h时均减少(图1H),叶绿体基粒片层和基质片层模糊化。
经过高温处理24 h时,抗性种群细胞膜上仍有ATP酶的活性定位点(图1I),细胞膜及叶绿体的基粒片层开始出现模糊的迹象(图1J);但此时的敏感种群第2对叶片已萎蔫,故无法观察超微结构的定位。
3 结论与讨论
3.1 紫茎泽兰种群间ATP酶活性差异与高温适应能力关系的探讨
在40℃高温处理下,抗性差异最大的2个紫茎泽兰种群叶片ATP酶活性反应水平在起始状态下一致;随着处理时间的延长,抗性种群ATP酶的活性明显加强,尤其在12 h时反应最强烈,敏感种群则无明显加强,12 h时酶活性反应已十分微弱。这一现象与石庆华等(2006)对水稻的研究结果基本一致。有关植物中ATP酶活性发生变化的相关原理已有报道,认为该酶与植物体内的物质离子吸收与运转有关。如苏金为和王湘平(2001)通过对茉莉Jasminum sambac(L.)幼苗的研究发现,ATP酶的活性与物质运输密切相关;王秀玲和高新起(2002)通过比较荞麦Fagopyrum esculentum Moench.柱头、花柱不同发育时期ATP酶的活性认为,高的ATP酶活性表明物质代谢和细胞间的物质转移活跃;田国伟和申家恒(1996)对小麦Triticum aestivum L.珠心细胞衰退过程中ATP酶的研究同样得出,高的ATP酶活性表明细胞正进行旺盛的主动物质吸收。Serrano(1989)也认为,ATP酶活性与植物体的物质主动吸收及运输成一定的正相关。本研究中,抗性种群随高温处理时间的延长ATP酶活性加强,这可能会在一定程度上促进其体内的物质代谢和运输,使其能对高温表现出较强的忍耐性;而敏感种群ATP酶活性逐渐减弱,植株较早萎蔫,从而表现出对高温的弱适应性。此外,ATP酶在高温胁迫下还可能参与了抗逆信号传递的过程,抗性种群比敏感种群更活跃地传递逆境信号,以便抵抗逆境的反应(潘秋红等,2007)。
3.2 紫茎泽兰种群间ATP酶定位点不同与高温适应性差异的探讨
经高温胁迫后,紫茎泽兰抗性、敏感种群叶片的ATP酶活性表现不同、酶超微结构的定位点也有明显差异。敏感种群ATP酶只定位于细胞壁,细胞膜较早出现伤害;抗性种群则除细胞壁外,细胞膜上也分布了大量的ATP酶活性定位点,在处理24 h时仍保持一定的活性。
一些学者研究发现,ATP酶主要分布在与物质离子的吸收与运转有关的组织细胞中,且其活性沉淀物大多沿着细胞壁和细胞膜的位置分布定位(Arango et al.,2003;王秀玲和高新起,2002)。细胞膜ATP酶被认为在物质的吸收与运输中起着质子泵的作用,它的活动形成离子跨膜运输的原动力(Gunther & Scherer,1984;Kasamo,2003;Serrano,1989;苏金为和王湘平,2002)。本试验中紫茎泽兰抗性种群经高温处理后,ATP酶的定位点在细胞膜上不断增加,12 h时最强烈,24 h时仍有分布,这可能会在一定程度上积极调动细胞膜与运输有关的组织细胞来担负物质的正常运输任务;而敏感种群ATP酶定位点少,植株也较早受害,表现出对高温的弱适应性。
以上ATP酶的细胞化学定位研究反映了种群间适应性的差异与ATP酶有一定的关系。
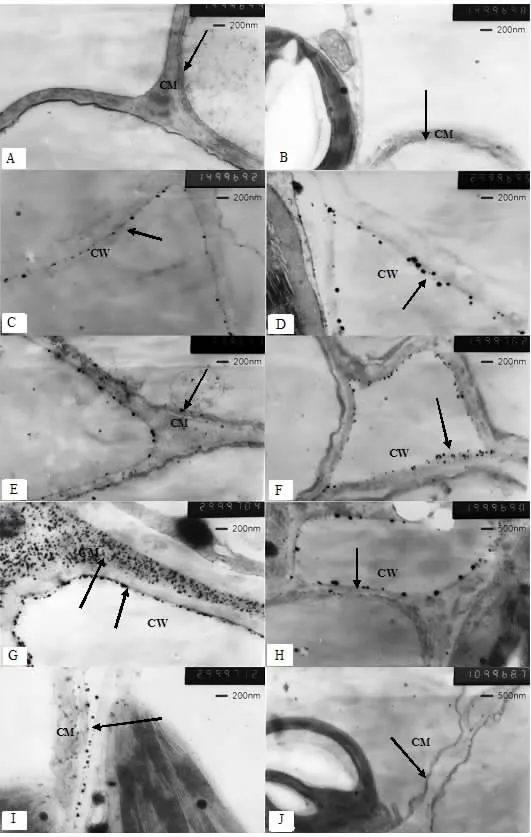
图1 40℃高温处理后紫茎泽兰叶片的ATP酶定位Fig.1 ATPase distribution of E.adenophorum leaves after 40 ℃ high temperature
郭丹,赵天宏,张兆伟,王美玉,付士磊,何兴元.2007.CO2和O3体积分数升高对银杏希尔反应活力和叶绿体 ATP酶活性的影响.生态环境,16(5):1406-1410.
韩建秋.2010.渗透胁迫对白三叶幼苗根系离子分泌和质膜ATP酶活性的影响.中国农学通报,26(9):202-205.
柯文山,熊治廷,柯世省,金则新.2007.两个海州香薷种群根对Cu的吸收及Cu诱导的ATP酶活性差异.环境科学学报,27(7):1214 -1221.
李雪梅,张维佳,王艳,王振英,彭永康.2008.PSⅡ抑制型除草剂Atrazine诱导白菜幼苗叶绿体蛋白质组的变化.作物学报,34(2):238-242.
刘杨,康喜亮,杨丽娟,白志川.2009.水杨酸与高温锻炼对高温胁迫下葡萄叶肉细胞质膜 ATPase活性的影响.北方园艺,(3):26-29.
马新明,李春明,刘海涛,史丽芳.2006.Cd Pb污染对烤烟ATP酶活性及烟叶品质的影响.农业环境科学学报,26(2):708-712.
潘秋红,郑艳军,刘艳艳,张艳芳,黄卫东.2007.在耐热性诱导中豌豆叶片过氧化氢和水杨酸含量与质膜酶活性的变化及相互关系.植物生理与分子生物学学报,33(5):425-434.
石庆华,李木英,许锦彪,谭雪明.2006.高温胁迫对早稻根系质膜ATPase活性及NH4+吸收的影响.作物学报,32(7):1044-1048.
苏金为,王湘平.2001.茉莉幼苗ATP酶活性的超微细胞化学定位与耐冷性研究.园艺学报,28(6):544-550.
苏金为,王湘平.2002.大豆种子萌发过程中子叶细胞超微结构和ATP酶活性动态研究.电子显微学报,21(2):114-117.
苏秀红,强胜,宋小玲.2005.不同地理种群紫茎泽兰耐热性差异的比较分析.西北植物学报,25(9):1766-1771.
田国伟,申家恒.1996.小麦珠心细胞衰退过程中ATP酶的超微细胞化学定位.植物学报,38(2):100-104.
王秀玲,高新起.2002.荞麦柱头、花柱的结构及ATP酶的超微细胞化学定位.西北植物学报,22(5):1221-1224.
宰学明,钦佩,吴国荣,王光,闫道良.2007.高温胁迫对花生幼苗光合速率、叶绿素含量、叶绿体 Ca2+-ATPase、Mg2+-ATPase及Ca2+分布的影响.植物研究,27(4):416-420.
赵志磊,顾玉红,赵玉梅,姜微波,侯名语.2007.冷激处理对芒果贮藏冷害及相关酶的影响.河北农业大学学报,30(4):27-30.
周瑞莲,王海鸥.1999.应用生物化学技术进行牧草抗逆性鉴定的原理和方法.中国沙漠,(19):16-20.
Arango M,Gévaudant F and Oufattole M.2003.The plasma membrane proton pump ATPase:the significance of gene subfamilies.Planta,216:355 -365.
Gunther F E and Scherer M.1984.Subcellular location of H+-ATPase from pumpkin hypocotyls(Cucurbita maxima L.)by membrane fractionation.Planta,160:348 -356.
Hall J,Kinney A and Dymott J.1982.Location and properties of ATPase activity in pea stems and wheat coleoptiles.Journal of Molecular Histology,14:323 -331.
Kasamo K.2003.Regulation of plasma membrane H+-ATPase activity by the membrane environment.Journal of Plant Research,116:517 -523.
Luan S.2003.Protein phosphatases in plants.Annual Review of Plant Biology,54:63 -92.
Serrano R.1989.Structure and function of plasma membrane ATPase.Annual Review of Plant Physiology and Plant Molecular Biology,40:61 -94.
Zhang J H,Liu Y P,Pan Q H,Zhan J C,Wang X Q and Huang W D.2006.Changes in membrane-associated H+-ATPase activities and amounts in young grape plant during the cross adaption to temperature stresses.Plant Science,170:768-777.
- 生物安全学报的其它文章
- 广谱抗真菌转基因水稻植株化学成分与结构动态变化

