电解锰阳极泥的除杂活化及应用
陶长元,李东海,刘作华,邹开云
(1.重庆大学化学化工学院,重庆 400044;2.重庆电池总厂,重庆 401120)
电解锰阳极泥是在电解金属锰生产时,产生于阳极区的黑褐色副产物,成分复杂,含有 Mn、Fe、Pb、Ni、Cu、Ag、Ca和Mg等元素,烘干后MnO2含量一般为42%~59%;由于活性低,除少量用于电解锰厂的锰矿浸取液除铁外,绝大部分作为工业固体废物被堆存处置或廉价销售,造成资源浪费和环境污染,而且每生产 1 t电解金属锰,就产生 50~150 kg电解锰阳极泥[1]。近年来,人们已对电解锰阳极泥的利用开展了一系列探索性研究,但仍存在转化率和回收率低、能耗高、工艺路线长、成本高、难以形成规模效益等问题。锌锰电池正极材料一般采用天然MnO2,但随着高品位软锰矿资源的日益枯竭,寻找适宜的替代材料已成为必然需求[2]。
考虑工艺成本和环保等因素,在系统分析电解锰阳极泥物理化学性质的基础上,本文作者采用湿法工艺[3]对电解锰阳极泥中的MnO2进行除杂活化处理,并用作锌锰干电池的正极材料。
1 实验
1.1 实验方法
电解锰阳极泥中的主要杂质为 Fe2O3、MnO、Mn2O3和CaSO4等,还有Ni、Cu等金属的氧化物,除杂的主要反应为:
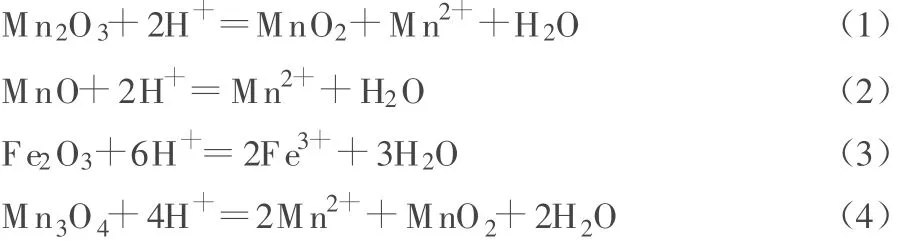
1.1.1 电解锰阳极泥的除杂活化处理
将电解锰阳极泥(重庆某电解锰厂提供)在XQM-2L型变频行星式球磨机(南京产)上以230 r/min的转速球磨(球料比 1∶1)40 min,制成直径为74 μ m的颗粒;再在H2SO4(重庆产,98%)或HCl(重庆产,36.5%)的稀溶液中加入少量NaCl(重庆产,AR),按液固比 3∶1~7∶1用上述稀酸在水浴加热的条件下浸取,进行除杂活化;酸浸取后,用NaOH(重庆产,AR)溶液中和多余的H+,按100 g电解锰阳极泥使用0.01 g的比例,添加十二烷基苯磺酸钠(重庆产,AR);碱洗后抽滤,并用稀HCl调整溶液的pH值为 5~7,再在 105℃下烘干10 h,过200目筛,备用。
1.1.2 含量测定
电解锰阳极泥中Fe、Cu、Ni、Pb、Co和Ag的含量用 180-80型原子吸收光谱仪(日本产)根据原子吸收光谱法[4]测定;Ca、Mg含量用 EDTA滴定法[5]测定;Mn含量由硫酸亚铁铵滴定法[6]测定;MnO2含量用草酸钠滴定法测定[7]。
1.1.3 电池的制作及放电性能测试
将制得的MnO2按照重庆电池总厂的工艺制成R20电池,再用R20型IDS恒阻电池智能放电检测系统(苏州产)按GB/T 8897.2-2008《原电池第2部分:外形尺寸和电性能要求》[8]测试放电性能。
1.2 SEM分析和XRD分析
用VEGAⅡLMU型扫描电子显微镜(捷克产)观察电解锰阳极泥的形貌;用6000型X射线衍射仪(日本产)分析电解锰阳极泥的物相,CuKα,波长0.154 06 nm,管压 40 kV、管流 30 mA,扫描速度为 6(°)/min,步宽为0.02°。
2 结果与讨论
2.1 处理前电解锰阳极泥的主要成分
电解锰阳极泥烘干后失水率为16.1%,主要成分见表1。
从表1可知,处理前电解锰阳极泥的杂质较多,MnO2含量较低。严格地说,制得的MnO2应记为MnOx,是非化学计量的化合物,属于隧道、层状或网状的晶体结构[9]。从主要成分计算可知,x=1.757,说明M nO2的晶体缺陷较大,有大量杂质在MnO2结构中,因此活性不高。

表1 处理前电解锰阳极泥的主要成分Table 1 Main content of electrolytic manganese anode slime before treatment
2.2 酸浸取条件对电解锰阳极泥中MnO2含量的影响
酸浸取条件对电解锰阳极泥中MnO2含量的影响见图1。
在液固比为5∶1、反应温度为50℃、H2SO4和 HCl浓度分别为1 mol/L和2 mol/L的条件下,进行不同时间的除杂活化实验。从图1a可知:适宜的反应时间为2 h。从动力学分析,浸取时间延长,杂质的浸出率会增加,但是一定程度后,这种趋势会变得很小。HCl除杂效果不如H2SO4的原因,可能是发生了式(5)所示的反应,导致式(1)所示反应生成的MnO2减少,因此处理后的电解锰阳极泥中MnO2含量降低。HCl易挥发,也是浸取效果不理想的一个原因。

在液固比为 5∶1、反应温度为50℃、酸浸取时间为 2 h的条件下,进行不同酸浓度的除杂活化实验。从图1b可知:浸取时选择1 mol/L H2SO4较好。当酸浓度较低时,H+的扩散速率较小;当酸浓度较高时,扩散阻力降低,H+容易进入MnO2的孔状结构,促进杂质离子浸出。HNO3具有强腐蚀性,对设备的要求很高,还会产生NOx污染,不宜使用。
在H2SO4浓度为1 mol/L、反应温度为50℃、酸浸取时间为2 h的条件下,进行不同液固比的除杂活化实验。从图1c可知:适宜的液固比为 5∶1。液固比低,溶液黏度大,浸出液易饱和,对传质过程不利;液固比高,浸出效率降低,不仅增加资源消耗,而且废水处理困难。

图1 酸浸取条件对MnO2含量的影响 Fig.1 Influence of acid leaching conditions on manganese dioxide content
在H2SO4浓度为 1 mol/L、液固比为5∶1、酸浸取时间为2 h的条件下,进行不同温度下有无NaCl[w(NaCl)=5%]的除杂活化实验。从图1d可知:反应温度为50℃较好,NaCl可增加CaSO4的溶解度,促进硫酸银等难溶物形成可溶性络合物,更好地浸出,增加电解锰阳极泥中MnO2的含量。
在液固比为5∶1、反应温度为50℃、酸浸取时间为2 h、w(NaCl)=5%的条件下,进行不同H2SO4浓度的除杂活化实验。从图1e可知:有NaCl存在时,H2SO4浓度仍以1 mol/L较合适。H2SO4浓度过高,会导致电解锰阳极泥中MnO2大幅减少,原因是H2SO4浓度较高时,发生了式(6)所示的反应,导致SO42-浓度升高,大量吸附在MnO2表面并进入孔状结构中,降低电解锰阳极泥中MnO2的含量。
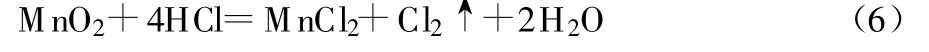
2.3 碱洗中和
表面羟基对MnO2电化学性能的影响较大[10]。电解锰阳极泥经酸洗后,溶液的pH值约为2.82,小于酸性锌锰干电池电解液的pH值(约5.0),破坏了MnO2表面酸性羟基与碱性羟基的平衡,导致放电时电压迅速下降,放电容量降低,因此必须加碱,中和吸附在MnO2表面的大量H+。碱浓度太高,会破坏MnO2表面两性羟基的平衡;只进行碱洗无法很好地除去漂浮的油状物,因此在碱洗时加入少量十二烷基苯磺酸钠。实验结果表明:除油效果良好,并改善了MnO2的孔状结构。碱洗后抽滤,控制滤液的pH值为5~7。
综上所述,最适宜的反应条件为:①酸浸取除杂时,H2SO4浓度1 mol/L,液固比5∶1,反应温度50℃,反应时间2 h,w(NaCl)=5%;②碱洗中和时,NaOH浓度0.25 mol/L,液固比4∶1,反应温度50℃,反应时间 1 h,添加少量十二烷基苯磺酸钠。以下处理条件均为最适宜反应条件。
2.4 XRD分析
电解锰阳极泥的XRD图见图2。

图2 处理前后电解锰阳极泥的XRD图Fig.2 XRD patterns of electrolytic manganese anode slime before and after treatment
对比标准图谱(JCPDS 44-0141)可知,图 2中12.5°、17.9°、28.7°、37.4°、41.8°、49.6°及 59.9°附近的特征峰是α-MnO2的特征峰。处理后,虽然杂质峰减少,晶形不变,但MnO2的晶体结构得到改善。α-MnO2主要是 T[2×2]隧道结构,截面面积在α、β和γ型MnO2中最大[11],具有较大的离子扩散通道,若隧道结构中不含大的杂阳离子,则放电性能良好[12]。处理后,M nO2的晶胞参数为a=0.978 5 nm、b=0.978 5 nm、c=0.286 3 nm,与文献[13]中α-MnO2类的碱硬锰矿的晶胞参数(a=0.980 nm、b=0.980 nm、c=0.286 nm)几乎一致,近似化学式为(Ba,K,Pb)2-x(Mn,Fe,Al)8O16。夏熙等[14]发现:掺入 1.25%~5.00%的铅会影响MnO2的放电机理,抑制电化学惰性物质Mn3O4的积累,改善MnO2的电化学性能。这可能是本工艺所得含铅MnO2具有较好放电性能的原因之一。
2.5 处理后电解锰阳极泥的主要成分
将最适宜条件下处理后得到的电解锰阳极泥烘干,分析主要成分,结果见表2。

表2 处理后电解锰阳极泥的主要成分Table 2 Main content of electrolytic manganese anode slime after treatment
对比表1、表2可知:处理后MnO2含量提高,金属杂质减少,MnOx的x增至1.999,说明晶体缺陷减少。由Nernst方程可知,x越大,半电池中MnO2的电势越高,有利于放电。
处理后电解锰阳极泥在铵型电解液中的金属浸出率见表3。

表3 处理后电解锰阳极泥在电解液中的金属浸出率Table 3 Metal leaching rate of electrolytic manganese anode slime after treatment in electrolyte
从表3可知:处理后的电解锰阳极泥中,可溶性杂质金属能够满足锌锰干电池的应用要求。
2.6 电化学性能测试
将处理前后的电解锰阳极泥制成R20电池,并进行放电性能测试,结果见表4。
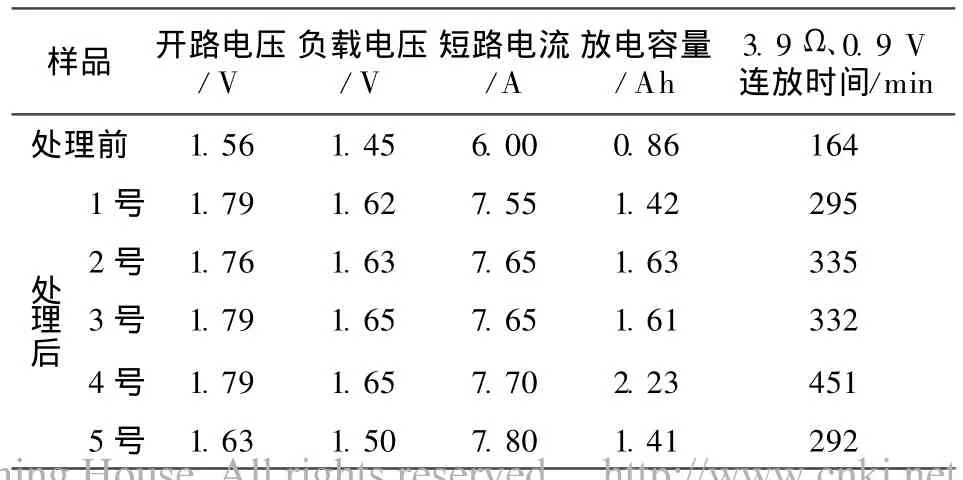
表4 处理前后电解锰阳极泥制成的R20电池的放电性能Table 4 Discharge performance of R20 battery produced by electrolytic manganese anode slime before and after treatment
从表4可知:处理后的5个平行样品,电解锰阳极泥中的MnO2得到活化,加上视密度增加,吸液能力提高,最终降低了电池的极化,因此制成的电池具有良好的放电性能。平行样品中,某些样品的放电性能差异较大,表明电解锰阳极泥是一种复杂的物质。
2.7 SEM分析
处理前后电解锰阳极泥的SEM图见图3。

图3 处理前后电解锰阳极泥的SEM图Fig.3 SEM photographs of electrolytic manganese anode slime before and after treatment
从图3可知,处理前,电解锰阳极泥存在严重的板结现象;处理后,板结现象减少,颗粒变得细小、均匀,孔隙率也有所增加,可以减小放电时的界面阻力和浓差极化,改善放电性能。
2.8 滤液的分析及回收处理
在液固比5∶1、w(NaCl)=5%、反应温度 50℃、反应时间2 h的条件下,考察H2SO4浓度对滤液的影响,结果见图4。
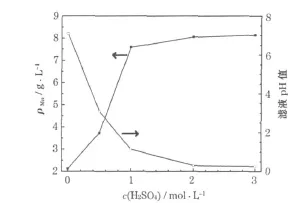
图4 H2SO4浓度对滤液中总锰浓度的影响Fig.4 Influence of sulfuric acid concentration on total manganese concentration in filtrate
从图4可知,H2SO4浓度取1 mol/L为宜。达到1 mol/L后,如果继续增大H2SO4浓度,不仅对锰的浸出率影响不大,还会造成MnO2表面吸附大量H+和SO42-,对提高MnO2的性能不利。
所有滤液混合的废液,pH值为1.38,ρMn2+=5.56 g/L,调节废液的pH值至10.32,使Mg2+、Fe3+等金属离子沉淀,添加MnCO3(溶液中的初始浓度为0.021 g/L)使Ca2+彻底沉淀。反应后,溶液的 pH值为 10.38,ρMn2+=0.29 mg/L,Ca2+、Mg2+、Fe3+、Pb2+和 Ag+未检出。处理后的液体可用于工艺的碱洗环节。
3 结论
电解锰阳极泥经本工艺处理后,得到质量分数为87%~93%的活化MnO2,虽然晶型仍为α-MnO2,但晶体结构和表面特性得到改善,适合用作锌锰干电池的正极材料。
用处理后所得 MnO2制成的 R20电池,3.9 Ω、0.9 V连放时间超过290 min。
处理后,仍有一些金属杂质存在于所得MnO2的晶格中,可通过加压氧化浸取来调控MnO2的晶型结构,以制备更高活性的MnO2。
致谢:本文得到重庆电池总厂杨林总工程师的大力支持,特此致谢。
[1]LIU Jian-ben(刘建本),CHEN Shang(陈上).用电解锰阳极泥和含SO2工业尾气制备硫酸锰[J].Environmental Protection of Chemistry Industry(化工环保),2009,29(6):538-540.
[2]YANG Lin(杨林),LAI Yong(赖勇),ZHENG Wen-xiang(郑文祥),et al.锌锰电池产业的现状与未来[J].Dianchi Gongye(电池工业),2009,14(6):413-415.
[3]TAO Chang-yuan(陶长元),DU Jun(杜军),LIU Zuo-hua(刘作华),et al.一种用电解锰阳极泥制备电池原料的方法及其制品[P].CN:200910251043.6,2010-06-02.
[4]QB 2106-1995,电池用电解二氧化锰[S].
[5]GB/T 1511-2006,锰矿石钙和镁含量的测定EDTA滴定法[S].
[6]GB/T 1506-2002,锰矿石锰含量的测定电位滴定法和硫酸亚铁铵滴定法[S].
[7]LIN Xiang-wei(林乡伟).某含锰废料在电池原料方面应用的研究[D].Nanning(南宁):Guangxi University(广西大学),2008.
[8]GB/T 8897.2-2008,原电池第2部分:外形尺寸和电性能要求[S].
[9]Zhang J,Duan Y P,Jing H.The morphology and electromagnetic properties of M nO2obtained in 8T high magnetic field[J].J Cryst Growth,2010,312(19):2 788-2 794.
[10]Malloy A P,Browning G J,Donne S W.Surface characterization of heat-treated electrolytic manganese dioxide[J].J Colloid Interface Sci,2005,285(2):653-664.
[11]Ma R,Bando Y,Zhang L,et al.Layered M nO2nanobelts:hydrothermal synthesis and electrochemical measurements[J].Adv Mater,2004,16(11):918-922.
[12]Devaraj S,Munichandraiah N.Effect of crystallographic structure of MnO2on its electrochemical capacitance properties[J].J Phys Chem C,2008,112(11):4 409-4 416.
[13]XIA Xi(夏熙).二氧化锰及相关锰氧化物的晶体结构、制备及放电性能(Ⅰ)[J].Battery Bimonthly(电池),2004,34(6):412-414.
[14]XIA Xi(夏熙),GONG Liang-yu(龚良玉).PbO2纳米粉体的固相合成及其对M nO2电极材料的改性作用[J].Acta Chimica Sinica(化学学报),2002,60(1):87-92.

