西泉眼水库水源地10月大型底栖动物群落特征及其与环境因子的关系1)
李佳娟 于洪贤 刘曼红 费 滕
(东北林业大学,哈尔滨,150040)
大型底栖动物具有生命周期长、区域性强、迁移力弱、分布广泛、较易辨认等特点,在水生态系统物质循环和能量流动中发挥着不可替代的作用[1]。它不仅能够反映当地综合生态条件,而且能对生态环境的恶化和改善做出迅速响应,同时,采样比较容易,成本低[2]。此外,大型底栖动物的群落结构、优势种类、现存量等参数还可以反映环境因子的长期变化情况[1],对此,国内外已有较多的研究[3-9]。研究大型底栖动物群落结构及其与环境因子之间的关系可为渔业的发展、水体污染评价与治理、水域环境保护等提供基础资料和科学依据。
西泉眼水库是哈尔滨市重要的水源地,位于松花江右岸一级支流阿什河上游的尚志、五常、阿城3市交界处,距哈尔滨市区93 km。水库始建于1992年,1996年竣工蓄水,总容量4.78亿m3,是黑龙江省最大的水库之一,预计2013年向哈尔滨市区供水。水质的好坏直接关系到哈尔滨市近千万居民的饮水安全,因而加强水质监测就显得尤为必要。自水库建成以来,生态环境的改变、农药化肥的大量使用、旅游业的繁荣已使水库水质受到很大影响。近年来,对西泉眼水库水质评价及富营养化状况的研究报道较多[10-11],而对大型底栖动物与环境因子的关系研究却未见报道。本研究以西泉眼水库秋季大型底栖动物为对象,分析库内大型底栖动物的群落结构及其与环境因子的关系,为水库的保护与治理提供生物学依据。
1 研究方法
1.1 采样点布设
根据地表水监测的相关要求,结合西泉眼水库的实际情况,本研究于2010年10月分别在阿什河入口、黄泥河入口、水库中心、双龟山、大坝出水口、阿什河上游等地设置采样点13个,如图1所示。
1.2 采样方法
根据国家环境保护总局关于“水环境(生物部分)监测规范”[12]的要求,2010年10月对西泉眼水库各采样点进行大型底栖动物采样,样品用1/16 m2彼得逊采泥器采集,经4%甲醛溶液固定后带回实验室,用40目尼龙筛洗净后置于白瓷盘中将大型底栖动物挑出,用75%乙醇保存,进行种类鉴定、计算和称质量。相关化学指标参照国家环境保护总局颁布的《水和废水监测方法》[13]进行测定,各采样点用GPS全球定位系统进行现场定位。
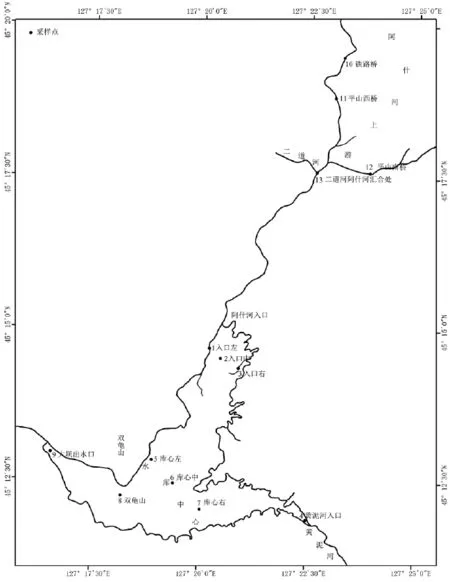
图1 西泉眼水库采样点示意图
1.3 数据处理
大型底栖动物群落划分采用Bray-Curtis相似性系数聚类分析和多维尺度(MDS)分析[14-16],在 SPSS16.0 软件上运行;利用典范对应分析(canonical corrspondence analysis,CCA)对大型底栖动物与环境因子的相互关系进行研究,在CANOCO4.5软件上运行、作图。
物种多样性及生物指数采用物种优势度指数(y)[17]、Margalef种类丰富度指数(d)[18]、Shannon - Wiener多样性指数(H)[19]、Pielou 均匀度指数(J)[20]和 Goodnight- Whitley 生物指数(GI)[21]进行数据处理和结果分析。各指数计算式分别为:

式中:N为所有种的个体总数;ni为第i种的个体数;fi为该种在各样品中出现的频率,当y>0.02时,该种即为优势种;S为总种数;n'i为寡毛类的个体数或密度。
2 结果与分析
2.1 大型底栖动物的种类组成和优势度
本研究共采集到大型底栖动物50种(表1),隶属3门4纲10目18科。其中:节肢动物41种,占总数的82%;环节动物7种,占14%;软体动物2种,占4%。从表1可以看出:西泉眼水库大型底栖动物群落主要由摇蚊幼虫和其他水生昆虫组成,而软体动物的种类和密度均很少,这是由于软体动物分布稀疏且采样面积小所致。群落中优势种为纹石蛾(Hydropsyche sp.)1种、划蝽(Arctocorisa sp.)1种、中华摇蚊(Chironomus sinicus)、霍甫水丝蚓(Limnodrilus hoffmeisteri)。
2.2 大型底栖动物的生物量和密度
各类大型底栖动物的生物量及各物种栖息密度如表1所示。节肢动物的生物量居明显优势,占总量的79.86%;环节动物次之,占19.58%;软体动物最小,占0.56%。大型底栖动物部分种类总平均密度的标准差都较平均值大很多,如纹石蛾(Hydropsyche sp.)1种总平均密度标准差(1 103 ind·m-2)为平均密度(363 ind·m-2)的3倍,说明大型底栖动物在各采样点的密度差异较大,即大型底栖动物在研究区的分布具有显著的空间差异性。由表2所示,各采样点的生物量和密度变化明显,大型底栖动物的高生物量和高密度区主要分布在10#~13#采样点(阿什河上游),更说明了物种分布不均。从采样情况分析,由于水库各水域生态环境的差异,大型底栖动物多分布于入库河流的浅水库湾,泥沙、砾石底质处,而库内淤泥底质处的物种种类和密度却相对较少。
2.3 西泉眼水库大型底栖动物群落特征
2.3.1 大型底栖动物的群落结构
群落划分采用Bray-Curtis相似性系数聚类和多维尺度(MDS)分析。从图2和图3可以看出,相似性系数聚类图和MDS图所得结果基本一致。13个采样点的大型底栖动物群落划分成4个不同的区域:区域Ⅰ包括阿什河入口、黄泥河入口、水库中心以及双龟山,也就是水库的主体部分;区域Ⅱ主要分布在平山西桥、南桥、二道河与阿什河汇合处;区域Ⅲ和区域Ⅳ分别分布在铁路桥和大坝出水口处。经MDS图分析得出的Stress值为0.001 3,具有良好的代表性[16],这说明该数据利用MDS图能够很好地解释西泉眼水库各采样点大型底栖动物群落的相似性关系,同时也能清楚显示各采样点大型底栖动物群落组成存在的差异。
2.3.2 大型底栖动物的生物多样性
各采样点的生物指数和物种多样性指数以及区域Ⅰ、Ⅱ、Ⅲ的Margalef种类丰富度指数(d)、Shannon-Wiener多样性指数(H)、Pielou均匀度指数(J)、Goodnight-Whitley生物指数(GI)的均值见表3。

表1 西泉眼水库大型底栖动物的现存量和优势度

表2 大型底栖动物各采样点密度与生物量
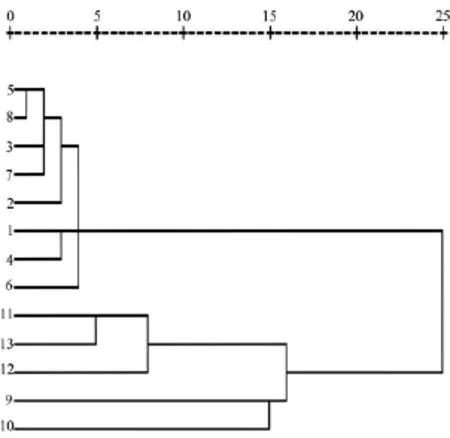
图2 西泉眼水库大型底栖动物聚类分析图

图3 西泉眼水库大型底栖动物多维尺度分析图
从多样性指数的均值可以看出,大型底栖动物群落生物多样性:区域Ⅱ>区域Ⅰ>区域Ⅲ。结合Bray-Curtis相似性系数聚类和多维排序尺度(MDS)群落结构分析以及底栖动物生物指数和多样性指数的评价标准[18-21],参照文献[22]及文献[23]确定的分类单元耐污值,对西泉眼水库3个区域的水质进行综合评价。在阿什河上游(区域Ⅱ),水环境受人类影响强度较弱,因此其生物多样性指数和种类丰富度指数均最大,属清洁水体;库内(区域Ⅰ)和铁路桥处(区域Ⅲ)由于捕鱼和漂流现象频繁,水环境受人类影响较大,因此水质相对较差,均属轻度污染水体;区域Ⅳ由于修建大坝,对水环境和底质都造成了很大的影响,没有采集到大型底栖动物,因而无法对其水质进行评价。迟晋峰等[24]对水库水环境质量进行了化学指标分析,认为现状水质不能满足GB3838—2002中Ⅱ类水质要求,这与本文研究有所差异,因其通过多项监测项目进行评价,而本文仅考虑环境因素,但总体上反映出西泉眼水库水环境较好。
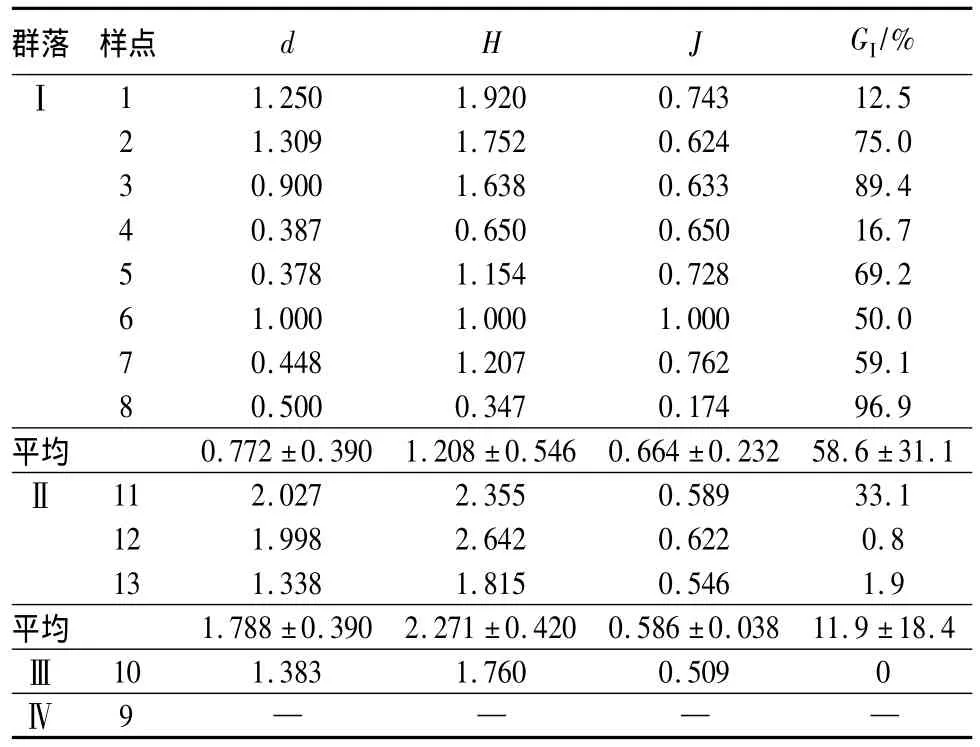
表3 大型底栖动物群落多样性指数
2.4 大型底栖动物与环境因子的关系
不同种类大型底栖动物对周围环境的适应性以及耐污力和敏感度皆存在差异[6]。根据Bray-Curtis相似性系数聚类和多维排序尺度(MDS)群落划分、入库河流及各断面对研究区具有代表性的 2#、4#、6#、8#、9#、10#、11#、12#、13#9 个采样点的大型底栖动物与水深、溶解氧、氯离子、总磷、总氮、氨氮、亚硝酸盐氮、硝酸盐氮、高锰酸盐指数、五日生化需氧量10个环境因子进行典范对应分析。如图4所示。
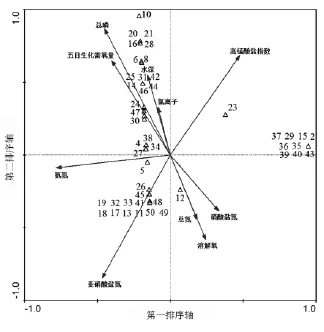
图4 大型底栖动物种类与环境因子的典范对应分析图
通过蒙特卡罗检验(Monte Carlo Peimutation Test)排除贡献小的因子,影响大型底栖动物群落结构的主要因子有高锰酸盐指数、总磷、氨氮及亚硝酸盐氮。排序图4中,前2个排序轴的特征值为0.965和0.848;大型底栖动物与环境因子前2个排序轴的相关系数很高,均为1.000;对于大型底栖动物来说,第一、第二排序轴之间的相关系数为0,表明这2个排序轴相互垂直;对于环境因子来说,前2个排序轴的相关性也为0,说明这2个排序轴也是垂直的,上述结果均说明,排序轴与环境因子间线性结合程度较好地反映了物种与环境因子之间的相互关系,排序结果是可信的[20,25]。
在图4中,与第一轴相关性较大的环境因子是氨氮和高锰酸盐指数,分别呈负相关和正相关,相关系数分别为0.477 6和-0.783 2。第一排序轴反映了氨氮的质量浓度、高锰酸盐指数的变化趋势,即排序图上从左往右,高锰酸盐指数逐渐增大,而氨氮的质量浓度逐渐降低。与第二轴相关性较大的环境因子是总磷、亚硝酸盐氮,分别呈正相关和负相关,相关系数分别为0.866 8和-0.846 3;其次,溶解氧、五日生化需氧量、高锰酸盐指数、水深与第二轴的相关性也比较大,相关系数分别为 -0.582 0、0.649 2、0.683 7、0.547 6。第二排序轴反映了溶解氧、五日生化需氧量、高锰酸盐指数、水深变化趋势,即大型底栖动物沿着排序抽的方向,从下往上对溶解氧的需求逐渐降低,对五日生化需氧量、高锰酸盐指数和水深的需求逐渐增加。
3 结论与讨论
本研究表明,不同区域的大型底栖动物在密度、生物量、多样性及特征种类均存在较大差异。在采集到的50种大型底栖动物中,水生昆虫居明显优势,且大多数分布在10#~13#点,而1#~8#点以寡毛类为主。Bray-Curtis相似性系数聚类分析和MDS分析将13个采样点划分为4个区域。区域Ⅰ(1#~8#)大型底栖动物的密度和生物量小,多样性指数(d、H)值低,均匀度指数(J)和Goodnight-Whitley生物指数(GI)值较高;区域Ⅱ(11#—13#)和Ⅲ(10#)大型底栖动物的密度和生物量都很大,d、H值均相对较高,J和GI值较低,其中区域Ⅲ的GI值为0;区域Ⅳ(9#)没有采集到大型底栖动物,这些与各区域环境因子存在差异是密切相关的。
区域Ⅰ分布在阿什河入口、黄泥河入口、水库中心及双龟山。水深在3~18 m之间,水中溶解氧相对于区域Ⅱ、Ⅲ低,有机质除总磷外均比区域Ⅱ低,但是区域Ⅰ底泥中总磷、总氮、高锰酸盐指数均超标[10],因此,直接表现为寡毛类颤蚓科在该区的绝对优势。区域Ⅰ大型底栖动物的密度小(440 ind·m-2)、种类少,主要是由于建库时间较短,不能满足新物种形成对时间的需求。
区域Ⅱ和区域Ⅲ分布在平山西桥、南桥,阿什河与二道河汇合处和铁路桥处,水位均较浅(1 m以下)。水中溶解氧质量浓度Ⅰ<Ⅱ<Ⅲ,总磷质量浓度为Ⅰ>Ⅱ>Ⅲ,氨氮质量浓度为Ⅱ>Ⅰ>Ⅲ,其余有机质的质量浓度均大于区域Ⅰ。这两个区域均分布在阿什河上游,由于水深的减小,大型底栖动物的种类和数量有所增加,这与郭维士等[26]在西泉眼水库渔业资源调查报告中提到的底栖动物的种类和数量随水深增加而递减的规律一致;另一方面,有机质丰富的水体,大型底栖动物的种类组成和数量就多[20]。
区域Ⅳ分布在大坝出水口。该区域由于修建大坝时倾倒的大量水泥残渣沉积到水底,将底泥覆盖,破坏了底质环境,不适于大型底栖动物生存;其次,受底质较硬等环境条件的限制,采样难度加大,从而导致在该区域未采集到大型底栖动物。
此外,大型底栖动物的幼虫期对底质环境是十分敏感的,底质环境的好坏和营养物质的贫富在一定程度上可以直接影响动物的生存、发展及种类组成[27]。区域Ⅰ中,1#~4#采样点底质为含有较多植物碎屑的软泥;5#~8#采样点属淤泥底质,区域Ⅱ底质为粗砂和砂砾,区域Ⅲ底质为泥砂和砾砂。区域Ⅰ和区域Ⅱ、Ⅲ的底质类型相差很大,因而,大型底栖动物的种类组成和数量差异很大;区域Ⅱ和区域Ⅲ底质类型比较相近,因而,除种类组成差别较大外,大型底栖动物的密度和生物量相差均不大。而要深刻理解影响大型底栖动物的关键因素,需要长期的历史数据积累和比对分析,以及进一步的深入研究。
[1]江晶,温芳妮,顾鹏,等.湖北清江流域胡家溪大型底栖动物群落结构及水质评价[J].湖泊科学,2009,21(4):547 -555.
[2]王兆印,程东升,段学花,等.东江河流生态评价及其修复方略[J].水利学报,2007(10):1228 -1235.
[3]张咏,厉以强,沈燕飞,等.江苏地表水体大型底栖无脊椎动物生物多样性状况研究[J].中国环境监测,2009,25(5):78 -82.
[4]戴友芝,唐受印,张建波.洞庭湖底栖动物种类分布及水质生物学评价[J].生态学报,2000,20(2):277 -282.
[5]高峰,尹洪斌,胡维平,等.巢湖流域春季大型底栖动物群落生态特征及与环境因子关系[J].应用生态学报,2010,21(8):2132-2139.
[6]蒋万祥,贾兴焕,周淑婵,等.香溪河大型底栖动物群落结构季节动态[J].应用生态学报,2009,20(4):923 -928.
[7]寿鹿,曾江宁,廖一波,等.瓯江口海域大型底栖动物分布及其与环境的关系[J].应用生态学报,2009,20(8):1958 -1964.
[8]Cowell B C.Distribution and seasonal abundance of benthic macroinvertebrates in a subtropical Florida lake[J].Hydrobiologia,1981,78:97 -105.
[9]孙刚,盛连喜,李明全.长春南湖底栖动物群落特征及其与环境因子的关系[J].应用生态学报,2001,12(2):319 -320.
[10]迟晋峰,刘玉黛,迟晋旭.哈尔滨市西泉眼水库水环境现状及水源保护对策[J].黑龙江水利科技,2010,38(1):174 -175.
[11]邢延峰,白羽军.西泉眼水库富营养化状况的研究[J].黑龙江环境通报,2007,31(1):46 -48.
[12]中华人民共和国水利部.水环境监测规范[M].北京:中国水利水电出版社,1998.
[13]国家环境保护总局,水和废水监测分析方法编委会.水和废水监测分析方法[M].北京:中国环境科学出版社,2002.
[14]马藏允,刘海,王惠卿.底栖生物群落结构变化多元变量统计分析[J].中国环境科学,1997,17(4):297 -300.
[15]Lampitt R S,Wishner K F,Turley C M,et al.Marine snow studies in the Northeast Atlantic Ocean:distribution,composition and roles as a food source for migrating plankton[J].Marine Biology,1993,116(4):689 -702.
[16]Bray J R,Curtis J T.An ordination of the upland forest communities of Southern Wisconsin[J].Ecological Monographs,1957,27:325-349.
[17]徐兆礼,王云龙,沈焕庭,等.长江口最大浑浊带区浮游动物的生态研究[J].中国水产科学,1995,2(1):39 -48.
[18]Margalef R.Information theory in ecology[J].General Systems,1958,3:36 -71.
[19]Shannon C E.A mathematical theory of communication[J].The Bell System Technical Journal,1948,27:379 -423,623 -656.
[20]吕光俊,熊邦喜,刘敏,等.不同营养类型水库大型底栖动物的群落结构特征及其水质评价[J].生态学报,2009,29(10):5339-5349.
[21]Goodnight C J,Whitley L S.Proceedings 15th industrial waste conference[M].Indianna:Purdue University Lafayette,1960:139 -142.
[22]王备新,杨莲芳.我国东部底栖无脊椎动物主要分类单元耐污值[J].生态学报,2004,24(12):2768 -2775.
[23]王建国,黄恢柏,杨明旭,等.庐山地区底栖大型无脊椎动物耐污值与水质生物学评价[J].应用与环境生物学报,2003,9(3):279-284.
[24]迟晋峰,刘玉黛,迟晋旭.哈尔滨市西泉眼水库水环境现状及水源保护对策[J].黑龙江水利科技,2010,38(1):174 -175.
[25]姚恩亲,杨晓红,张海燕,等.基于典范对应分析的南太湖入湖口浮游植物环境关系研究[J].地质灾害与环境保护,2010,21(4):57-62.
[26]郭维士,杨凤华,董宏伟,等.西泉眼水库渔业资源调查报告[J].黑龙江水产,2001(4):7 -9.
[27]吴耀泉.关于浅海底栖动物的生态分布和底质环境关系的概述[J].海洋科学,1983(6):58 -61.

