电化学可控制备溶胶-凝胶薄膜在生物传感器中的应用
孙海宜, 崔培英, 尤进茂, 渠凤丽,2*
(1.曲阜师范大学化学与化工学院,山东省生命有机分析重点实验室,山东曲阜273165)
(2.青岛科技大学,橡塑材料与工程教育部重点实验室,山东青岛266045)
0 引言
生物传感器是生物识别单元与信号转换元件耦联形成的功能器件,以生物活性单元作为生物敏感膜,通过各种信号转换器捕捉待测物与敏感物质间的反应,是分析体系生物化学信息获取的重要工具。目前,生物传感器研究领域需要解决的主要问题是如何提高界面可控性及重现性。传统传感界面构建的不可控性使得生物传感器的实用性(重现性)及分析性能(灵敏度、选择性)均受到影响。要得到灵敏度高、精确度高、成本低、高通量的生物传感器,性能优良的传感界面构建是关键。因此,构建化学可控、生物兼容性好、有利于界面传质与信号转换的生物传感界面是生物传感研究领域的热点问题和一大挑战。
溶胶-凝胶技术在生物传感器领域应用广泛,因为其不仅具有好的生物兼容性和化学惰性、热稳定性等性质,而且硅和有机硅薄膜在室温下即可在电极表面制备[1~4]。这种薄膜通常可以通过浸涂(dip-coating)或旋涂(spin-coating)含有适当有机硅单体,蒸发诱导在基底表面水解聚合[5~6]。这种方法操作简单,但也存在膜厚度不可控制、凝胶膜易脆裂、与金属电极基底结合不牢固等缺点,而且此种方法仅限于在平坦基底表面成膜。
溶胶-凝胶过程包含两步:前驱物单体在一定条件下水解和水解单体共聚为网状结构氧化物凝胶。Walcarius小组通过用电化学沉积方法分步控制溶胶-凝胶过程发展了溶胶-凝胶制备新方法[7~8]。即在电极/溶液表面施加一个负电位,产生OH-使(仅仅使)电极/溶液表面pH升高从而加快共聚过程生成硅溶胶-凝胶薄膜。此硅溶胶-凝胶膜只会沿着导电基底形成,这样不仅实现了溶胶-凝胶膜的电化学可控制备而且实现了在不平基底上的制备。电化学可控制备方法制备表面介孔溶胶-凝胶膜可改善生物识别特性与信号转换功能,实现固定化与功能化的统一。在溶胶-凝胶合成体系中引入一些小分子有机添加剂可以合成出具有均一介孔特征的材料,促进了界面传质,有利于较大分子的固定化。该文综述了近年来溶胶-凝胶技术在生物活性物质固定化方面的应用和进展,对比了不同溶胶-凝胶技术在生物传感器应用方面的优缺点。
1 浸涂(dip-coating)或旋涂(spin-coating)成膜法
溶胶-凝胶技术是指有机或无机化合物经过溶液、溶胶、凝胶而固化,再经过热处理而制得氧化物或其它化合物固体的方法,包括水解和聚合、凝胶化、老化和干燥等几个步骤。溶胶-凝胶薄膜通常可以通过浸涂 (dip-coating)或旋涂(spin-coating)含有适当有机硅单体,蒸发诱导在基底表面水解聚合。溶胶-凝胶技术在生物传感器中的应用早期大都是通过此种成膜方法。与其它固化方法相比,溶胶-凝胶包埋法可以较好地保持蛋白质表面微观结构的整体性和方向均一性,所以对组份的活性和稳定性的损伤较小。因而可较好地保持生物活性,适用于任何种类生物组份,并且具有高的热稳定性和光化学稳定性[9~11]。Braun和他的同事们[12]成功地将碱性磷酸酯酶埋入TMOS的Sol-gel中,所得的复合生物活性材料在室温的水溶液中放置了2个月而没有失活。Barrero[13]用硅凝胶固定的pyoverdin荧光法分析了Fe3+,实验中没有发现试剂的泄漏,且其稳定性在溶胶-凝胶基底中得到了增强。Tastsu[14]制备了含有葡萄糖酶(GOD)的TEOS溶胶-凝胶,他们研究了包埋GOD的回收率、酶活性与老化时间的关系,溶液中酶的活性在4℃保存了2个月后仍然存在,并随老化温度的升高而降低。Wang[15~17]亦分别研究了溶胶-凝胶碳复合的葡萄糖传感器和IgG免疫传感器。
2 电化学方法引导超薄溶胶-凝胶膜
溶胶-凝胶过程包含两步:前驱物单体在一定条件下水解(方程式 1,酸性条件,pH=3),水解单体共聚为网状结构的氧化物凝胶(方程式2,碱性条件,pH=8)。
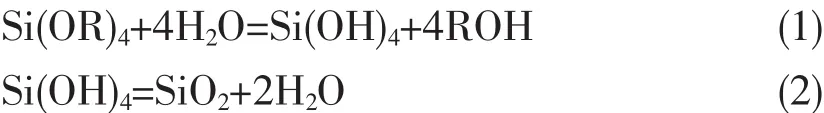
Walcarius小组通过用电化学沉积方法分步控制溶胶-凝胶过程发展了溶胶-凝胶制备新方法。即在电极/溶液表面施加一个负电位,产生OH-使(仅仅使)电极/溶液表面pH升高从而加快共聚过程生成硅溶胶-凝胶薄膜[18~21]。电化学方法分步沉积溶胶-凝胶膜有两个明显不同过程。第一阶段为本体溶胶-凝胶化过程,第二阶段为界面溶胶-凝胶化过程。构建电化学可控生物传感界面,控制溶胶-凝胶膜只在基底上形成是关键问题。这就要求用电化学方法在基底表面电沉积溶胶-凝胶薄膜时,一是要减缓本体溶胶-凝胶化过程,二是控制界面溶胶-凝胶化过程。溶胶浓度、溶胶组份、水解时间、水解温度及体系是否搅拌等是决定本体溶胶-凝胶化的主要影响因素[22~23]。减缓本体溶胶-凝胶化过程,尽量减少溶胶-凝胶化过程在溶液中进行,从而保证溶胶-凝胶化过程仅在导电基底表面进行。
控制膜厚度是发展溶胶-凝胶电化学可控技术的关键部分之一,因为膜厚度不仅影响界面传质也影响信号转化能力,更会直接影响响应信号的灵敏度[24]。电化学过程的有效速率常数(Keff)和扩散控制电流(Ilim)成正比关系,和膜厚度(d)成反比关系,具体可用下列关系式(3)表达:
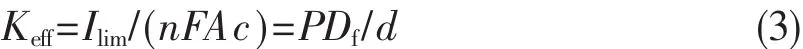
其中,n是电化学过程中转移电子数,F为法拉第常数(C mol-1),A为电极面积 (cm2),c是溶液中氧化还原探针浓度 (mol.cm-3),P是溶液和膜之间的分配系数,Df是透过膜的表观扩散常数(cm2.s-1),d为膜厚度(cm)。控制沉积速度是控制膜厚度的关键,也是发展溶胶-凝胶膜电化学可控制备方法的关键。
Walcariu小组用此电化学方法通过使用非常稀的正硅酸乙酯单体、调节沉积时间和沉积电压成功制备了生物兼容性好的硅溶胶-凝胶超薄膜(<100 nm)(图1)[25]并用于血红蛋白固定。 多孔电极大的比表面积使得它相对传统电极有更高灵敏度。Walcarius小组与Kuhn小组合作,通过模板法制备多孔金电极[26~27],并用电化学方法在多孔金电极内壁上沉积硅溶胶-凝胶薄膜。沉积完成后没有堵塞微孔以及微孔之间的通道,保证了界面传质的有效性(图2)[25]。电化学方法调节pH的方法只允许催化缩聚在电极/溶液界面进行,这就有利于均匀地在多孔金电极内壁沉积硅薄层而不会堵塞内孔。此方法扩大了溶胶-凝胶膜在各个领域的应用前景,在不平基底上实现了生物分子的无损固定化。
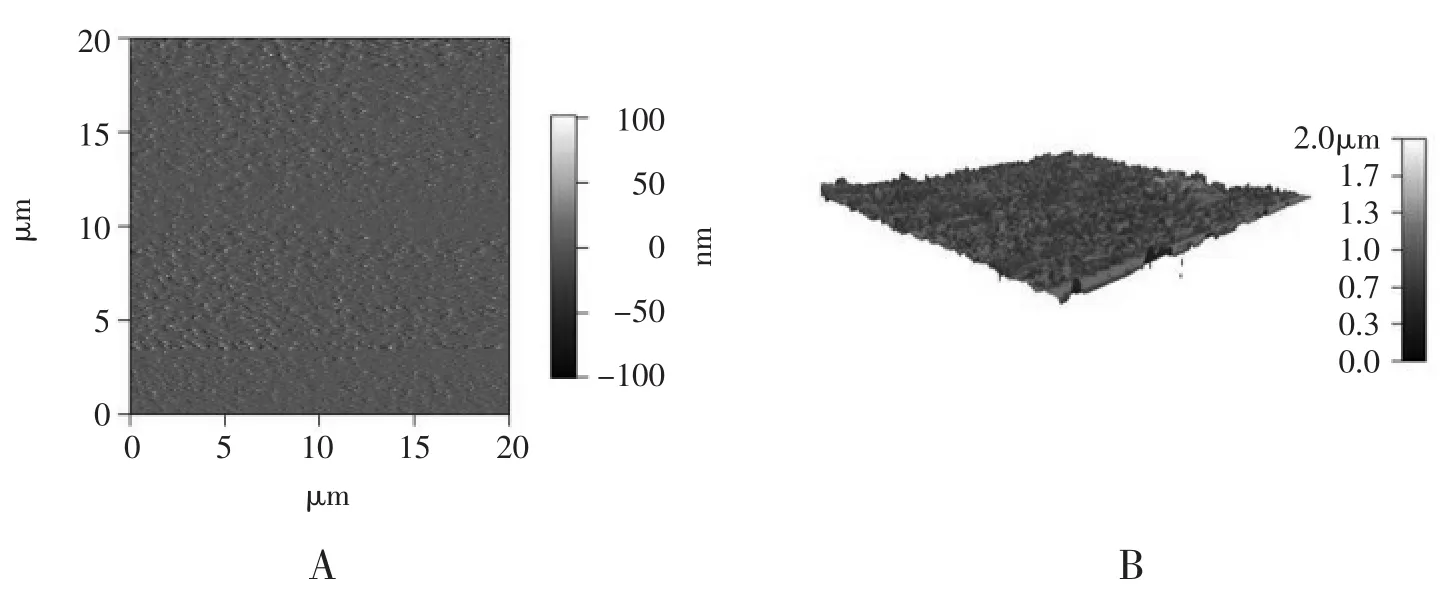
图1 在平坦金电极基底上电化学沉积TEOS溶胶-凝胶膜后的AFM(A)、AFM-3D(B)图Fig.1 AFM image of a flat substrate after electrochemical deposition of TEOS sol-gel film,(A),AFM-3D(B)
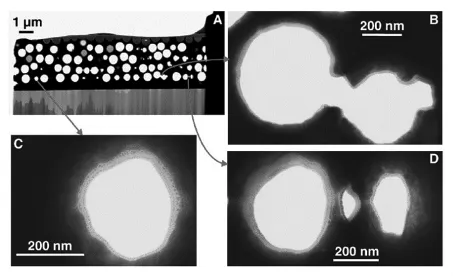
图2 在13.6 mmol/L TEOS溶胶中浸15 min后,再电沉积20 s超薄硅膜的多孔金电极(9/2层)的高分辨图(B-D)Fig.2 High resolution views(B-D)of a slice(A)of a macroporous gold electrode(9/2 layers)decorated with an ultra-thin silica film electrogenerated for 20 s,after 15 min wetting in a sol made of 13.6 mmol/L TEOS
3 电化学方法引导超薄介孔溶胶-凝胶膜
表面传质是影响生物传感器性能的重要因素之一,介孔膜的构建有利于提高生物传感器的表面传质。1998年,Wei等[28~29]首次成功的以非表面活性剂(主要是有机小分子,如D-葡萄糖、联苯甲酰-L-酒石酸、D-麦芽糖等)为模板,经溶胶-凝胶法制备出具有大比表面积和高孔容的介孔SiO2材料。该方法具有操作简单、成本低、反应条件温和等特点,并且材料的孔径大小可以通过控制有机小分子模板的浓度进行调节,可用于较大生物分子的固定化[30]。
近年来,人们发现在溶胶-凝胶合成体系中引入一些小分子有机添加剂可以合成出具有均一介孔特征的材料。尤其是模板法合成介孔材料具有操作简单、可控性强等优点,已经显示出良好的发展前景。Takahashi等[31]将柠檬酸作为有机小分子添加剂引入到SiO2合成体系中制备出高比表面、孔径均一分布的介孔SiO2材料。通过调节柠檬酸的用量,材料的孔径大小在2~12 nm范围内可调。柠檬酸在合成过程中起到模板剂的作用,有利于介孔的形成。Zheng等[32]以尿素和环糊精有机分子作为模板剂,在室温下通过钛酸丁酯醇溶液的水解缩聚反应制出介孔TiO2材料。
正如Brinker和Dunphy讨论的那样,以表面活性剂为模板制备介孔材料要解决的两个重要问题就是控制孔道方向和形貌[33~34]。介孔孔道的尺寸及方向制约材料的性能,影响分子的有效扩散。实验证明介孔孔道方向垂直于基底的介孔材料有利于分子无障碍通过。近期虽有报道通过化学修饰固-液界面和(或)维度限制自组装过程来控制成核和孔道方向,而所有纳米结构孔道均垂直于基底仍然有挑战。Walcarius小组提出用电化学方法引导,以表面活性剂为模板在各种不同基底上自组装垂直于基底的均一多孔硅薄膜[24,35~38]。孔的方向控制主要是如何通过电化学方法诱导模板在导电基底的有序组装 (图3)[35]。影响模板有序组装的各种因素主要有电荷密度、模板间的定向作用力等。通过电化学方法实现模板在基底上的有序组装,从而实现孔道方向垂直于基底表面介孔膜的制备[8,39~40]。该方法结合了电化学引导表面活性剂在固-液表面自组装及电化学方法制备溶胶-凝胶超薄膜原理。即对含有模板的电极/溶胶表面应用一个合适的阴极电位产生催化缩聚所必需的OH-并自组装垂直于电极的一维通道。Walcarius小组研究了不同导电基底、模板与溶胶比例等对成孔尺寸的影响。该方法是兼容控制的在异构基底上的局部沉积,开辟了电化学方法制备复杂模式介孔材料的道路。

图3 初步制备的介孔溶胶-凝胶纳米薄膜的扫描电镜图Fig.3 TEM images of the electrodeposited sol-gel nanometer thin films with mesoporous
4 展望
在电化学可控方法制备介孔溶胶-凝胶薄膜的研究基础上,电化学方法制备表面介孔溶胶-凝胶纳米材料复合膜将会在提高传感器的灵敏度方面有一定潜力。可以进行溶胶-凝胶有机高分子复合膜生物兼容性、电化学特性及其在生物传感界面构建中的应用研究。因为聚合膜可以进一步提高体系的生物相容性,提高生物分子的修饰能力,也可以作为媒介体改善信号转换能力。可以开展原位电化学方法共沉积掺杂了电化学活性物质(亚甲基蓝等)的溶胶-凝胶复合膜的电化学性质及其在生物传感界面构建中的应用研究。因为具有氧化还原活性的电活性物质在和硅烷化试剂共聚的时候可以起到交联剂的作用,有利于形成更强劲稳定的表面控制共聚膜。这个过程包含了对氧化还原薄膜中氧化还原中心的"稀释"作用,保证了较高电子转移效率。近年来,纳米材料在电子设备和纳米传感器等许多领域得到广泛研究与应用。因为纳米结构的材料具有独特的光学、电学和催化特性及良好的生物相容性。可以开展原位电化学方法共沉积掺杂了无机纳米材料(碳纳米管、金纳米颗粒等)、无机半导体纳米粒子(ZnS、CdS等)的复合溶胶-凝胶膜的电化学催化能力及其在生物传感界面中的应用研究。研究电化学引导溶胶-凝胶薄膜的新方法,制备过程简单,成膜厚度可控,又可在不平基底上成膜,必将为今后的生物组份固化技术、生物传感器的制备提供更多的机会和条件。
[1]Wang B Q,Li B,Wang Z X,et al.Sol-gel thin-film immobilized soybean peroxidase biosensor for the amperometric determination of hydrogen peroxide in acid medium[J].Anal.Chem.,1999,71(10):1 935~1 939.
[2]Gupta A,Prabhakar N,Singh R,et al.sol-gel derived cerium-oxide-silicon-oxide nanocomposite for cypermethrin detection[J].Thin Solid Films,2010,519(3):1 122~1 127.
[3]Shi G Y,Sun Z Y,Liu M C,et al.Electrochemistry andelectrocatalytic properties of hemoglobin in layer-bylayer films of SiO2with vapor-surface sol-gel deposition[J].Anal.Chem.,2007,79(10):3 581~3 588.
[4]Dave B C,Soyez H,Miller J M,et al.Synthesis of protein-doped sol-gel SiO2thin films:evidence for rotational mobility of encapsulated cytochrome C[J].Chem.Mater.,1995,7(8):1 431~1 434.
[5]Gill I,Ballesteros A.Encapsulation of biologicals within silicate,siloxane,and hybrid sol-gel polymers:an efficient and generic approach[J].J.Am.Chem.Soc.,1998,120:8 587~8 598.
[6]Etienne M,Walcarius A.Evaporation induced self-assembly of templated silica and organosilica thin films on various electrode surfaces[J].Electrochem.Commun.,2005,7:1 449~1 456.
[7]Nadzhafova O,Etienne M,Walcarius A.Direct electrochemistry of hemoglobin and glucose oxidase in electrodeposited sol-gel silica thin films on glassy carbon[J].Electrochem.Commun.,2007,9:1 189~1 195.
[8]Sibottier E,Sayer S,Gaboriaud F,et al.Factors affecting the preparation and properties of electrodeposited silica thin films functionalized with amine or thiol groups[J].Langmuir,2006,22:8 366~8 373.
[9]李清文,王义明,罗国安.溶胶凝胶技术在生物传感器中的应用[J].化学通报,2000,5:14~19.
[10]Lev O,Tsionsky M,Rabinovich L,et al.Organically modified sol-gel sensors[J].Anal.Chem.,1995,67:22A~30A.
[11]Dave B C,Dunn B,Valentine J S,et al.Sol-gel encapsulation methods for biosensors[J].Anal.Chem.,1994,66:1 120A~1 127A.
[12]Braun S,Rappoport S,Zusman R.Biochemically active sol-gel glasses,the trapping of enzyme[J].Mater.Lett.,1990,10:1~5.
[13]Barrero J M,Carrara C,Perez-Conde MC,et al.Pyoverdin doped sol-gel glass for the spectrofluorimetric determination of irom(Ⅲ)[J].Analyst,1995,120:431~435.
[14]Tastsu Y,Yamashita K.Entrapment of GOD in silica gel by sol-gel method and its application to glucose sensors[J].Chem.lett.,1992,1 615~1 618.
[15]Wang J,Pamidi P V A,Rogers K R.Sol-gel derived thick film amperometric immunosensors[J].Anal.Chem.,1998,70:1 171~1 175.
[16]Wang J,Park D S,Pamidi P V A.Tailoring the macroporosity and performance of sol-gel derived carbon composite glucose sensors[J].Electroanal.Chem.,1997,434:185~189.
[17]Wang J,Pamidi P V A,Park D S.Sol-gel derived metal dispersed carbon composite amperometric biosensor[J].Electroanalyst,1997,9:52~55.
[18]Amatore C,Oleinick A,Klymenko O V,et al.Theory and simulation of diffusion-reaction into nano-and mesoporous structures.Experimental application to sequestration of mercury(Ⅱ)[J].Anal.Chem.,2008,80:3 229~3 243.
[19]Fowler C E,Buchber C,Lebeau B,et al.An aqueous route to organically functionalized silica diatom skeletons[J].App.Sur.Sci.,2007,253:5 485~5 493.
[20]Walcarius A.Electrochemical applications ofsilicabased organic-inorganic hybrid materials[J].Chem.Mater.,2001,13:3 351~3 372.
[21]Devoy J,Walcarius A,Bessiere J.Chemical Mechanisms Responsible for the Immobilization of Selenite Species from an Aqueous Medium in the Presence of Copper(Ⅰ)Oxide Particles[J].Langmuir,2002,18:8 472~8 480.
[22]Zhao D Y,Huo Q S,Feng J L,et al.Nonionic Triblock and Star Diblock Copolymer and Oligomeric surfactant Syntheses of highly ordered,hydrothermally stable,mesoporous silica structures[J].J.Am.Chem.Soc.,1998,120:6 024~6 036.
[23]Indraneil M,Chen J,Wei Y,et al.Use of sublimation for template removal from menthol templated mesoporous organosilica prepared via sol-gel process[J].Powder Technology,2011,206:214~217.
[24]Etienne M,Quach A,Grosso D,et al.Molecular transport into mesostructured silica thin films:electrochemical monitoring and comparison between p6m,P63/mmc,and Pm3n Structures[J].Chem.Mater.,2007,19:844~856.
[25]Qu F L,Nasraoui R,Etienne M,et al.Electrogeneration of ultra-thin silica films for the functionalization of macroporous electrodes[J].Electrochem.Commun.,2011,13:138~142.
[26]Szamocki R,Reculusa S,Ravaine S,et al.Tailored mesostructuring and biofunctionalization of gold for increased electroactivity[J].Angew.Chem.Int.Ed.,2006,45:1 317~1 321.
[27]Walcarius A,Kuhn A.Ordered porous thin films in electrochemical analysis[J].Trends in Anal.Chem.,2008,27:593~603.
[28]Wei Y,Jin D,Ding T,et al.A non-surfactant templating route to mesoporous silica materials[J].Adv.Mater.,1998,3:313~316.
[29]Wei Y,Xu J,Dong H,et al.Preparation and physisorp-tion characterization of d-glucose-templatedmesoporous silica sol-gel materials[J].Chem.Mater.,1999,11:2 023~2 029.
[30]Wei Y,Feng Q W,Xu J G,et al.Polym ethacrylate-silica hybrid nanoporous materials:a bridge between inorganic and polymeric molecular sieves[J].Adv.Mater.,2000,12:1 448~1 450.
[31]Takahashi R,Sato S,Sodesawa T,et al.High surfacearea silica with controlled pore size prepared from nanocomposite of silica and citric acid.[J].J.Phys.Chem.B,2000,104:12 184~12 191.
[32]Zheng J,Pang J,Qiu K Y,et al.Synthesis of mesoporous titanium dioxide materials by using a mixture of organic compounds as a non-surfactant template[J].J.Mater.Chem.,2001,11:3 367~3 372.
[33]Brinker C J,Dunphy D R.Morphological control of surfactant-templated metal oxide films[J].Curr.Opin.Colloid Interface Sci,2006,11:126~132.
[34]Jiang Y,Liu N,Gerung H,et al.Nanometer-thick conformal pore sealing of self-assembled mesoporous silica by plasma-assisted atomic layer deposition[J].J.Am.Chem.Soc.,2006,128:11 018~11 019.
[35]Walcarius A,Sibottier E,Etienne M,et al.Electrochemically assisted self-assembly of mesoporous silica thin films[J].Nature Mater,2007,6:602~608.
[36]Walcarius A.Electroanalytical applications of microporous zeolites and mesoporous (organo)silicas:recent trends[J].Electroanalysis,2008,20:711~738.
[37]Goux A,Etienne M,Aubert E,et al.Oriented mesoporous silica films obtained by electro-assisted self-assembly(EASA)[J].Chem.Mater.,2009,21:731~741.
[38]Rozhanchuk T,Tananaiko O,Mazurenko I,et al.Electroanalytical properties of haemoglobin in silica-nanocomposite films electrogenerated on pyrolitic graphite electrode[J].J.Electroa.Chem.,2009,625:33~39.
[39]Sayen S,Walcarius A.Electro-assisted generation of functionalized silica films on gold[J].Electrochem.Commun.,2003,5:341~348.
[40]Walcarius A,Sibottier E.Electrochemically-induced deposition of amine-functionalized silica films on gold electrodes and application to Cu(Ⅱ)detection in(Hydro)alcoholic medium[J].Electroanalysis,2005,17:1 716~1 726.

