Anti-HER2 ScFv-GFP融合蛋白在大肠杆菌中的表达及其靶向结合乳腺癌细胞的初步分析
高国辉,黄奇迪,王金丹,杨水兵,杨娟,张凤立,胡孝渠
(1.温州医学院 生命科学院,浙江 温州 325035;2.温州医学院附属第一医院 肿瘤外科,浙江温州 325000;3.温州医学院 仁济学院,浙江 温州 325035)
人表皮生长因子受体2(the human epidermal growth factor receptor 2,HER2)是定位于17号染色体长臂上的癌基因[1],该基因的表达状态与肿瘤的恶性程度呈正相关,是典型的恶性肿瘤标志物。目前,以HER2为靶标对肿瘤细胞进行靶向生物治疗是临床肿瘤治疗的热点之一[2-4]。
抗HER2单链抗体片段(anti-HER2 single chain fragment variable,anti-HER2 ScFv)是抗HER2免疫球蛋白Fab片段中的可变区部分,其分子小、穿透实体瘤能力强、靶向特异性明显。研究表明,将Anti-HER2 ScFv与其他肿瘤细胞杀伤性多肽重组,构建融合蛋白用于药物靶向性研究将具有十分重要的应用价值[5-7]。 但是,这些融合蛋白靶向结合HER2的结果验证大多需要间接免疫法或流式细胞仪计数判断最终结果,鉴定步骤较多,误差大。
本研究拟以绿色荧光蛋白(green fluorecent protein,GFP)为报告基因,构建融合基因anti-HER2-ScFv-GFP,在原核表达系统表达获得携带绿色荧光蛋白的抗HER2单链抗体,观察该融合单链抗体结合乳腺癌细胞表面受体后活细胞表面绿色荧光的分布,分析其应用于靶向治疗HER2阳性肿瘤和分子诊断的可能。
1 材料和方法
1.1 材料
1.1.1 基因片段、菌种与载体:鼠源性人抗HER2-ScFv片段由中山大学医学院宋尔卫教授课题组提供,GFP片段由浙江大学生命科学院吴敏教授惠赠,大肠杆菌E.coliTG1、E.coliTOP10、原核表达载体pBAD His B由本实验室保存, pGEM T easy Vector购于Promega公司。
1.1.2 主要试剂:T4DNA连接酶、TaqDNA聚合酶、dNTP、中分子量蛋白Marker、NC膜购于Promega公司,限制性内切酶EcoRI、HindIII、BamHI、dNTPs、DNA Marker DL2000、DNA Marker 4500均为Takara公司产品;鼠抗GFP-Tag mAb、Goat Anti-Mouse IgG-HRP、DAB为ABMART公司产品,DNA Gel PurfiicatoinKti3.1为上海申能博彩生物科技有限公司产品;质粒抽提试剂盒购于Omega公司。
1.2 方法
1.2.1 引物的设计与合成:见表1。

表1 PCR引物名称及序列
1.2.2 融合基因anti-HER2-ScFv-GFP的构建:PCR法分别获得目的基因anti-HER2-ScFv、GFP,用EcoRI、Bam HI双酶切anti-HER2-ScFv基因片段,用Hind III、Bam HI双酶切基因片段GFP,分别胶回收之。将两条同时具有Bam HI黏性末端胶回收片段产物利用T4DNA连接酶16 ℃连接过夜,以连接产物为模板,以anti-HER2-ScFv-F为上游引物,GFPR为下游引物,PCR扩增获得融合基因,1%琼脂糖凝胶电泳鉴定之。将之克隆到pGEM T easy Vector,转化TG1感受态细胞,氨苄青霉素抗性筛选,构建供体质粒pGEM T easy Vector/anti-HER2-ScFv-GFP,测序鉴定阳性质粒中融合基因序列,Blast比对序列的正确性。
1.2.3 原核表达载体重组子pBAD His B/anti-HER2-ScFv-GFP的构建:用EcoR I、HindIII分别双酶切供体质粒pGEM T easy Vector/anti-HER2-ScFv-GFP,原核表达载体pBAD His B,用T4DNA连接酶将pBAD His B与anti-HER2-ScFv-GFP在4 ℃连接反应过夜,连接产物转化TG1感受态细胞,氨苄青霉素抗性筛选,蓝白斑筛选、双酶切鉴定重组子,提取阳性重组子质粒转化TOP10感受态细胞,鉴定之。
1.2.4 融合蛋白的诱导表达:挑取单克隆,接种于含有氨苄青霉素的LB液体培养基中,37 ℃过夜培养,次日以1:100接种,37 ℃培养至A600 nm达0.6左右,加0.2%浓度L-阿拉伯糖作为诱导剂,37 ℃,150 r/min,分别诱导0、3、5 h,吸取1.5 mL菌液离心沉淀菌体,用100μL 1×PBS重悬菌体待用。
1.2.5 SDS-PAGE与Western Blot分析:将菌液加等体积的2×SDS-PAGE Loading Buffer沸水浴煮沸5 min后,12000 r/min离心5 min取上清,以0 h诱导的重组菌与空载体菌株为阴性对照,进行SDS-PAGE分析。样品经SDS-PAGE分离后电转移至NC膜,以5 g/L脱脂奶粉室温封闭1 h,依次加入鼠抗GFP Tag mAb(1:5000稀释,4 ℃孵育过夜)为一抗,HRP标记的山羊抗小鼠IgG(1:5000稀释,室温2 h)为二抗用化学发光试剂盒于暗室条件下感光显影,分析蛋白质印迹结果。
1.2.6 表达产物的分离纯化与浓度测定:取200 mL诱导菌离心后收集菌体,用100 mmol/L Tris·HC1(pH 8.0)重悬,冰浴中温和超声6次(每次2 min,间隔10 s)破碎菌体,4 ℃,10000 r/min,离心5 min,收集上清,参照试剂盒说明书利用Ni2+-NTA亲和层析法纯化之,各取少量不同组洗脱液加入等量2×SDS-PAGE Loading Buffer,煮沸5 min,离心后取上清进行SDS-PAGE分析。透析法和稀释法反复复性, 取合适体积的纯化融合蛋白样品考马斯亮蓝法测定蛋白浓度,以牛血清血蛋白(BSA)为标准品。根据所测定的A595nm,利用标准曲线计算出未知样品的蛋白质浓度(μg/mL)。
1.2.7 融合蛋白结合HER2阳性细胞株SKBR3与HER2阴性细胞株MCF7功能的分析:过0.45μm滤膜对纯化后的融合蛋白除菌,胰酶消化生长铺满的乳腺癌细胞SKBR3、MCF7,重悬于无胎牛血清的RPMI1640培养液,分别滴入不同稀释度的融合蛋白样品(1:5、1:20、1:40),37 ℃, 50 mL/L CO2培养箱中培养2 h,调整细胞密度为5×108个/L,以1 mL/孔加入6孔细胞培养板,每孔1 mL,设复孔为阴性洗脱对照,使anti-HER2-ScFv与乳腺癌细胞SKBR3、MCF7细胞表面受体充分结合,添加胎牛血清含100 mL/L,37 ℃,50 mL/L CO2培养箱中培养48 h后,1×PBS洗3次。以GFP标准品为阴性对照,激光共聚焦显微镜观察绿色荧光单链抗体与SKBR3、MCF7细胞表面受体结合情况,分析细胞的变化。
2 结果
2.1 融合基因anti-HER2-ScFv-GFP的获得 1%琼脂糖凝胶电泳鉴定表明anti-HER2-ScFv(816 bp)在800 bp左右,GFP(720 bp)为700 bp左右,如图1A所示,融合基因anti-HER2-ScFv-GFP在1539 bp左右,如图1B所示,与预计相符合。
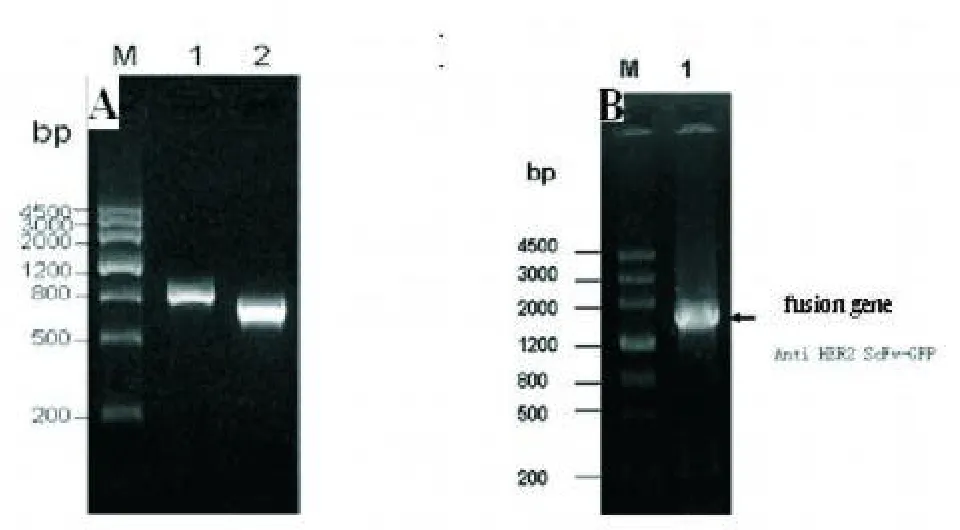
图1 融合基因的构建过程图
对pGEM T easy Vector/anti-HER2-ScFv-GFP测序,表明anti-HER2-ScFv片段处于融合基因上游,其3’端终止密码子TAA在PCR扩增时成功删除,全长813 bp。GFP片段处于融合基因下游,全长为720 bp,两片段由6 bp的BamHI酶切位点的互补黏性末端处直接连接,整个融合基因为1539 bp。Blast分析重组子中的融合基因序列与理论序列同源性为100%。
2.2 原核表达载体重组子pBAD His B/anti-HER2-ScFv-GFP的构建 1%琼脂糖凝胶电泳鉴定表明,双酶切结果在1500 bp左右有明显条带出现,EcoR I单酶切在4500 bp以上有明显条带出现,如图2A所示,PCR扩增出1539 bp条带如图2B,表明原核表达载体pBAD His B/anti-HER2-ScFv-GFP的构建成功。
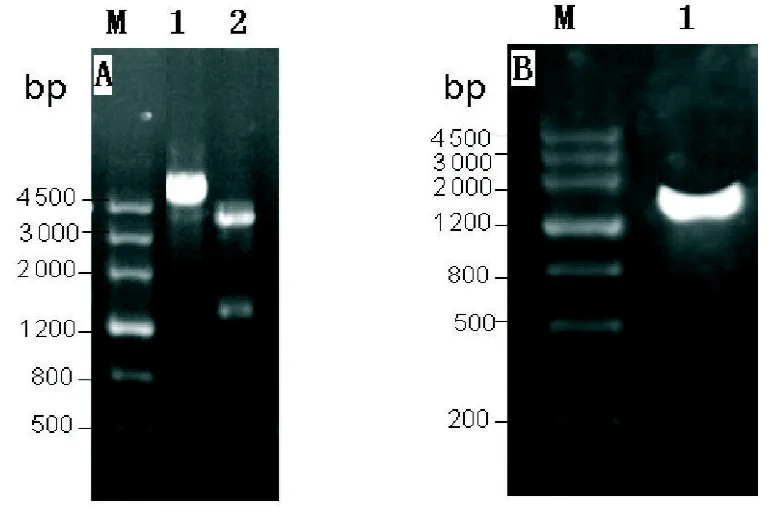
图2 原核表达载体重组子pBAD His B/anti-HER2-ScFv-GFP的构建
2.3 SDS-PAGE和Western Blot鉴定 SDS-PAGE结果如图3A所示。在55~72 kDa之间有明显特异性条带,与预计的融合蛋白60 kDa左右一致。蛋白样品经SDS-PAGE分离后电转移至NC膜,Western Blot结果有特异性条带在60 kDa左右,如图3B。
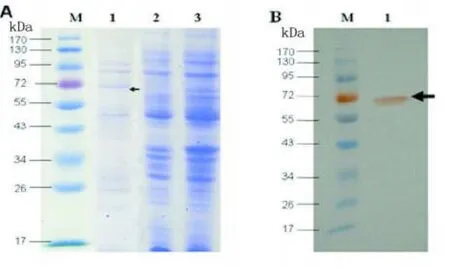
图3 SDS-PAGE法和Western Blot法鉴定原核表达系统获得的融合蛋白
2.4 融合蛋白的复性与浓度的测定 取1:10稀释后的纯化融合蛋白Anti-HER2-ScFv-GFP样品,考马斯亮蓝法测定蛋白浓度,所测定的A595nm=0.487,利用标准曲线计算出样品的蛋白质浓度约为492.8 μg/mL。
2.5 融合蛋白靶向结合SKBR3与MCF7的功能分析 以1:5、1:20、1:40不同浓度梯度稀释后,滴定于SKBR3和MCF7,48 h后分别用1×PBS洗脱,结果HER2阴性的乳腺癌细胞MCF7上的荧光单链抗体很容易被洗脱(图4B),而HER2阳性的乳腺癌细胞SKBR3上的荧光单链抗体不被洗脱,SKBR3细胞出现皱缩现象,细胞变小,增殖变慢(图4A)。GFP作为阴性对照也容易从SKBR3上洗脱下来(图4C)。

图4 融合蛋白分别与SKBR3、MCF7的结合效率对比,GFP阴性对照与SKBR3结合效率对比
3 讨论
有研究表明,将抗HER2单链抗体与其他基因融合构建融合蛋白,将同时具有靶向性和杀伤性,对抗HER2单链抗体的高级结构没有影响。Wang等[8]将抗HER2单链抗体与毒素蛋白ETA融合构建融合蛋白ScFv(FRP5)-ETA,研究其在前列腺癌LNCaP中的作用,结果ScFv(FRP5)-ETA融合蛋白可靶向性结合HER2过表达的前列腺癌LNCaP细胞表面从而将效应分子毒素蛋白ETA靶向性输入癌细胞,细胞出现明显的固缩、核浓缩等形态特征。Zhao等[9]将抗HER2单链抗体与前凋亡因子颗粒蛋白酶B融合构建融合蛋白,利用抗HER2单链抗体靶向性结合Jurkat细胞研究凋亡因子作用,结果该融合蛋白可特异性促使Jurkat凋亡。此外,以抗HER2单链抗体作为导向系统偶联各种HER2阳性肿瘤细胞的HER2受体并特异性杀死该肿瘤细胞的研究[10-13]还有很多。这些研究在结果验证中,均采用间接免疫荧光染色法观察转染后的细胞形态,而融合基因在肿瘤细胞内的表达情况则采用流式细胞仪进行检测分析。
本研究将抗HER2-ScFv基因片段置于融合基因的上游,绿色荧光蛋白GFP置于融合基因的下游,利用绿色荧光蛋白的报告作用分析抗HER2 ScFv-GFP单链抗体的靶向性。通过将融合基因进行序列测定并进行Blast比对表明,该融合基因中抗HER2单链抗体(813 bp)片段没有任何突变,其与下游的GFP(720 bp)之间仅仅多了一个BamHI位点6 bp左右,全基因序列长度为1539 bp。从理论上分析,将多出两个氨基酸,该融合基因在原核表达系统中正确表达的蛋白相对分子量应为58 kDa。将该融合基因构建到原核表达载体pBAD His B上后,从该原核表达载体结构序列图谱分析,pBAD His B核糖体结合位点(RBS)后的第一个翻译起始密码子与目的融合基因的起始密码子ATG之间多出ATG、6×His、Xpress epitope、Enterokinase site等结构,约多翻译出40个氨基酸,故原核表达成功后该融合抗体理论蛋白质相对分子量应为60 kDa左右。SDS-PAGE和蛋白质免疫印迹实验均表明融合蛋白成功在原核表达系统中表达。
在验证其靶向结合乳腺癌HER2阳性细胞的研究中,我们将抗HER2 ScFv-GFP在原核表达系统pBAD His B/anti-HER2-ScFv-GFP/TOP10中表达,利用Ni2+-NTA层析法纯化融合蛋白产物,研究其与肿瘤细胞的靶向结合效率。通过激光共聚焦显微镜或普通荧光显微镜直接观察绿色荧光的分布情况,结果表明融合蛋白抗HER2-ScFv-GFP可与HER2阳性肿瘤细胞SKBR3表面的HER2受体特异性结合,而与HER2阴性肿瘤细胞MCF7混合后,容易被1×PBS冲洗掉,则认为HER2阴性肿瘤细胞MCF7表面因无HER2表达,故无法接受抗HER2的单链抗体,也无法观察到绿色荧光。而GFP标准品与SKBR3的结合实验也排除了是GFP本身与HER2受体结合的可能性。因此,当该融合蛋白在靶向结合HER2阳性肿瘤细胞时,仅需用激光共聚焦显微镜或者普通荧光显微镜观察绿色荧光就可直接判断靶向结合效率,而不需通过流式细胞仪和间接免疫荧光染色法。但是,从SKBR3细胞表面分布的绿色荧光看,细胞变化并不十分明显,也没有发现凋亡现象,是否是因为原核表达载体自身的缺陷性而导致该融合蛋白的高级结构发生变化,还是其他原因,需要对该融合蛋白进一步研究其高级结构来判断。
本实验的成功使原来不可见的单链抗体封闭乳腺癌细胞表面HER2受体现象在荧光蛋白的报告下能够变得可见,可更直观分析乳腺癌细胞凋亡与单链抗体浓度变化的关系。同时,利用携带绿色荧光的抗HER2单链抗体的靶向性开发分子诊断试剂盒在肿瘤分型、初期诊断等方面具有十分重要的应用价值。
[1]Hayashi N, Nakamura S, Yagata H, et al. Chromosome 17 polysomy in circulating tumor cells in patients with metastatic breast cancer:a case series [J]. Int J Clin Oncol,2011, 6,[Epub ahead of print]
[2]Penault L,Jorca F. Targeted therapies: the question of target detection and evalution[J].Bull Cancer,2007, 94(7):245-248.
[3]Press MF, Lenz HJ. EGFR, HER2 and VEGF pathways: validated targets for cancer treatment[J]. Drugs,2007,67(14):2045-2075.
[4]Capala J, Bouchelouche K. Molecular imaging of HER2 positive breast cancer: a step toward an individualized’ image and treat strategy[J]. Curr Opin Oncol,2010,22(6):559-566.
[5]Robinson MK, Hodge KM, Horak E, et al.Targeting ErbB2 and ErbB3 with a bispecific single-chain Fv enhances targeting selectivity and induces a therapeutic effect in vitro [J].Br J Cancer,2008,99(9):1415-1425.
[6]Laginha KM, Moase EH, Yu N, et al. Bioavailability and therapeutic efficacy of HER2 scFv-targeted liposomal doxorubicin in a murine model of HER2-overexpressing breast cancer[J]. J Drug Target,2008,16(7):605-610.
[7]Shmeeda H,Tzemach D,Mak L, et al.Her2-targeted pegylated liposomal doxorubicin: retention of target-specific binding and cytotoxicity after in vivo passage[J]. J Control Release,2009,136(2):155-160.
[8]Wang L,Liu B,Schmidt M, et al Antitumor effect of an HER2-specific antibody-toxin fusion protein on human prostate cancer cells[J]. Prostate,2001,47(1):21-28.
[9]Zhao J, Zhang LH, Jia LT, et al.Secreted antibody/ granzyme B fusion protein stimulates selective killing of HER2-overexpressing tumor cells[J]. J Biol Chem,2004,279(20):21343-21348.
[10]Suzuki, T. Anderegg B, Ohkawa T,et al. Adenovirus-mediated ribozyme targeting of HER-2/neu inhibits in vivo growth of breast cancer cells[J]. Gene Ther,2000,7(3):241-248.
[11]Xu YM, Wang LF, Jia LT, et al. A caspase-6 and anti-human epidermal growth factor receptor-2 (HER2) antibody chimeric molecule suppresses the growth of HER2-overexpressing tumors[J]. J Immunol,2004,173(1):61-67.
[12]Jia LT,Zhang LH,Yu CJ, et al Specific tumoricidal activity of a secreted proapoptotic protein consisting of HER2 antibody and constitutively active caspase-3[J]. Cance Res,2003,63(12):3257-3262.
[13]任君琳,王涛,许彦鸣,等.重组抗HER2 ScFv/FDT/caspase-6基因的构建、表达及其活性鉴定[J].第四军医大学学报, 2007,28(3):193-196.

