ROCK抑制剂对脑出血大鼠脑白质损伤的影响
刘正姣,李东芳,贾晓涛,罗 岗
脑出血后神经元及神经纤维的损伤是影响脑出血患者病情程度及预后的主要因素。成年动物CNS轴突受损后不能再生的主要原因是CNS髓鞘中含有髓鞘抑制因子,髓鞘抑制因子是通过活化Rho蛋白家族成员之一 RhoA这一共同分子开关信号通路,引起一系列的反应,最终导致生长锥的溃变,从而抑制轴突再生。在己辨明的6个RhoA下级分子中,只有ROCK与轴突再生有关,因此,ROCK可能是CNS髓磷脂中各种轴突生长抑制性蛋白发挥作用的集中点[1]。盐酸法舒地尔(Fasudil hydrochloride)是目前临床唯一应用的 ROCK选择性抑制剂[2,3],能通过抑制 ROCK蛋白的表达,抑制Rho/ROCK信号转导通路的活化,从而减轻髓鞘抑制因子和胶质疤痕对神经再生的抑制。Satoh等[4]研究表明,ROCK抑制剂在缺血性脑卒中能够抑制脑缺血所导致的神经元死亡,但以往对出血性脑血管病脑损伤的保护作用研究较少。本实验通过大鼠脑出血模型,应用盐酸法舒地尔进行干预,观察比较其对脑出血大鼠神经功能缺损评分、血肿周围脑组织含水量及脑组织病理变化情况,探讨ROCK抑制剂对脑出血后神经损伤可能的保护作用。
1 材料与方法
1.1 动物和主要试剂 雄性 Wistar大鼠96只,体重250 g±15 g,购于山西医科大学生理实验室。将其分为3组:假手术组(n=36)、脑出血组(n=36)、盐酸法舒地尔治疗组(n=24)。假手术组和脑出血组选6个观察时点分别为手术前及手术后6 h、24 h、48 h、3 d、7 d。盐酸法舒地尔治疗组选4个时点分别为手术前及手术后48 h、3 d、7 d。每个时点均为6只动物。盐酸法舒地尔注射液购自天津红日药业股份有限公司;立体定位仪(江湾型)由山西医科大学生理实验室提供。固绿FCF购自上海如吉生物科技发展有限公司;变色素2R购自上海源叶生物科技有限公司;磷钨酸购自江西东太科技有限公司。苏木精、无水乙醇、冰醋酸等常规试剂由山西医科大学寄生虫实验室提供。
1.2 动物模型制作方法及模型成功标准 采用立体定向大鼠自体血注入内囊建立模型。模型成功标准,参照Zea Longa 5分制评分标准,大鼠清醒后评分。
1.3 神经功能障碍评分 造模成功后运用Bederson[5]大鼠神经功能缺损评分方法进行评分。总分为8分。
1.4 药物干预 按60 kg体重的人盐酸法舒地尔注射液治疗用量90 mg/d与大鼠换算,则大鼠用量为9.45 mg/(kg◦d),人和大鼠间按体表面积折算的等效剂量比值为6.3,再将静脉注射转变为腹腔注射为(11.15~11.81)mg/(kg◦d)。治疗组于出血后24 h开始给药,1次/天,直到相应时点。ICH组腹腔注射等体积生理盐水,1次/天,直到相应时点。假手术组手术过程除不注入自体血外,其余条件同ICH组完全一致。
1.5 血肿周围脑组织水分含量测定 采用干湿法测定含水量。达相应时点处死动物,迅速开颅取血肿周围组织 2块(约1 mm3),用万分之一克精度电子天平(德国Sartorius公司生产BP221s)称重,然后置于电热恒温烤箱,恒温105℃24 h烤至恒重,后置于干燥密闭容器内使其降至室温。按Elliott公式计算脑组织含水量:含水量=(湿重-干重)/湿重×100%。
1.6 标本采集 达相应时点处死动物,开颅取出脑组织,甲醛固定,石蜡包埋,切片。行改良三色染色法染色[6]。
1.7 统计学处理 采用SPSS 13.0统计软件处理。计量资料以均数±标准差(±s)表示。
2 结 果
2.1 3组神经功能障碍评分 3组大鼠在入选时神经行为评分均小于 1分(P>0.05)。按Bederson分级评定,术后各时间点治疗组神经功能评分均较ICH对照组低(P<0.05),而较假手术组明显高(P<0.05)。详见表1。
表1 各组在不同时间点的神经功能障碍评分(±s)分
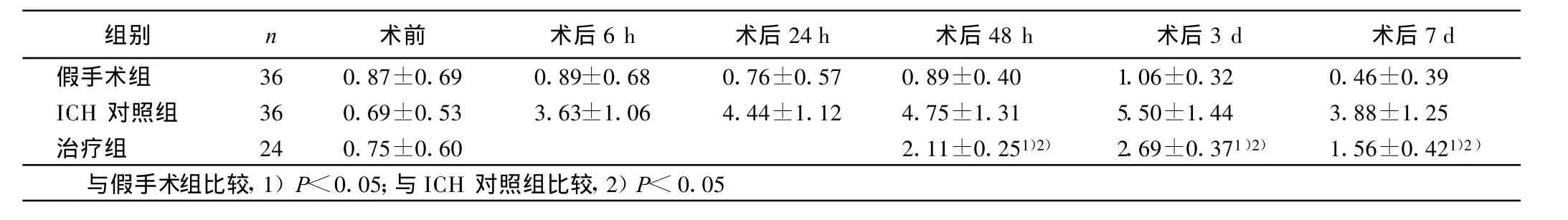
表1 各组在不同时间点的神经功能障碍评分(±s)分
组别 n 术前 术后6 h 术后24 h 术后48 h 术后3 d 术后7 d假手术组 36 0.87±0.69 0.89±0.68 0.76±0.57 0.89±0.40 1.06±0.32 0.46±0.39 ICH 对照组 36 0.69±0.53 3.63±1.06 4.44±1.12 4.75±1.31 5.50±1.44 3.88±1.25治疗组 24 0.75±0.60 2.11±0.251)2) 2.69±0.371)2) 1.56±0.421)2)与假手术组比较,1)P<0.05;与ICH对照组比较,2)P<0.05
2.2 3组血肿周围脑组织含水量变化 治疗组血肿周围含水量较ICH对照组降低(P<0.05),而较假手术组明显升高(P<0.05)。详见表2。
表2 各组不同时间点脑组织含水量(±s)%
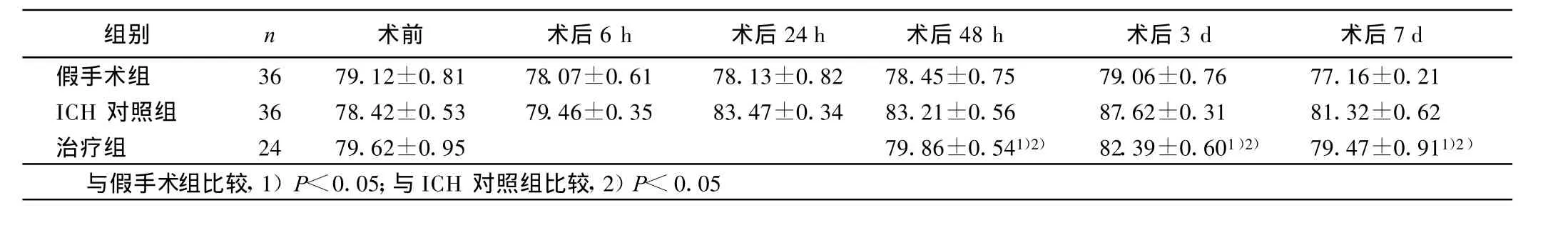
表2 各组不同时间点脑组织含水量(±s)%
组别 n 术前 术后6 h 术后24 h 术后48 h 术后3 d 术后7 d假手术组 36 79.12±0.81 78.07±0.61 78.13±0.82 78.45±0.75 79.06±0.76 77.16±0.21 ICH 对照组 36 78.42±0.53 79.46±0.35 83.47±0.34 83.21±0.56 87.62±0.31 81.32±0.62治疗组 24 79.62±0.95 79.86±0.541)2) 82.39±0.601)2) 79.47±0.911)2)与假手术组比较,1)P<0.05;与ICH对照组比较,2)P<0.05
2.3 病理改变 神经轴突呈绿色或蓝绿色;神经髓鞘呈枣红色或紫红色;神经元的细胞浆呈蓝绿色;细胞核呈紫蓝色;红细胞呈鲜红色;血管的内弹力膜呈绿色;胶原纤维呈绿色。改良三色法显示脑出血组6 h轴突有不规则增粗、断端膨大呈球形、部分髓鞘与轴突之间的间隙增宽,脑出血3 d轴突不规则增粗、出现收缩球、髓鞘明显弯曲、不完全地附着在轴突表面,甚至剥脱。脑出血7 d时病理变化不及3 d时明显。而治疗组48 h、3 d、7 d轴突增粗及髓鞘脱失均有明显改善。
3 讨 论
脑出血后血肿周围也存在一个“半暗带”,即组织损伤和水肿形成进行性加重的区域。首先血肿及其脑水肿的压迫对脑组织造成机械性损害,随后由于血肿本身演变,释放凝血酶,胆红素,Fe2+等毒性物质对周围组织产生毒害作用,以及血脑屏障破坏进一步加重脑水肿,均可对缺血高度敏感和形态结构特殊的髓鞘和神经纤维造成损害,从而引起和加重神经功能障碍[7,8],因此脑水肿的产生和发展是导致患者神经功能恶化甚至死亡的主要原因。本研究结果显示,术后各时间点治疗组神经功能评分及脑组织周围含水量均较ICH对照组低,而较假手术组明显高。病理结果显示治疗组轴突增粗及髓鞘脱失均较脑出血组有明显改善,提示法舒地尔的应用能够减轻脑出血后神经纤维的损伤,改善神经功能,可能有一定的脑保护作用。
改良三色染色法目前是胶原纤维的主要染色方法之一[9],在神经纤维的染色中应用很少。本实验采用此方法对脑出血后血肿周围脑组织进行染色,观察其结果能够同时明确地显示出轴突和髓鞘的病理变化情况,并且可见到嗜银染色所显示的神经轴突的病理改变,如轴突不规则增粗、断端膨大、出现收缩球等。而且此方法染色时间短,结果显示清晰、不易脱片。这表明改良三色法优于嗜银染色[10]。说明此染色方法在神经纤维中值得应用及进一步研究。
[1]Bito H,Furuyashiki T,Ishihara H,et al.A critical role for a vhoassociated kinase,P160 ROCK,in determining ax on outgrowth in mammalian CNS neurons[J].Neuron,2000,26:431-441.
[2]Shinichi S,Tatsuma U,Kazuyuki T,et al.Phannaeo-logieal profile of hydroxyl fasudil as a selective rho kinase inhibitor on ischemic brain damage[J].Life Seiences,2001,69:1441-1453.
[3]Breitenlechner C,Gassel M,Hidaka H,et al.Protein kinase A in complex with Rho-klnase inhibitors Y-27632,Fasudil,and H-1152P:Structural basis of selectivity[J].Structure(Camb),2003,11(12):1595-1607.
[4]Satoh S,Toshima Y,Ilegaki I,et al.Wide therapeutic time windows for fasudil neurop rotection against ischemia-induced delayed neuronal death in gerbils[J].Brain Res,2007,1128(1):175-180.
[5]Bederson JB,Pitts LH,Tiles M,et al.Rat middle cerebral artery occlusion:Evaluation of the model and development of a neurologic ex amination[J].Stroke,1986,17:472.
[6]邓平,宋一璇,祝家镇.改良三色法显示石蜡切片中的神经轴突及神经髓鞘[J].中华病理学杂志,1998,27(3):235.
[7]Neumann H.Molecular mechanisms of axonal damage in inflammatory central nervous system diseases[J].Curr Opin Neurol,2003,16:267-273.
[8]Qing WG,Dong YQ,Ping T Q,et al.Brain edema after intracerebral hemorrhage in rats:The role of iron overload and aquaporin[J].Neurosurg,2009,110(3):462-468.
[9]陈敬文,钟端阳,张伟.介绍一种改良的M asson氏三色染色法[J].中国组织化学与细胞化学杂志,2010,19(2):209-210.
[10]邓平,祝家镇,宋一璇.脑干损伤后神经元及轴突改变的组织化学观察[J].法医学杂志,2001,17(1):10-11.

