Egb761对大鼠肺缺血再灌注损伤的保护作用
崔晓鹏,秦太昌,刘 斌
肺缺血/再灌注(ischemia/reperfusion,I/R)是指缺血器官、组织经血液再灌注后缺血性损伤进一步加重的病理生理现象,损伤常见于心肺联合移植、肺动脉袖状切除、体外循环等手术,是患者发生肺动脉高压、肺水肿及呼吸衰竭的最主要原因,直接关系到患者生命维护及其生活质量。本文旨在阐述缺血/再灌注机制,以探讨其防治措施。
1 材料与方法
1.1 动物与分组 雄性Wistar大鼠(山西医科大学动物中心提供)30只,体重250 g~350 g。随机分为 3组,每组 10只,分别为假手术组(S组)、肺缺血/再灌注组(I/R组)和银杏叶提取物+缺血/再灌注组(EGb+I/R组)。各组间大鼠的体重及鼠龄无统计学意义。
1.2 施加干预 银杏叶提取物+缺血/再灌注组(Egb761+I/R组),银杏叶提取物(Egb761)于术前3 d开始腹腔注射30 mg/(kg◦d)。假手术组(S组)及缺血/再灌注组(I/R组)于相同时间点给以等量生理盐水腹腔内注射。
1.3 动物模型制作 参照Eppinger等[1]大鼠肺I/R模型加以改进,将Wistar大鼠以20%水合氯醛 300 mg/kg~350 mg/kg腹腔注射麻醉后,仰卧位固定,行颈部正中切口,分离出气管、右侧颈静脉和颈动脉,气管切开、插管,接动物呼吸机行机械通气(吸入室内空气,呼吸频率40/min,潮气量10mL/kg~15 mL/kg),右侧颈静脉插管、固定,接微量注射泵;然后经左侧第5肋间开胸,游离左肺门,静脉注射肝素100U。静息5min后,于呼气末用套线阻断左主支气管、左肺动脉和左肺静脉。30 min后开放,进行再灌注2 h。实验结束后,从颈动脉快速抽取动物血,并切取左肺标本。
1.4 观察指标与方法 超氧化物歧化酶(SOD)试剂盒由南京建成公司提供(批号:14004),按说明书进行检测。肺超微结构,左下肺采用2.5%戊二醛固定,磷酸盐缓冲液(PBS)洗涤3次,1%锇酸后固定,梯度丙酮脱水,包埋切片,醋酸铀-枸橼酸铅复染,应用透射电子显微镜观察超微结构。肺湿/干重比,部分肺组织生理盐水充分漂洗,滤纸吸干,称重为湿重,70℃、24 h烘干称重为干重,两者之比为肺湿重/干重比[13]。
2 结 果
2.1 3组大鼠湿/干重、SOD结果(见表1)
表1 3组肺湿重/干重及SOD比较(±s)
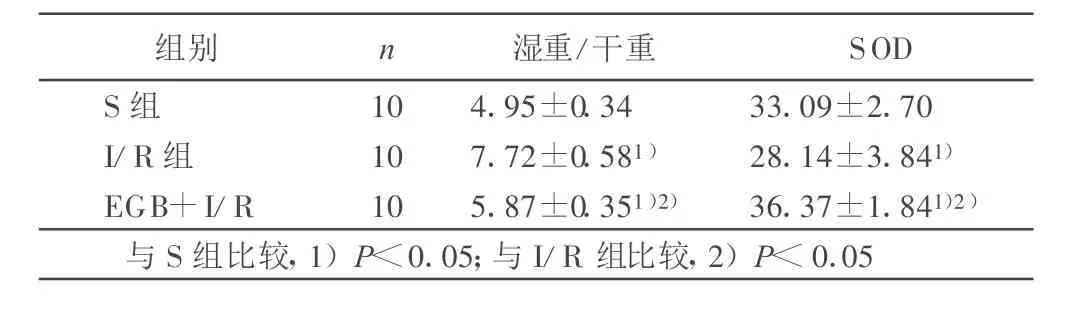
表1 3组肺湿重/干重及SOD比较(±s)
组别 n 湿重/干重 SOD S组 10 4.95±0.34 33.09±2.70 I/R组 10 7.72±0.581) 28.14±3.841)EGB+I/R 10 5.87±0.351)2) 36.37±1.841)2)与S组比较,1)P<0.05;与I/R组比较,2)P<0.05
2.2 电镜观察 I/R组肺泡Ⅰ型细胞呈扁平,染色质凝集,胞浆空泡化,Ⅱ型细胞线粒体肿胀明显。线粒体嵴减少,胞浆空泡化明显,板层小体稀少,肺泡隔明显肿胀,血管内皮细胞肿胀。Egb761+I/R组肺泡Ⅰ、Ⅱ型细胞结构基本正常,线粒体嵴较清楚,微绒毛比较完整,板层小体结构比较完整。
3 讨 论
银杏叶提取物(Exacrttof Ginkgo Bilbo.Egb761)是从银杏树叶中分离纯化的化合物,是目前国际上应用最广泛的植物制剂之一。银杏叶提取物中有效生物活性成分为银杏黄酮苷和银杏萜内酯,研究中发现这两类物质的药理作用不尽相同。银杏黄酮苷具有提高SOD活性和抗氧化作用,是强效氧自由基清除剂,可改善微循环及保护ATP酶。银杏萜内酯具有极强的抗血小板激活因子(PAF)作用[2,3]。同时,两类物质的药理作用相互交叉、相互协同。氧自由基和血小板活化因子都是缺血再灌注损伤中的重要致伤因素。氧自由基可以通过攻击生物膜中多聚不饱和脂肪酸,形成一系列脂质过氧化物及其降解产物丙二醛(MDA)等。MDA上升能引起蛋白质交联变性、DNA断裂,破坏肺组织结构[4]。同时Egb761对氧自由基有很强的清除作用,可俘获氧自由基,使 O2+和OH-失活[5]。
国内外的大量研究表明,Egb761对心[6]、脑[7]、肾[8]、肝、肠[9]等多种脏器的缺血/再灌注有良好的保护作用,也是临床上较为常用的肺保存液。本实验结果显示,Egb761可明显降低肺缺血30 min再灌注2 h后肺湿重/干重比,说明 Egb761对肺缺血/再灌注损伤有保护作用。
肺泡壁结构(毛细血管内皮细胞和肺泡上皮细胞)的完整性是保障肺脏正常气体交换的基础,其结构和功能的异常,将直接影响呼吸系统疾病的病理生理过程。本研究显示肺血管内皮细胞及上皮细胞的破坏、间质性肺水肿的形成是肺缺血/再灌注后急性肺损伤的病理基础。减少内皮细胞和上皮细胞的破坏、降低血管的通透性是预防急性肺损伤的重要环节之一。
肺缺血/再灌注组 SOD活性显著降低,应用 Egb761后SOD活性显著升高。
银杏叶提取物能减轻肺缺血/再灌注损伤和稳定SOD的活性,其机制可能与SOD活性有关。
[1]Eppinger MJ,Deeb GM,Bolling SF,et al.Mediators of ischemiareperfusion injury of rat lung[J].Am J Pathol,1997,150(5):1773-1784.
[2]Kudolo GB,Dorsey S,Blodgett J.Effect of the ingestion of Ginkgo biloba extract on platelet aggregation and urinary prostanoid excretion in healthy and ty pe 2 diabetic subjects[J].Thromb Res,2002,108(2-3):151-160.
[3]Rioufol G,Pietri S,Culcasi M,et al.Ginkgo biloba extract EGb 761 attenuates myocardial stunning in the pig heart[J].Basic Res Cardiol,2003,98(1):59-68.
[4]Ayenel IS,Dodia C,Pearse S,et al.Role of oxygen in oxidation of lipid and protein during ischemia/reperfusion in isolated rat lung[J].Arch Biochem Biophys,1992,296:183-189.
[5]Zhang RZ,Yang Q,Yim AP,et al.Alteration of cellular electrophy siologic properties in porcine pulmonary microcir culation after preservation with University of Wisconsin and Euro-Collins solutions[J].Ann Tho rac Surg,2004,77(6):1944-1950.
[6]Shen J,Wang J,Zhoa B,et al.Eeffets of EGb761 on nitric oxide and oxygen free ardieals,myoeardial damage and arrhythmia in ischemia reperfusion injury in vivo[J].Biochiem Biophys Acta,1998,1406:228-236.
[7]Hu B,Sun SG,Mei YW.Protective effect of Ginkgo Biloba Ex trat on cerebral ischemia/reperfusion injuryin in rats[J].Chin J Integr T radi Western Med,2003,23:436-440.
[8]Sener G,Sener E,Sehirli O,et al.Ginkg o biloba ex tract ameliorates ischemia reperfusion-induced renal injury in rats[J].Pharm Res,2005,52:216-222.
[9]Onen A,Deveei E,Inaloz SS,et al.Histopathological assessment of the prophylactic effect of ginkgo biloba exartct on intestinal ischemia-reperfusion injury[J].Aeta Gastroenterol Belg,1999,62(4):386-389.

