3-巯基丙酸自组装金电极的制备及其对尿酸的电化学
宋宏图,舒 好,汪召豪,万其进
(武汉工程大学绿色化工过程教育部重点实验室,湖北省新型反应器与绿色化学工艺重点实验室,湖北 武汉 430074)
0 引 言
化学修饰电极是在传统电化学电极基础上发展起来的新研究方向,它是电化学和电分析化学的前沿研究领域[1].常规电化学电极材料简单、结构单一、复合效应差[2-4],应用上局限性极大.因此,近20年来化学修饰电极成为国际上电化学和分析化学家研究的热点[5-6].化学修饰电极归根结底是一种传感器,是通过化学修饰的方法在电极表面进行分子设计,将具有优良化学性质的分子、离子、聚合物固定在电极表面,造成某种微结构,赋予电极某种特定的化学和电化学性质,实现底物的表面电催化和电化学改性[7-9],并广泛地应用于生物科学、环境科学、分析测试和能源等领域,在提高选择性和灵敏度方面具有独特的优越性[10-13];同时,通过对化学修饰电极的表征,进一步揭示物质的电荷传递规律和电极反应动力学[14]的本质,丰富和发展了表面电化学和溶液电化学的基本理论和方法[15-17].
尿酸(UA)又称为2,6,8-三氧嘌呤,是嘌呤的代谢最终产物,其中的嘌呤环没有解开,其结构如图1所示.
正常情况下,人体内的尿酸大约有1 200 mg,每天新生成约600 mg,同时排泄600 mg,处于平衡状态.但如果体内产生过多来不及排泄或者尿酸排泄机制退化,则体内尿酸潴留过多,当血液尿酸质量浓度大于7毫克/毫升,使人体体液变酸,影响人体细胞的正常功能,长期置之不理将会引发痛风.随着人们饮食结构的改变,特别是富含蛋白质和嘌呤食物摄入的增加,人群中尿酸水平逐年上升.事实上,近年来研究发现,血尿酸还与肾损害密切相关,并与老龄、高血压、糖尿病等危险因素一起使肾功能损害的患病率逐年增加.因此对其测定方法的研究在生理功能和临床应用方面都具有重要的实际意义[18].近年,测定尿酸的方法主要有酶法、伏安法、磷钨酸还原法、毛细管电泳法、液相色谱法、同位素稀释质谱法和电化学法[19-21].

图1 尿酸的结构图
20世纪30年代酶试剂用于临床生化指标测定,20世纪70年代得到了较大发展.临床上常用的检测尿酸的方法为单酶法,其基本原理是通过单一酶促反应后利用各种方法测定底物或者产物的浓度来求待测物含量.该反应利用磷酸盐作为缓冲体系,在一定温度下反应一定时间,观察吸光度值,通过计算可以得到尿酸的浓度值.此方法虽然操作简单,但操作过程太复杂[22-23].
伏安法是较常用的检测尿酸的方法,近年来伏安法检测尿酸在理论研究和实际运用于临床诊断上都取得了很大的发展.伏安法检测尿酸常用的方法有以下两种:一种是微电极示差脉冲伏安法.该方法是在电极表面修饰一层化学物质分子,赋予电极特定的性质,能有效地降低某些氧化还原物质的过电位,从而达到分离或同时测定的目的.微电极示差脉冲伏安法常用的是聚甘氨酸修饰碳纤维微电极示差脉冲伏安法,利用碳纤维微电极(CFME)经过特定的电化学方法活化,活化后的CFME表面修饰一层聚甘氨酸膜,该膜电极对尿酸有近可逆的响应.该方法测定结果较为准确,可望用于在线检测,但应用不是十分广泛.另外一种方法是吸附溶出伏安法.此法灵敏度高,有一定选择性,是测定尿酸的新方法.该法抗干扰能力较强,操作简便,样品处理简单,易于推广.上述系列方法中,很多内源物质、外源物质或者仪器本身对测量产生干扰.后来人们研究发展利用高效液相色谱测定血清中的尿酸.
Siekmann[24]将[1,3-15N2]尿酸标记物加入血清样品中,室温下充分混合30 min,离子交换色谱进行净化,用乙酸将尿酸洗提出来,80 ℃氮气吹干,将残留物用甲基氨溶解,再次吹干.用N-甲基-N-三甲基硅烷基三氟乙酰胺进行三甲基硅烷化衍生,最后用气相色谱/质谱联用技术进行检测.并根据同位素稀释法的原理计算血清中尿酸的含量.Ellerbe[25]等也研究采用[1,3-15N2]尿酸同位素标记物作为内标,利用GC-ID/MS方法测定血清中的尿酸.在血清中加入[1,3-15N2]尿酸同位素标记物,轻轻搅拌均匀,室温下静置一个晚上,充分平衡.平衡后的混合物经阴离子交换色谱柱净化,然后用乙酸洗提,所得尿酸溶液在60 ℃下用N-甲基-N-三甲硅烷基三氟乙酰胺进行衍生化反应.然后用GC-MS分析.在GC-ID/MS分析中,需要采用样品预处理手段,包括净化、离子交换、衍生化等等.因此样品的前处理过程比较复杂、费时且成本较高.
Zhirl[26]等人采用反相液相色谱测定血清中的尿酸.Sakuma[27]等人讨论了不同的样品前处理方法对测定血清中尿酸含量的影响.SeKi[28]等人采用柱切换技术检测血清中的尿酸.他们运用了6种不同的柱子连接后对样品进行分离和定值.此方法的样品前处理很简单,只需将血清稀释和过滤,但是需要使用复杂的柱切换设备.Grune[29]等人用高效毛细管电泳法同时检测了系列嘌呤碱和核酸.Xu[30]等人采用毛细管区带电泳对血清中的尿酸进行定性和定量.
于秀娟等[31]研究了细胞色素C在VB1自组装膜修饰金电极上的电化学反应,有关化学修饰电极测定DA的方法已有报道[32-34].
本研究是利用电化学方法,通过寻找合适的修饰剂来制作电化学修饰电极.并以此为基础,建立价格低廉、方便快捷、灵敏度高、线性范围宽的测定UA的新型传感器.
1 实验部分
1.1 仪器与试剂
CHI760B电化学工作站(上海辰华仪器公司);三电极系统:金圆盘电极(Φ=2 mm)或修饰电极为工作电极,铂丝电极为辅助电极,饱和甘汞电极(SCE)为参比电极;KQ250型超声波清洗器(昆山市超声仪器有限公司);Super NW超纯水系统(Heal Force Development Co.,Ltd).
3-巯基丙酸(MPA),尿酸(UA)(Aladdin Chemistry Co.,Ltd);磷酸氢二钠-柠檬酸缓冲液(pH=6.0),利用Na2HPO4(0.2 mol/L)和柠檬酸(0.1 mol/L)配制而成;高纯氮气(武钢气体公司);其它试剂均为分析纯,实验用水为超纯水,溶液在使用之前均通N2除氧;实验在室温下进行.
2 结果与讨论
2.1 MPA/Au电极的制备
将金电极(Au)于金相砂纸上磨光,用0.05 μmAl2O3粉末抛光成镜面,依次在无水乙醇和二次水中超声清洗各5 min,干燥备用.
将打磨好的金电极在0.5 mol/L的H2SO4中进行循环伏安,以清洗电极表面上的杂质,活化电极.然后浸泡在5 mmol/L的MPA溶液中进行自组装24 h.
2.2 MPA/Au电极的表征
2.2.1 MPA/Au电极在铁氰化钾溶液中的电化学行为 图2为相同的条件下裸金电极(a)、MPA/Au电极(b)在0.005 mol/L的Fe(CN)63-/4-+0.1 mol/L KCl溶液中的循环伏安图.比较图中曲线(a)和曲线(b)可知,当MPA自组装到Au电极表面后,其在[Fe(CN)6]3-/4-溶液中的氧化还原峰电流减小,峰电位差加大,可逆性变差,这是由于MPA成功自组装到电极表面后在一定程度上阻碍电子在金电极表面的传递.

图2 在0.005 mol/L [Fe(CN)6]3-/4-+0.1 mol/L KCl中的循环伏安图
注:(a)裸金电极,(b)3-巯基丙酸自组装金电极;扫速100 mV/s.
2.2.2 MPA/Au电极的交流阻抗图谱 交流阻抗法通过控制电化学系统的电流在小幅度的条件下随时间按照正弦规律变化,直接或者间接的测量系统的电势变化或者交流阻抗,进而分析电化学系统的反应机理、计算系统的相关参数.结果如图3所示,其中a和b分别代表裸金电极和MPA/Au电极在0.005 mol/L Fe(CN)63-/4-+0.1 mol/L KCl的溶液中的交流阻抗叠加图.在含有探针分子[Fe(CN)6]4-/3-的情况下,复平面阻抗谱上的高频部分是受动力学控制的区域,低频部分是受扩散控制的区域.曲线a(裸电极)和b(修饰电极),可以看到较之裸金电极而言,MPA/Au修饰电极在高频部分出现一个直径较大的圆弧,表明在高频区修饰电极的电阻相对裸电极的电阻要大.这可以说明MPA修饰剂中含有一个—COOH,该基团带负电荷,阻碍电子在裸金电极表面的传递,这与不同电极在铁氰化钾中的循环伏安图实验结果相符合,进一步表明MPA成功组装到金电极表面.

图3 分别为(a)裸金电极,(b)MPA/Au电极在0.005 mol/LFe(CN)63-/4+0.1 mol/L KCl溶液中的交流阻抗图
2.2.3 MPA/Au在铁氰化钾溶液中峰电流与扫速的关系 本实验研究了在MPA/Au电极在在0.005 mol/L [Fe(CN)6]3-/4-+0.1 mol/L KCl溶液中的不同扫速对[Fe(CN)6]3-/4-氧化峰电流的影响.图4是峰电流从小到大对应的扫速,依次为20,40,60,80,100,120,140,160,180,200 mV/s.由图5可知,在0.02~0.20 V/s的扫速范围内,[Fe(CN)6]3-/4-在MPA/Au电极上氧化峰电流与扫速的平方根成线性关系.经分析其线性回归方程为ip(μA)=2.693 6+3.365 3 v1/2(结果的单位为mV·s-1),R=0.998 7.上式表明[Fe(CN)6]3-/4-在该电极上的氧化过程是受扩散控制的.对于受扩散控制过程的可逆氧化还原反应的峰电流,可由Randles-Savcik方程表示(25 ℃时):
ip=2.69×105n3/2AD1/2v1/2c
式中ip为峰电流,单位为安培(A);n为电子转移数,A为电极的有效表面积,单位为cm2;D为反应物的扩散系数,单位为cm2/s;v为扫描速度,V/s;c为反应物的浓度,mol/L.
由上式可知峰电流ip与v1/2应该成直线关系,在一定条件下,如果已知反应物的扩散系数D,就可计算出电极的有效表面积A.在本实验中扩散系数D可取6.7×10-6cm2/s,c为5×10-3mol/L,经计算修饰电极的有效表面积为1.97×10-2cm2,而裸金电极的理论表面积为3.14×10-2cm2,比较可知金电极自组装后有效表面积减小到为原来的62.6%,这是由于巯基虽然在电极表面形成一层致密的膜,修饰电极的有效总表面积仍然是减小的.
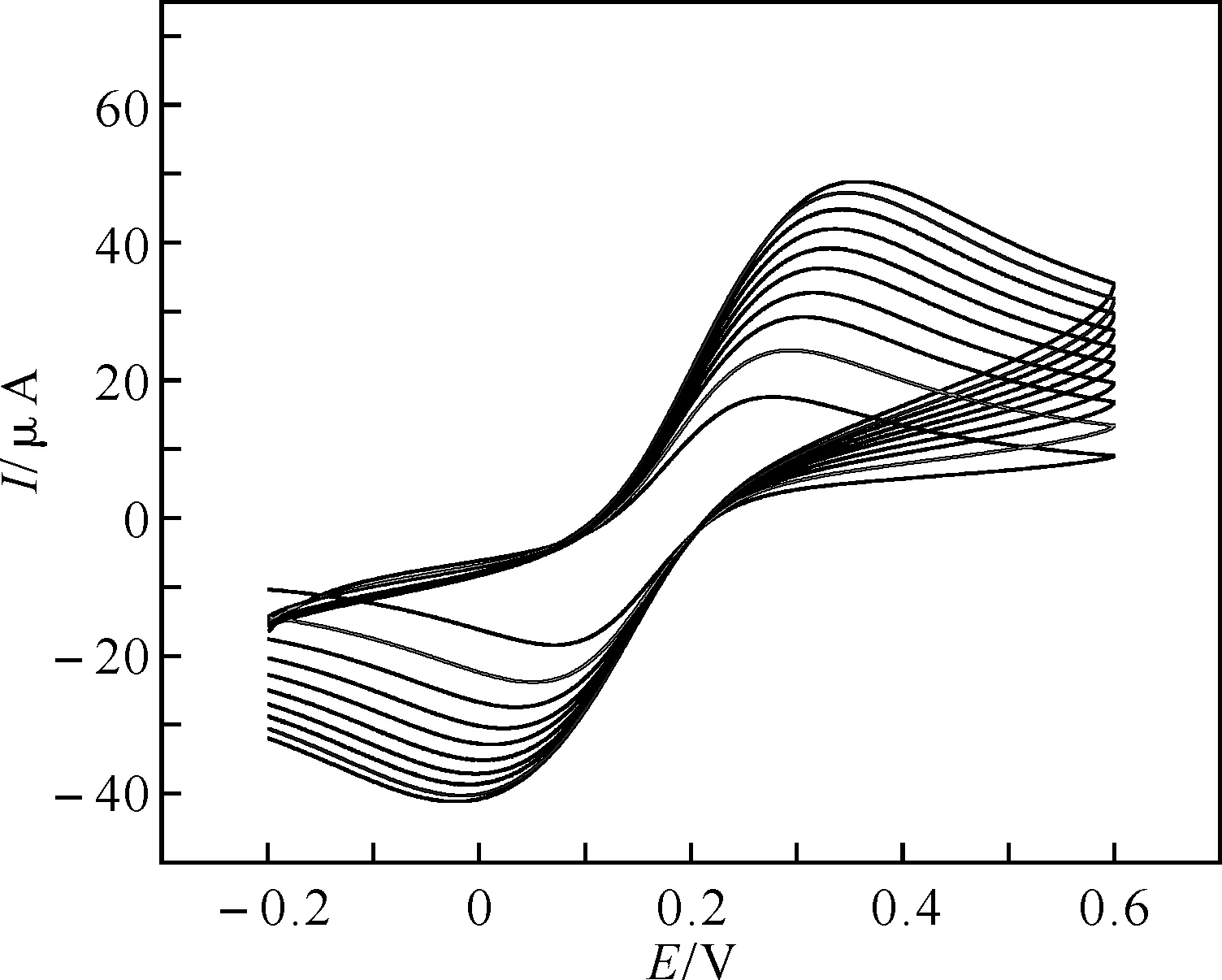
图4 MPA/Au电极在0.005 mol/L [Fe(CN)6]3-/4-+0.1 mol/L KCl溶液中的循环伏安图
注:扫速分别为:20,40,60,80,100,120,140,160,180,200 mV/s.
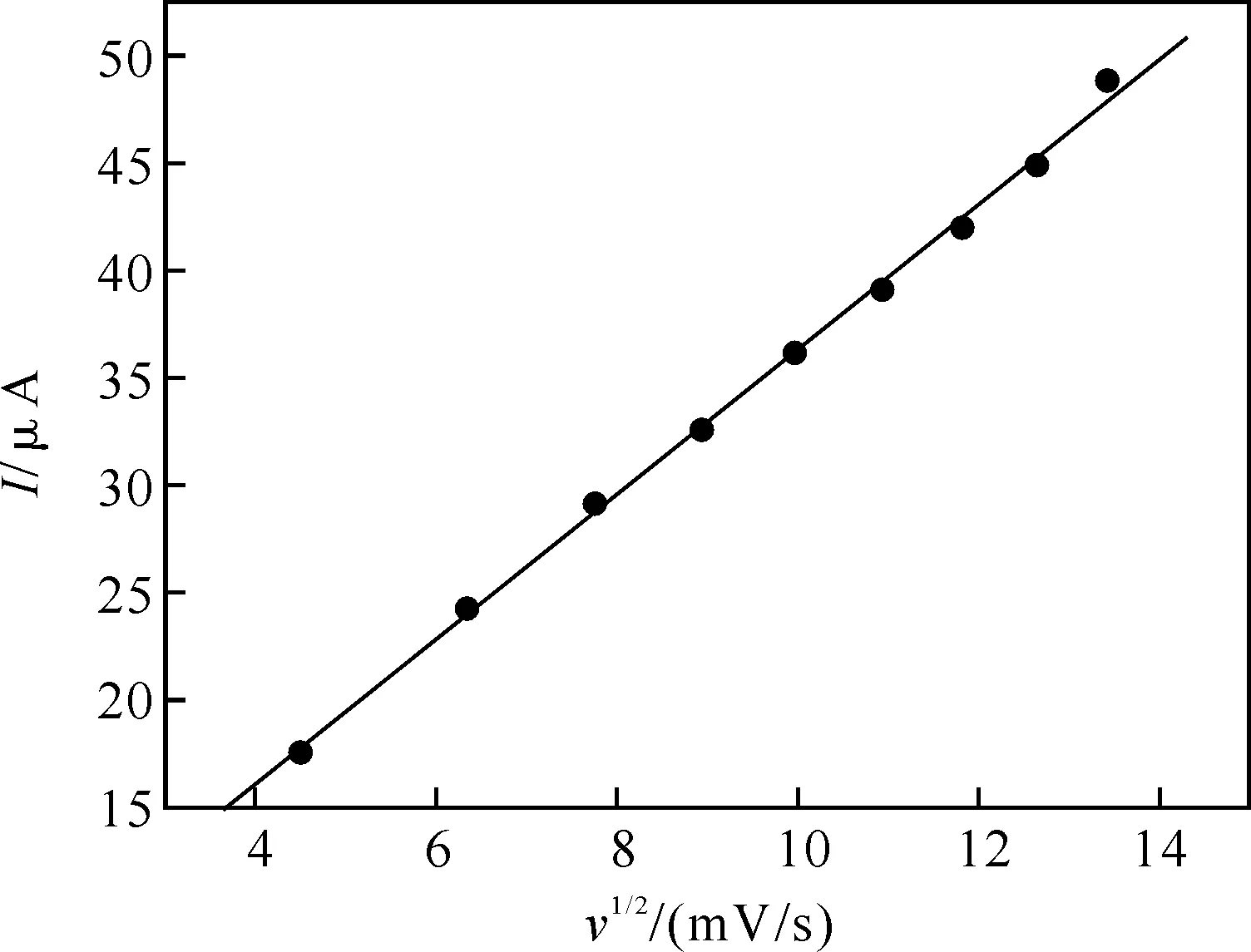
图5 MPA/Au电极在0.005 mol/L [Fe(CN)6]3-/4-+0.1 mol/L KCl溶液中扫速的平方根与峰电流的线性关系图
2.3 尿酸在MPA自组装膜修饰金电极上的电化学行为及其测定
2.3.1 不同电极对UA的电化学响应 图6为不同修饰电极在pH=6.0Na2HPO4-C6H8O7缓冲溶液中的循环伏安图:(a)MPA/Au电极对1×10-4mol/L UA的CV图,(b)裸电极对1×10-4mol/L UA的CV图,(c)裸电极在底液中的CV图,(d)MPA /Au电极在底液中的CV图.由曲线(b)可知UA在裸金电极上有一定的响应,呈现一氧化峰;MPA自组装到裸金电极表面后,如曲线(a),氧化峰电流明显增大,峰电位负移近200 mV,表明MPA组装上电极表面后,对UA有非常良好的电催化作用.由曲线(d)可知,MPA/Au电极对底液没有响应,对比曲线(a),可说明曲线(a)中的氧化峰为UA的氧化峰.

图6 不同电极在Na2HPO4-C6H8O7缓冲溶液(pH=6.0)中的循环伏安图
注:(a)MPA/Au电极在1×10-4mol/L UA中的CV图,(b)裸电极在1×10-4mol/L UA中的CV图,(c)裸电极在底液中的CV图,(d)MPA/Au电极在底液中的CV图.
2.3.2 底液的选择 在定量分析UA过程中,模拟生物体内环境使UA最大程度上保持生物活性,是保证测定结果正确性的必要条件,所以需要选择最佳分析底液.本实验中,在选用不同底液时,pH值均为5.8,控制其它实验条件不变,将底液分别选为NaH2PO4-Na2HPO4缓冲溶液(c),柠檬酸钠-柠檬酸缓冲液(d),Na2HPO4-C6H8O7缓冲液(a),NaAc-HAc缓冲液(b),然后测量UA标准溶液的CV图,作峰电流与不同底液的曲线图,如图7,显然在pH=5.8的Na2HPO4-C6H8O7缓冲液中,该修饰电极对UA的响应峰电流最大,所以最终试验选择Na2HPO4-C6H8O7缓冲液作为底液.

图7 不同底液中UA的峰电流与底液的CV图
2.3.3 最佳pH的选择 该实验中,以Na2HPO4-C6H8O7缓冲溶液为底液,在pH5.0~7.0范围内配制改变1×10-3mol/L UA溶液,研究修饰电极在扫速为100 mV/s时的电化学行为随pH值的变化情况.如图8所示,在pH5.0~6.0范围内,峰电流随着pH的升高迅速增大;当pH超过6.0后,随着pH的升高峰电流反而减小.故本实验选择测定底液的pH为6.0.
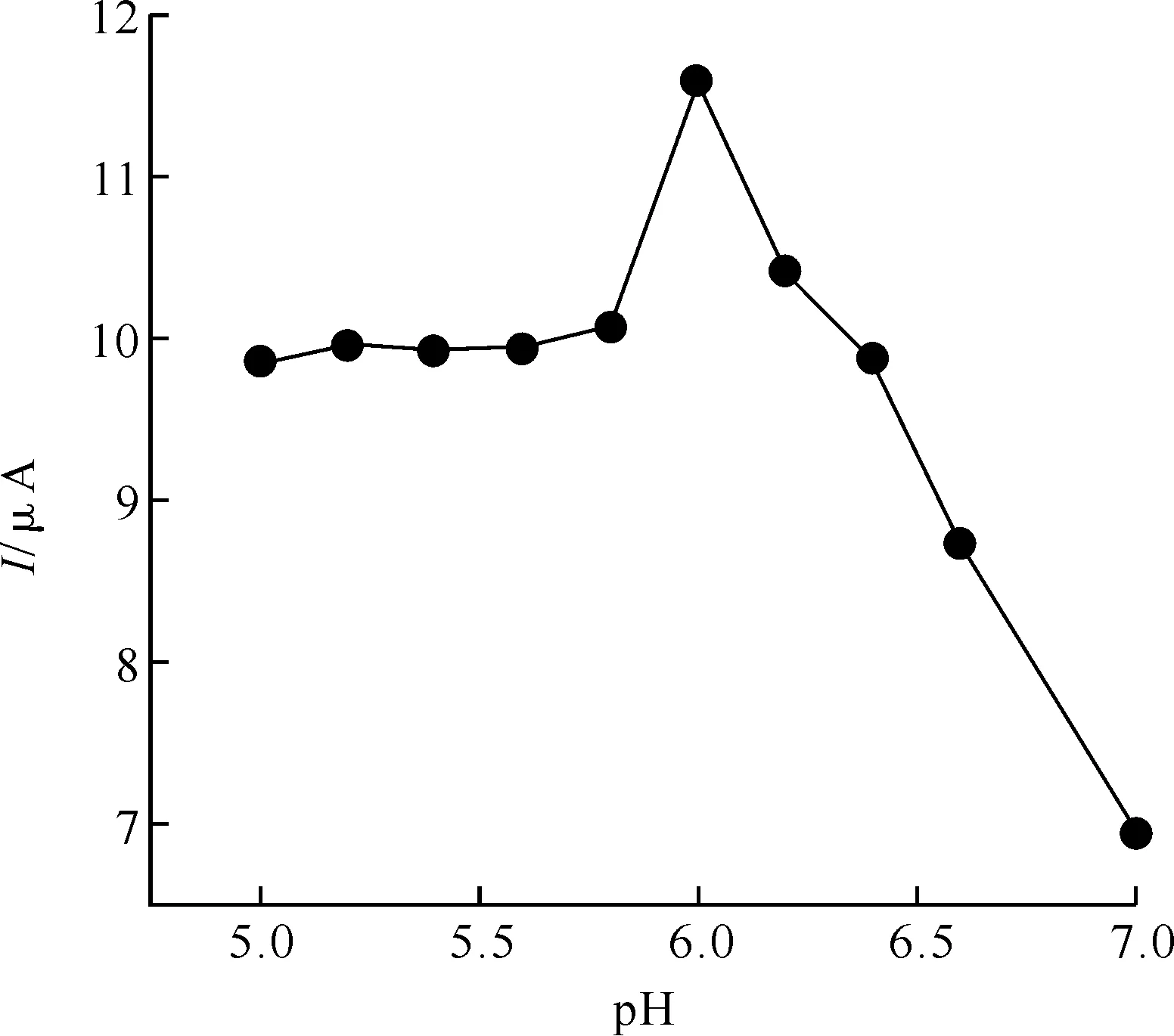
图8 不同pH(5.0~7.0)中1×10-3 mol/L UA的峰电流与pH的折线图
2.3.4 自组装时间的选择 MPA分子几乎呈平面长链型,而且具有一个-SH,所以在自组装过程中MPA很容易组装到金电极的表面,快速地占据裸金电极表面的空白位点,形成一层致密的自组装膜,在一定程度上会影响电子在电极表面的传递过程,从而影响电极的电化学性能.所以在试验中有必要探讨最佳MPA(8 mmol/L)自组装时间,使电极达到最佳电化学性质.控制其它试验条件不变,调整MPA自组装时间分别为1 h(a)、2 h(b)、3 h(c)、6 h(d)、12 h(e)、18 h(f)、24 h(h)、30 h(g),测量该电极在1×10-3mol/L UA标准溶液中的CV图,如图9可知,24 h是最佳自组装时间.
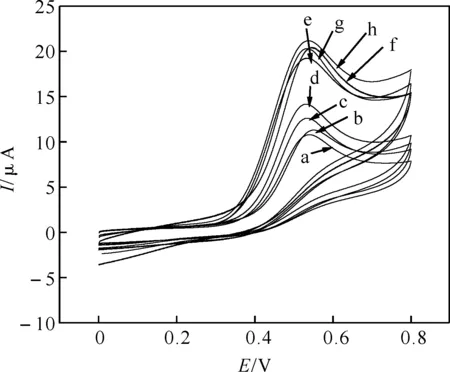
图9 修饰电极在MPA(8 mmol/L)溶液中不同组装时间对UA的CV图
注:1 h(a)、2 h(b)、3 h(c)、6 h(d)、12 h(e)、18 h(f)、24 h(h)、30 h(g).
2.3.5 标准曲线的绘制 如图10,在pH=6.0的Na2HPO4-C6H8O7缓冲溶液中,利用示差脉冲技术测量浓度在1.6×10-4~1×10-6mol/L范围内UA标准溶液的电化学响应,电位扫描范围0.0~0.8 V,扫速为100 mV/s.由图10可知,UA响应峰电流随着浓度的增大而呈线性增加,峰电位基本保持不变.
如图11,是UA氧化峰电流与UA浓度的线性关系曲线,线性方程为ip(μA)=0.738 9+0.040 46 c0/(μmol/L),相关系数R=0.998 6,检测限为5×10-7mol/L,这一结论说明MPA/Au电极在浓度范围为1.6×10-4~1×10-6mol/L内具有良好的线性关系,可以将其应用于实际UA试样溶液的浓度定量分析.
2.3.6 MPA/Au修饰电极的稳定性和重现性 在本实验中,使用MPA/Au电极平行测定1.2×10-4mol/L的UA溶液20次,如图12所示,从第二次之后峰电流基本稳定,由此可以说明体系的重现性良好.然后,对比新制备的MPA/Au电极,用在二次蒸馏水中放置一周后的电极测定同一浓度的UA溶液,其峰电流无明显变化,表明MPA/Au电极具有较长的使用寿命和良好的稳定性,可以用于UA的分析测定.
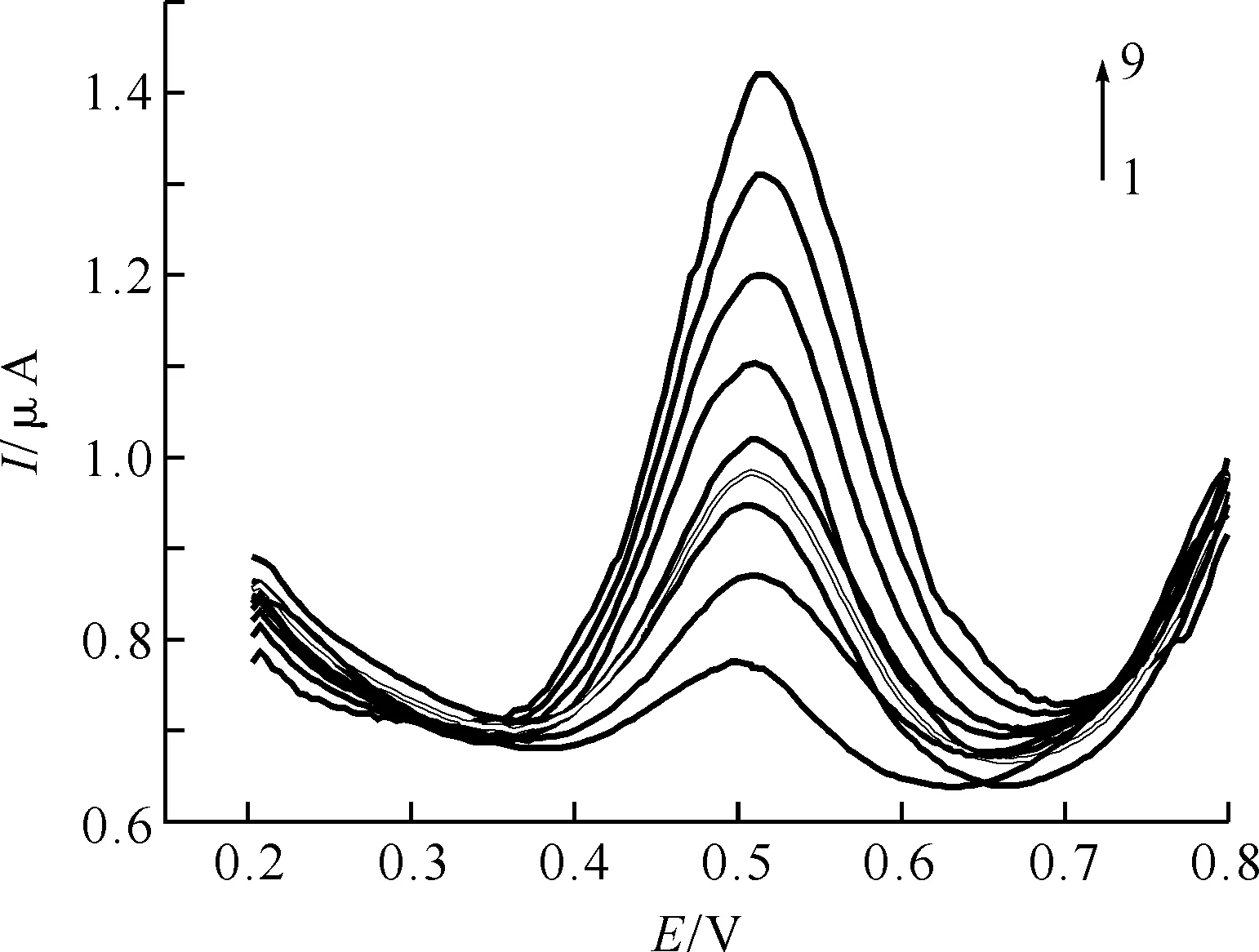
图10 MPA/Au电极在底液为pH=6.0的Na2HPO4-C6H8O7缓冲溶液的UA溶液中的示差脉冲曲线图
注:由上到下浓度分别为1.6×10-4,1.4×10-4,1.2×10-4,9×10-5,7×10-5,6×10-5,5×10-5,3×10-5,1×10-6mol/L;扫速100 mV/s;pH=6.0.

图11 峰电流与UA浓度的线性相关曲线
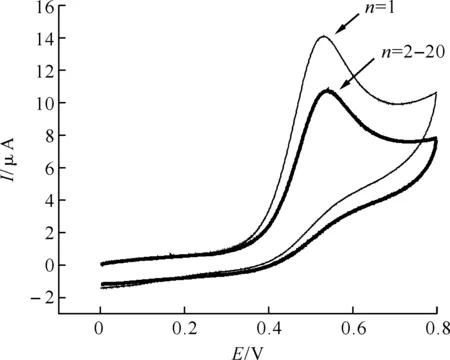
图12 MPA/Au修饰电极的稳定性
3 结 语
本研究以裸金电极为基体电极,以3-巯基丙酸为修饰剂,运用自组装的方法,制备3-巯基丙酸自组装修饰电极(MPA/Au).相比伏安法测定尿酸(检测限一般在1×10-7mol/L左右),MPA/Au电极能够更迅速,准确,简便地测量UA.
提高灵敏度和选择性一直是各种分析方法长期以来所追求的目标,可以利用不同修饰剂的混合自组装方法和电沉积纳米金方法来提高修饰电极的灵敏度和选择性.MPA/Au修饰电极作为一种新型的化学传感器,由于其特有的稳定性,高灵敏性以及巨大的潜在应用价值,一定会得到越来越多人的关注.
参考文献:
[1]董绍俊,车广礼,谢远武.化学修饰电极[M].北京:科学出版社,1995.
[2]刘有芹,颜芸,沈含熙.化学修饰电极的研究及其分析应用[J].分析化学,2006(4):7-9.
[3]Watkins B F,Behing J R,Kariv E.Self-assembling gold nanoparticles to three-dimensional sol-gel network[J].Chem Soc,1975,97:35-49.
[4]Moses P R,Wier L,Murray R W.Chiral recognition and chiral sensing using zinc porphyrin dimmers[J].Anal Chem,1975,47:1882.
[5]金利通,全威,徐金瑞,等.化学修饰电极[M].上海:华东师范大学出版社,1992:284-286.
[6]董绍俊.化学修饰电极在分析化学中的应用[J].分析化学,1988,16(10):951.
[7]金利通,方禹之.聚合物型修饰电极及其在分析化学中的应用[J].分析试验室,1989,8(1):225-229.
[8]Gerisher H Z.Porphyrin assemblies as chemical sensors[J].Electrochem,1955,59:604.
[9]Lane R F,Hubbrad A T.Porphyrins and phthalicyanines as materials for optical limiting[J].Phys Chem,1973,77:1401.
[10]Fleischmann M,Oliver A.Heavy metal ions detection in solution in sol-gel and with grafted porphyrin monolayers[J].Elctrochem Acta,1986,31:899.
[11]姜灵彦,传银,丽萍,等.纳米材料修饰电极及其在电分析化学中的应用[J].化学研究与应用,2004,16(5):615-618.
[12]Jia J B,Wang B Q,Wu A,et al.A method to construct a third-generation horseradish peroxidase biosensor[J].Anal Chem,2002,74:2217-2223.
[13]Patolsky F,Gabriel T,Willer I.Determination of serum uric acid by isotope dilution mass spectro-metry as a new candidate definitive method[J].Electroanal Chem,1999,479:69.
[14]Jiang L P,Xu S,Zhu J M.Advances in nano silver with various morphologies[J].Inorg Chem,2004,43:5877.
[15]贾铮,戴长松,陈玲.电化学测量方法[M].北京:化学工业出版社,2006.
[16]约瑟夫·王,朱永春.分析电化学[M].北京:化学工业出版社,2008.
[17]万其进,王秀文.聚合物/多壁碳纳米管修饰电极的电化学行为及其分析应用[D].武汉:武汉工程大学化工与制药学院,2008.
[18]Cui Quan Yong.Correlation between acute myocardial infarction,cerebral infarction and serum uric acid[J].Journal of Bengbu Medical College,2004(2):178-179.
[19]Fei Jin Song,Ji Hong,Chen Fan Yuan.Clinical study on the association of serum uric acid and serum bilirubin with carotid atherosclerosis in aged patients with hypertension[J].Modern Medicine Health,2004,14:1322-1323.
[20]Li XL,Wu J,Shen G L.Chemopreventive and chemotherapeutic effects of intravesical silibinin against bladder cancer by acting on mitochondria[J].Chemo-sensor,2006,26(2):43-47.
[21]曾涵,龚兰新,魏莉英.尿酸在聚6-甲基香豆素修饰的玻碳电极上的电化学行为[J].天然产物研究与开发,2010,22:24-28.
[22]林海谅.多发性硬化的临床分析及血清尿酸与多发性硬化关系的探讨[D].福建:福建医科大学第一临床医学院,2004.
[23]彭翠华,彭建宏.快速消除溶血干扰检测血尿酸的方法[J].湖南医学高等专科学校学报,1999,1(3):19-21.
[24]Siekmann L.Determination of uric acid in human serum by isotope dilution-mass spectromer -tu[J].Clin Chem Clin Biochem,1985,23:129-135.
[25]Polly Ellerbe,Alex Cohen.Determination of serum uric acid by isotope dilution mass spectrome-try as a new candidate definitive method[J].Anal Chem,1990,62:2173-2177.
[26]Azzedine Zhirl.Simultaneous determination of uric acid and creatinine in plasma by reversed-phase liquid chromatography[J].Clin Chem,1985,31(1):109-112.
[27]Ryozo Sakuma,Toshihiro Nishina.Deproteinizing methods evaluated for determination of uric acid in serum by reversed-phase liquid chromatography with ultraviolet detection[J].Clin Chem,1987,33(8):1427-1430.
[28]T Seki,Y Orita.Determination of Uric acid in Serum and Its Development[J].Pharm Biomed Anal,1997,15:1621-1626.
[29]T Grune,G Ross.Optimized Separation of purine bases and nucleosides in human cord plasma by capillary zone electrophoresis[J].Anal Chem,1993,636(1):105-111.
[30]K Xu,L Hua.Determination of epitestosterone in human urine by off-line immunoaffinity solid-phase extraction coupled with high performance liquid chromatography[J].Chromatogr B,1997,694(2):461-466.
[31]Yu Xiu Juan,Qu Xiao Gang,Lu Tian Hong.Preliminary transgenic research on the ren-2 gene[J].Chinese Anal,1994,22(1):1111-1114.
[32]Lin L Q,Chen J H,Yao H.Electrocatalytic properties of dopamine and uric acid at vitamin B1 self-assembled monolayer gold electrode[J].Bioelectrochemistry,2008, 73(1):11-17.
[33]Zare H R,Rajabzadeh N,Ardakani Mazloum M.Electrocatalytic properties of dopamine and uric acid at vitamin B1 self-assembled monolayer gold electrode[J].Electroanal Chem,2006,589(1):60-69.
[34]Lin Xiang Qin,Kang Guang Feng,Chai Ying.Electrochemical behavior and determination of dopamine at ZnO nanorods intercalated graphite modified electrode[J].Chinese Anal Chem,2008,36(2):157-161.

