三种杀菌剂对黄瓜内生细菌群落多样性的影响
方素云, 王振中
(华南农业大学植物病理生理学研究室,广州 510642)
植物内生菌是一个多样性十分丰富的微生物类群,分布于健康植物组织内,并与寄主植物协同进化[1]。其生长代谢受多方面因素制约,不仅受到寄主植物的影响,外界环境因子(如季节温度变化、光照、雨水、空气湿度)也是其重要影响因素[2-3]。外界环境变化影响植物生长代谢,间接影响到内生菌生物多样性与生长代谢。还有一些化学物质并不影响植物的生长代谢,但却直接影响内生菌的数量和多样性,如一些人工合成的杀虫剂、杀菌剂等[4-5]。
末端限制性片段长度多态性技术(terminal restriction fragment length polymorphism,TRFLP),是建立在 PCR的基础上,通过分析微生物群落16S rRNA基因的限制性酶切片段(terminal restriction fragments,T-RFs)的多态性来反映微生物群落多样性及其定量关系的基因指纹技术,不需要微生物的分离、纯培养,因而避免了培养方法的弊端,相对于其他分子生物学技术,它具有分辨率高、易于实现自动化及互联网海量数据库共享等优势。1997年以来的大量研究实践表明,T-RFLP技术是分析复杂微生物群落的最强有力的工具之一[6-9]。
杀菌剂在现代化农业发展过程中发挥了重要作用,但大量施用对植物的内生微生物的影响是非常直接的。Babich等[10]提出,一种化学污染物对某一生态系统中微生物的影响,可以间接反映出该种化学品对此生态系统的影响。Seghers等[5]研究结果表明农用化学品不仅会对土壤微生物群落产生影响,而且还会对根内生菌群落产生影响。利用生物化学与分子生物学技术来进行农药污染物的环境风险评价正在被广泛应用[11-12]。农用链霉素、苯醚甲环唑、代森锌是生产上常用的杀菌剂,在植物病害防治方面发挥了重要的作用。但是,其应用后对植物内生细菌影响的研究在国内外鲜有报道。
本试验利用T-RFLP技术,研究3种杀菌剂处理黄瓜后对其根、茎、叶的内生细菌群落多样性的影响。以此了解杀菌剂使用后对植物内生细菌生态系统平衡的可能性影响,为杀菌剂进一步合理安全使用提供理论依据,具有较大的理论与实践意义,为评价杀菌剂施用后对植物内生细菌资源的影响提供基础数据。
1 材料与方法
1.1 试验材料
供试植物:黄瓜(CucuMis sativus Linn.)品种为‘华优一号’(华南农业大学科技实业发展总公司)。
供试药剂:农用链霉素72%可溶性粉剂(青岛恒瑞高科技农化有限公司),苯醚甲环唑10%水分散粒剂(先正达投资有限公司),代森锌65%可湿性粉剂(青岛海澳生化有限公司)。
1.2 试验设计
盆栽黄瓜,6片真叶时,用杀菌剂药液喷雾处理,处理1为72%农用链霉素可溶性粉剂,喷施浓度为150mg/L。处理2为10%苯醚甲环唑水分散粒剂2 500倍液,处理3为65%代森锌可湿性粉剂1 200倍液,对照为不施药处理,喷洒清水,分别于施药后 0、1 、3 、5、7、14、21 d 采集不同处理的根 、茎、叶样本,放入-70℃冰箱备用。每组处理设3个重复。
1.3 黄瓜线粒体和叶绿体的排除
用非荧光标记的引物8 f,518 r扩增黄瓜根部基因组 DNA,扩增产物用试剂盒(TIANGEN)纯化,然后连接到PMD19-T载体(TaKaRa)上,再转化到DH5α感受态细胞中,通过蓝白斑筛选阳性克隆,并用RV-M和MB-47作为引物的菌落PCR的方法检查插入片段的大小,如果片段大小为700 bp左右(扩增片段除了包含530 bp左右的16S rDNA序列,还包括两端载体上的序列共156 bp),则鉴定为阳性克隆。将插入正确片段的阳性克隆菌液进行测序(华大基因科技股份有限公司),以插入正确片段的阳性克隆为模板,再用荧光引物8 f和518 r进行PCR反应,对PCR反应产物进行酶切电泳分析和T-RFLP测序(上海基康生物技术有限公司)。
1.4 T-RFLP分析
1.4.1 DNA提取
用无菌水彻底清洗黄瓜的根茎叶表面,然后依次用70%乙醇浸泡30 s,2.6%次氯酸钠浸泡3min,无菌水冲洗5次,无菌滤纸吸取多余水分。将最后一次清洗的水少量涂布于NA平板,以检查表面灭菌的效果。采用改进的CTAB法分别提取黄瓜根茎叶基因组DNA[13],置于-20℃冰箱保存备用。
1.4.2 细菌16S rDNA片段的PCR扩增和纯化
将提取的基因组DNA作为聚合酶链式反应(PCR)的模板,采用通用引物扩增细菌16S rDNA。
正向 引物 为 8 f:5′-AGAGTTTGATCCTGGCTCAG-3′;
反向引物为 518 r:5′-A TTACCGCGGCTGCTGG-3′[14]。
其中正向引物 5′端用6-羧基二乙酸荧光素(FAM)标记。引物由上海基康生物技术有限公司合成并标记。
PCR反应体系总体积为50μL,内含Taq DNA聚合酶缓冲液5μL,MgCl2 2.5 mmol/L,dNTPs(each)0.25 mmo l/L,正向和反向引物各0.4μMol/L,模板40 ng,Taq DNA聚合酶(TaKaRa)5 U。反应程序为:95℃预变性5 min,95℃变性45 s,52℃复性45 s,72℃延伸1.5 min,35个循环,72℃最终延伸10 min。扩增的PCR产物用PCR纯化试剂盒(TIANGEN)纯化,方法按说明进行。
1.4.3 酶切分析
纯化后的PCR产物用内切酶 HeaⅢ消化,20μL中反应体系包含10×MBuffer 2μL。DNA 200 ng,HeaⅢ1μL,加入灭菌双蒸水至20μL,37℃消化6 h,然后65℃温育20min将酶灭活。酶切产物的T-RFLP分析由上海基康生物技术有限公司完成。
1.5 数据分析
利用Peak Scanner Software v1.0软件将测序结果与DNA片段长度标准进行对比,从而确定每个T-RF的长度和丰度,有效 T-RFs片段数目可以用来确定样品中微生物种群数,每个 T-RFs所对应峰的面积反映了该种群的丰度,而每个不同长度TRFs的峰面积在所有 T-RFs的峰面积总和中的比例可以反映这个片段在酶切片产物中的相对丰度即优势度,从而间接反映出这个片段所代表的物种在微生物群落中的相对丰度[15-16]。最后使用基于互联网的微生物群落分析工具Phy logenetic Assignment Tool以确定与其相匹配的微生物种类。微生物多样性指数采用 Shannon-Weiner指数(H)法计算[17],其计算公式为:H=-∑Pi ln P i,其中 Pi表示每个峰面积占总面积的比率。
2 结果与分析
2.1 黄瓜线粒体和叶绿体的排除
由于植物叶绿体16S rDNA和线粒体18S rDNA与细菌的16S rDNA高度同源,因此在以非培养方法研究植物内生细菌的种群结构时,要排除植物叶绿体16S rDNA和线粒体18S rDNA的干扰是非常重要的。本文采用克隆的方法,得到黄瓜叶绿体DNA和线粒体DNA的阳性克隆,通过测序得到叶绿体16S rDNA和线粒体18S rDNA的T-RF片段大小分别为295 bp和189 bp(图1)。这两个片段在T-RFLP的分析中将被排除。
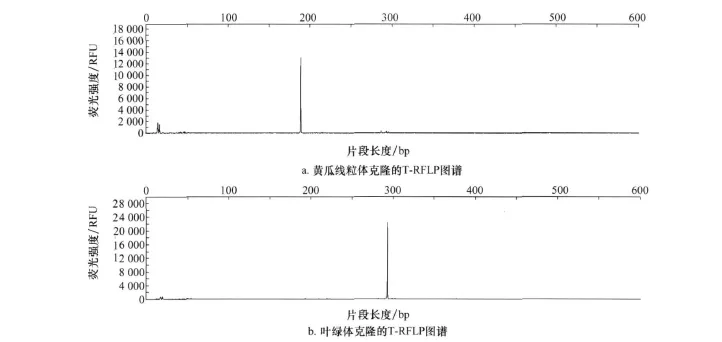
图1 黄瓜线粒体和叶绿体克隆的T-RFLP图谱
2.2 T-RFLP分析
2.2.1 黄瓜叶、茎、根不同时间内生细菌的 H值变化情况
经3种不同杀菌剂处理后,黄瓜叶片中不同时间内生细菌的H值变化如图2。结果表明,经3种杀菌剂处理后的样品 H值明显低于对照,总体趋势为先降后升。代森锌处理1 d后,H值较空白对照变化最大,减少了43.7%,农用链霉素,苯醚甲环唑处理5 d后,样品的 H值较空白对照分别减少69.4%、36.6%。随着时间的延长,3种杀菌剂处理14 d后黄瓜内生细菌的 H值逐渐恢复到处理前的水平,种群结构趋于稳定。
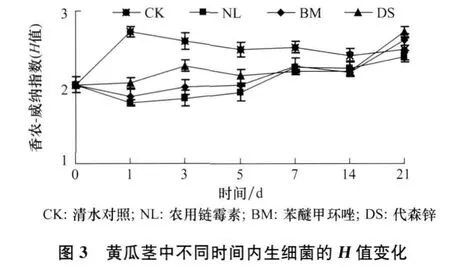
经3种不同杀菌剂处理后,黄瓜茎中不同时间内生细菌的H值变化如图3。结果表明,在黄瓜茎中的 H值变化比较平稳,较之于对照,处理后的样品的H值也是整体降低的。处理1 d后,农用链霉素,苯醚甲环唑和代森锌处理的样品的H值较空白对照变化率达到最大,分别减少了34.2%、31.3%、24.7%。随着时间的延长,3种杀菌剂处理14 d后黄瓜内生细菌的 H值逐渐恢复到处理前的水平,种群结构趋于稳定。

经3种不同杀菌剂处理后,黄瓜根中不同时间内生细菌的H值变化如图4。结果表明,黄瓜根部处理样品的H值变化比较特殊,与对照相比呈现上升趋势,并且在3 d,农用链霉素、苯醚甲环唑和代森锌处理样品的 H值较空白对照变化率达到最大,分别增加了57.5%、53.8%、38.6%。随着时间的延长,3种杀菌剂处理14 d后黄瓜内生细菌的H值逐渐恢复到处理前的水平,种群结构趋于稳定。

图4 黄瓜根部不同时间内生细菌的H值变化
2.2.2 3种杀菌剂处理黄瓜叶、茎、根后,内生细菌T-RFs片段优势度变化情况
根据Shannon-Weiner指数分析得到3种杀菌剂处理黄瓜叶片第5天时,H值较空白对照变化最大,在此仅对第5天黄瓜叶片内生细菌T-RFs片段优势度进行分析。
经3种杀菌剂处理第5天,黄瓜叶片内生细菌T-RFs片段的优势度变化情况如图5。与对照样品相比,经杀菌剂处理后各T-RFs片段优势度都呈下降趋势。其中,长度为 151 、203、243、326 bp 片段所属的细菌在经农用链霉素处理后的样品里已经消失,193 bp片段所属的细菌在经苯醚甲环唑处理后的样品里已经消失,305 bp片段所属的细菌在经代森锌处理后的样品里已经消失,表明这些片段所属的微生物分别对这3种农药比较敏感。另外,对照样品的主要片段是283 bp,优势度达到了27.2%,叶片中的内生细菌主要集中在这个片段所代表的微生物中。
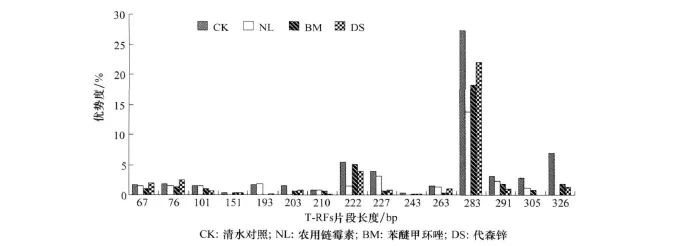
图5 3种杀菌剂处理后第5天黄瓜叶片内生细菌T-RFs片段优势度变化情况
Phy logenetic Assignment Tool比对结果如表1,与283 bp相匹配的细菌大都为拟杆菌门(Bacteroidetes)。326 bp相匹配的细菌为厚壁菌门(Firmicutes)。可见拟杆菌门和厚壁菌门类群的细菌在黄瓜叶片内较为丰富。与193 bp相匹配的细菌大多属于慢生根瘤菌科(Bradyrhizobiaceae)和交替单胞菌科(A lteromonadales),可见苯醚甲环唑对α-和γ-变形细菌的影响较大。与305 bp相匹配的细菌有梭菌属(C lostrid ium),真杆菌属(Eubacterium),蒂希耶尔菌属(Tissierella),说明代森锌对厚壁菌门的影响很大。在这3种杀菌剂中农用链霉素对于黄瓜内生细菌的影响最大,有多个 T-RFs片段都消失,这些片段代表的细菌种类很多,可知厚壁菌门,β-和δ-变形细菌对农用链霉素比较敏感。
经3种杀菌剂处理黄瓜茎部第1天,H值较空白对照变化最大,此时的黄瓜茎内生细菌T-RFs片段的相对丰度变化情况如图6。结果表明,经3种杀菌剂处理后各T-RFs片段优势度也都呈下降趋势,但并没有出现了T-RFs片段的消失,3种杀菌剂对黄瓜茎的影响相对于叶片较小。另外,对照样品的主要片段是222,283,326 bp,相对丰度分别达到了14.8%,17.9%,14.7%,片段222 bp相对丰度明显高于叶片,其所属的细菌种群(表1)主要为β-变形细菌,α-变形细菌和厚壁菌门。可见在黄瓜茎部这3类的细菌比在叶片丰富。

表1 Phylogenetic Assignment Tool比对结果

图6 3种杀菌剂处理第1天黄瓜茎内生细菌T-RFs片段优势度变化情况
经3种杀菌剂处理黄瓜根部第3天,H值较空白对照变化最大,黄瓜根内生细菌T-RFs片段的相对丰度变化情况如图7。结果表明,黄瓜根部的内生细菌在3种杀菌剂处理后各个T-RFs片段所属的细菌相对丰度都出现了不同程度的增加,这与在叶片和茎部的内生细菌的变化情况有很大的不同。另外,对照样品的主要片段是222 bp和283 bp,相对丰度分别为20%和19%。所属的细菌类群(表1)有拟杆菌门,β-变形细菌,厚壁菌门,α-变形细菌。可知在黄瓜根部的优势种群主要是这三大细菌类群。
3 结论与讨论
农用链霉素、苯醚甲环唑、代森锌为防治蔬菜病害的常用杀菌剂,这3种杀菌剂处理后均使黄瓜叶、茎中内生细菌的多样性指数减少。而在黄瓜根部,3种杀菌剂处理的内生细菌多样性指数却有所升高,这说明了不同处理的杀菌剂虽然改变了内生细菌群落结构多样性,但是多样性并不简单地因污染而降低。其原因可能是与根际土壤的微生物种群之间存在复杂的相互关系(如偏利、协同、共生、偏害、竞争等)有关,也可能是一定程度的杀菌剂能改变土壤微生物与黄瓜根部内生菌群落原有群落内部的种群之间的竞争关系,导致黄瓜内生菌中其他微生物如真菌或放线菌的种群有所降低,从而使黄瓜根部内生细菌群落多样性增加。3种杀菌剂相比,农用链霉素对内生细菌的影响最大,代森锌最小,这可能与3种杀菌剂的特性不同有关,农用链霉素和苯醚甲环 唑是内吸性杀菌剂,而代森锌是保护性杀菌剂。

图7 3种杀菌剂处理第3天黄瓜根内生细菌T-RFs片段优势度变化情况
由于不同长度的T-RFs片段必然代表不同的微生物,而且相同长度的T-RFs片段代表至少一种微生物的存在(长度相同,碱基序列不一定相同),所以这些末段标记的片段可以用来反映微生物菌落组成情况[18]。T-RFLP分析结果表明拟杆菌门,厚壁菌门,α-和β-变形细菌为黄瓜根茎叶中的优势种群。Ueda等[19]分析水稻根中的固氮细菌多样性,结果表明水稻根中变形细菌为优势种群。Sessitsch等[14]对马铃薯内生细菌进行了分析,序列分析表明内生细菌属于 α-、β-、γ-变形细菌及厚壁菌门。可见变形菌门和厚壁菌门中的一些细菌为多种植物中的优势内生细菌。3种杀菌剂处理后对黄瓜叶片中内生细菌的影响最大,出现了6个T-RFs片段的消失,这些片段所代表的细菌类群大都为变形菌门,和厚壁菌门。说明变形菌门和厚壁菌门的细菌类群对杀菌剂比较敏感,最容易受到杀菌剂的影响,也说明了杀菌剂对植物叶片的作用最为直接。
3种杀菌剂处理黄瓜根茎叶1~5 d的种群变化达到最大,14 d后黄瓜内生细菌的多样性指数趋于稳定,逐渐恢复到处理前的水平。原因很多,首先,内生细菌长期生活在植物体细胞内或细胞间隙这样一个特殊环境中,与寄主植物协同进化,并形成了互利共生的关系。内生菌能够增强寄主植物对生物胁迫和非生物胁迫的抗逆性,其自身合成的抗生素、激素、酶抑制剂、诱导物等多种活性物质或通过诱导物胁迫寄主植物合成萜类,生物碱,皂苷,黄酮,酚类和多炔类等次生代谢物能对杀菌剂有一定的降解作用。另外,黄瓜中内生细菌种类繁多,有些内生细菌对杀菌剂不敏感,甚至还有些内生细菌可能把其作为营养物质加以利用。所以,反过来内生细菌也能降解黄瓜中残留的杀菌剂,即起解毒作用,从而使短期内黄瓜内生细菌生态能恢复平衡。但对于经常连续使用高浓度杀菌剂的菜地,杀菌剂在土壤中是否有富集、富集的浓度及其对植物内生菌的影响还有待进一步研究。
[1]Stone JK,Bacon C W,W hite JF Jr.An overview of endophyticMicrobes:endophy tisMdefined[M].New York:Mareel Dekker,2000:3-29.
[2]Mocali S,Bertelli E,DiCellof,et al.Fluctuation of bacteria isolated fromelMtissues during differen t seasonsand fromdifferent plan t organs[J].Research in Microbiology,2003,154(2):105-114.
[3]Dan ti R,Sieber T N,SanguinetiG,et al.Decline in diversity and abundance of endophytic fungi in twigs of Fagus sy lvatica L.after experiMental long-terMexposu re to sodiuMdodecylbenzene sulphonate(SDBS)aerosol[J].EnvironMen tal Microbiology,2002,4(11):696-702.
[4]张保国,唐玲,李祖明,等.阿维菌素杀虫剂对甘蓝叶际微生物群落结构的影响[J].环境科学,2009,30(5):1292-1297.
[5]Seghers D,Wittebolle L,Top E M,et al.Impact of ag ricultural practices on the Zea mays L.endophytic comMunity[J].Applied and EnvironMentalMicrobiology,2004,70:1475-1482.
[6]Lukow T,Dunfield P F,Liesack W.Use of the T-RFLP technique to assess spatial and teMporal changes in the bacterial comMunity structure with in an agricultural soil p lan ted with transgenic and non-transgenic potato plants[J].FEMS Microbiology Ecology,2000,32(3):241-247.
[7]Dunbar J,Ticknor L O,Kuske C R.Phylogenetic specificity and reproducibility and new method for analysis of terMinal restriction fragMen t profiles of 16S rRNA genes frombacterial comMunities[J].App lied and EnvironMen tal Microbiology,2001,67(1):190-197.
[8]Marsh T L.Terminal restriction fragment length polymorphism(TRFLP):An emergingmethod for characterizing diversity among hoMologous populations of aMplification p rodu cts[J].Cu rren t Opinion in Microbiology,1999,2(3):323-327.
[9]C lement BG,Keh l L E,DeBord K L,et al.TerMinal restriction fragment patterns(TRFPs),a rapid,PCR-based method for the comparison of complex bacterialcommunities[J].Journal of MicrobiologicalMethods,1998,31(3):135-142.
[10]Babich E,Stotzky G.Developing standard for environmental toxicants:the need to consider abiotic environMental factors and Microbe-Mediated ecologic processes[J].Environmental H ealth Perspectives,1983,49:247-260.
[11]段学军,闵航.镉胁迫下稻田土壤微生物基因多样性的DGGE分子指纹分析[J].环境科学,2004,25(5):122-126.
[12]Chinalia F A,KillhaMK S.2,4-Dichlorophenoxyacetic acid(2,4-D)biodegradation in river sediments of Northeast-Scotland and its effect on the microbial communities(PLFA and DGGE)[J].Chemosphere,2006,64:1675-1683.
[13]王珍,方宣钧.植物DNA分离[J].分子植物育种,2003,1(2):281-288.
[14]Sessitsch A,Reiter B,Pfeifer U,et al.Cu ltivation-independen t population analysis of bacterial endophytes in three potato varieties based on eubacterial and actinomycetes-specific PCR of 16S rRNA genes[J].FEMS Microbiology Ecology,2002,39:23-32.
[15]贾俊涛,宋林生,李筠.T-RFLP技术及其在微生物群落结构研究中的应用[J].海洋科学,2004,28(3):64-68.
[16]王洪媛,江晓路,管华诗.微生物生态学一种新研究方法TRFLP技术[J].微生物学通报,2004,31(6):90-94.
[17]余素林,吴晓磊,钱易.环境微生物群落分析的 T-RFLP技术及其优化措施[J].应用与环境生物学报,2006,12(6):861-868.
[18]宋福强.微生物生态学[M].北京:化学工业出版社,2008:7-21.
[19]Ueda T,Suga Y,Yahiro N,etal.Remarkab le N2-Fixing bacterial diversity detected in rice roots by molecular evolu tionary analy sis of ni fH gene sequences[J].Jou rnal of Bacteriology,1995,177(5):1414-1417.

