大肠杆菌热敏肠毒素B亚基的原核表达及生物学活性分析
王 会, 何孔旺,陆承平
(1.山东省枣庄市畜牧兽医局,枣庄277100;2.江苏省农科院兽医研究所,南京210014;3.南京农业大学,南京210095)
大肠杆菌热敏肠毒素(Escherichia coli heat-1abile enterotoxin,LT)是产肠毒性大肠杆菌(enterotoxigenic Escherichia col,ETEC)的 毒 力 因子之一,也是迄今为止已知的最强的黏膜免疫原和黏膜免疫佐剂,但LT强烈的致腹泻毒性限制了它的实际应用[1,2]。LT由1个A亚基(LTA)和5个B亚基(LTB)组成,LTA是其毒素活性中心,而LTB是其免疫原性中心,无毒性,并且单独的LTB亦具有免疫佐剂活性。本实验构建pET32a/LTB原核表达质粒,表达重组LTB蛋白,不仅可用于亚单位疫苗研制,还可以进行黏膜免疫佐剂的研究。
1 材料与方法
1.1 菌株与质粒 大肠杆菌K88(LT+,ST+)株,DH5α,BL21(code plus),原核表达质粒pET32a均由江苏省农业科学院兽医所保存。
1.2 主要试剂 引物由上海捷倍斯(Genebase)公司合成;HRP标记的羊抗兔IgG,DAB显色试剂盒购自武汉博士德生物工程有限公司;GM1,兔源抗CTB抗体为Sigma公司产品。
1.3 PCR及AT克隆 按照GenBank中大肠杆菌热敏肠毒素(LT)的基因序列,选用lt基因3'端抗原性较强的128个氨基酸,包括LTB全基因(ORF:864-1299,共436 bp),自行设计一对引物。煮沸法制备大肠杆菌模板,PCR扩增目的基因,预计扩增片段长度为454 bp。
P1:5'- CGCGAATTCATGAATAAAGTAAAATG-3' EcoRⅠ
P2:5'-AAGGTCGACTTAGTATAAGTACAGTA-3' Sal I
PCR产物经双酶切回收后定向克隆至pMD 18-T载体,转化DH5α感受态细胞,碱裂解法提取质粒后进行双酶切鉴定。阳性质粒命名为pMD18/LTB,并对其进行基因测序。
1.4 LTB的原核表达
1.4.1 重组表达质粒pET32a/LTB的构建对阳性克隆质粒pMD18/LTB进行双酶切,切下LTB目的基因与同样双酶切的表达载体pET32a连接,构建pET32a/LTB重组表达质粒,转化入大肠杆菌BL21(code plus)。同上抽提质粒并进行酶切鉴定。阳性质粒命名为pET/LTB,并进行测序。
1.4.2 重组菌的诱导 阳性的克隆菌37 ℃振荡培养过夜,次日以2%的比例接种于LB(含100 μg/mL氨苄)液体培养基中,37 ℃继续快速培养至 OD600=0.4~ 0.6,1 mmol/LIPTG、30 ℃诱导表达。超声波破碎菌体,分离上清和沉淀,SDS-PAGE电泳。
1.5 重组蛋白的western blot及其纯化、鉴定
1.5.1 western blot 对LTB融合蛋白采用12%分离胶、5%浓缩胶进行SDS-PAGE,将凝胶在Tris-Gly缓冲系统中,0.65 mA/cm2,90 min转印至NC膜上,5%脱脂乳封闭过夜,利用纯化的LT蛋白免疫兔制备的多抗为一抗(1:50),HRP标记的羊抗兔IgG为二抗(1:1000),DAB显色试剂盒显色。
1.5.2 融合蛋白的纯化 经SDS-PAGE鉴定,融合蛋白主要存在于包涵体中,将诱导至最佳时间的细菌培养物4 ℃,10 000×g离心10 min,弃上清,用含6 mol/L盐酸胍的1×Binding Buffer溶解包涵体;His·Bind Purification Kit纯化后透析复性。收集复性后的蛋白,-20 ℃保存备用。
1.5.3 LTB生物学活性的鉴定 利用GM1-酶联免疫吸附(ELISA)方法测定复性后的LTB与GM1的结合能力。
2 结果
2.1 LTB ORF氨基酸序列抗原性分析 由Antigenic Index 发现LTB蛋白具有较好的抗原性(图1)。

图1 DNAStar软件预测LTB蛋白抗原性Fig.1 The prediction of antigenity of LTB by DNAStar
2.2 目的基因PCR扩增及T-载体的克隆 PCR扩增的ltb基因片段为454 bp,与预期长度一致(如图2),将其连入pMD18-T载体后酶切鉴定结果为阳性(如图3)。
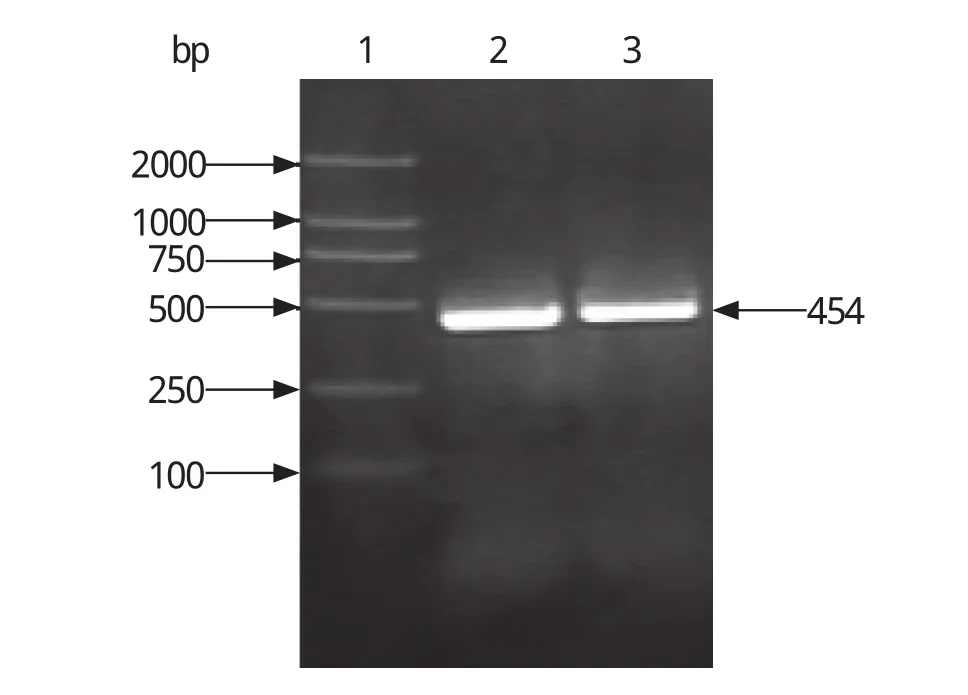
图2 ltb基因片段 PCR 产物Fig. 2 PCR products of ltb
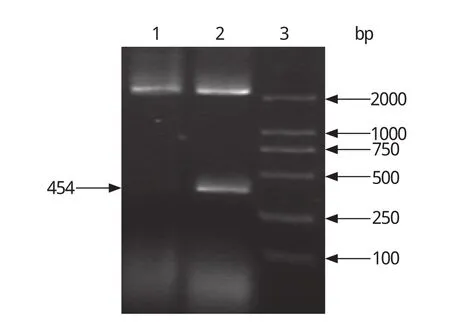
图3 pMD 18/LTB酶切产物Fig.3 Enzyme digestion of products of pMD 18/LTB
2.3 重组质粒pET32a/LTB的构建 双酶切pET32a/LTB重组表达质粒,琼脂糖凝胶电泳上可清晰的看到454 bp大小的目的条带,表明pET32a/LTB重组表达质粒构建成功(如图4)。

图4 重组质粒pET32a/LTB的酶切鉴定Fig.4 The result of RE analysis pET32a/LTB
2.4 目的基因的序列分析 将从大肠杆菌K88菌株中扩增出来的ltb基因片段的测序结果放在DNAStar中分析,与GenBank上公布的ltb序列(AB011677)相比较,二者同源性为98.7%(图5)。

图5 ltb基因片段测序结果Fig.5 Sequence of the target gene
2.5 重组质粒pET32a/LTB的诱导表达 SDSPAGE电泳结果表明诱导前的重组菌、pET32a和空BL21均没有34 kDa左右的条带出现,而含有目的基因的菌株在诱导后有明显的特异性条带出现,其分子量约为34 kDa左右(如图6)。使用Smartview分析软件分析表明,重组LTB的表达量占菌体总蛋白的10%左右。
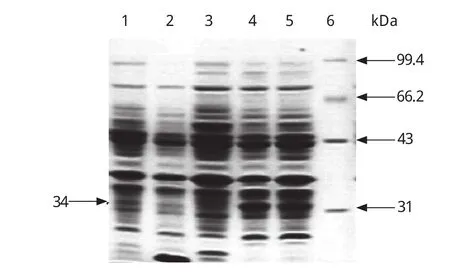
图6 载体、宿主菌与表达产物的SDS-PAGE对照分析Fig.6 SDS-PAGE patterns of pET32a vector, BL21 and expression product
2.6 表达蛋白存在状态的分析 离心收集诱导表达菌后,经过超声波裂解,分别取上清、沉淀进行SDS-PAGE电泳。结果显示,融合蛋白主要以包涵体形式存在于超声破菌后的沉淀中,上清中仅有少量(见图7)。

图7 SDS-PAGE检测破碎菌上清和沉淀Fig.7 SDS-PAGE electrophoresis of sediment and supernatant of ultrasonicated E.coli after expression
2.7 免疫转印 对表达蛋白进行Western blot鉴定,结果融合蛋白可于兔抗LT抗血清发生反应,说明表达蛋白具有抗原性(图8)

图8 融合蛋白免疫转印鉴定图Fig.8 Western blot analysis of fusion protein
2.8 LTB的纯化 经His·Bind Resin亲和层析纯化后,收集各部分洗脱液。进行SDS-PAGE鉴定。由图9可见蛋白纯度较高,而且分布比较集中。

图9 不同时间收集的纯化产物的SDS-PAGE分析Fig. 9 SDS-PAGE patterns of purified product in different time
2.9 生物学活性检测 LTB的免疫增强功能是因为其形成的五聚体具有与神经节昔脂GMl的结合能力,而在热变性条件下,可使五聚体解聚而丧失与GMl的结合能力[3]。因此,鉴定融合蛋白LTB/Trx A是否保留了与GMl结合能力是很必要的。GMl-ELISA分析表明,复性后的融合蛋白(rLTB)保留了部分与GMl结合活性,而同一浓度的样品在经过加热处理后(rLTB(B)),其与GMl结合能力几乎丧失,这是因为热处理使CTB/Trx A五聚体发生解聚。作为阳性对照,K88菌的培养上清中含有天然的LTB蛋白,与GM1具有高亲和力。而单纯的载体蛋白(Trx A)与GM1基本无结合能力(图 10)。
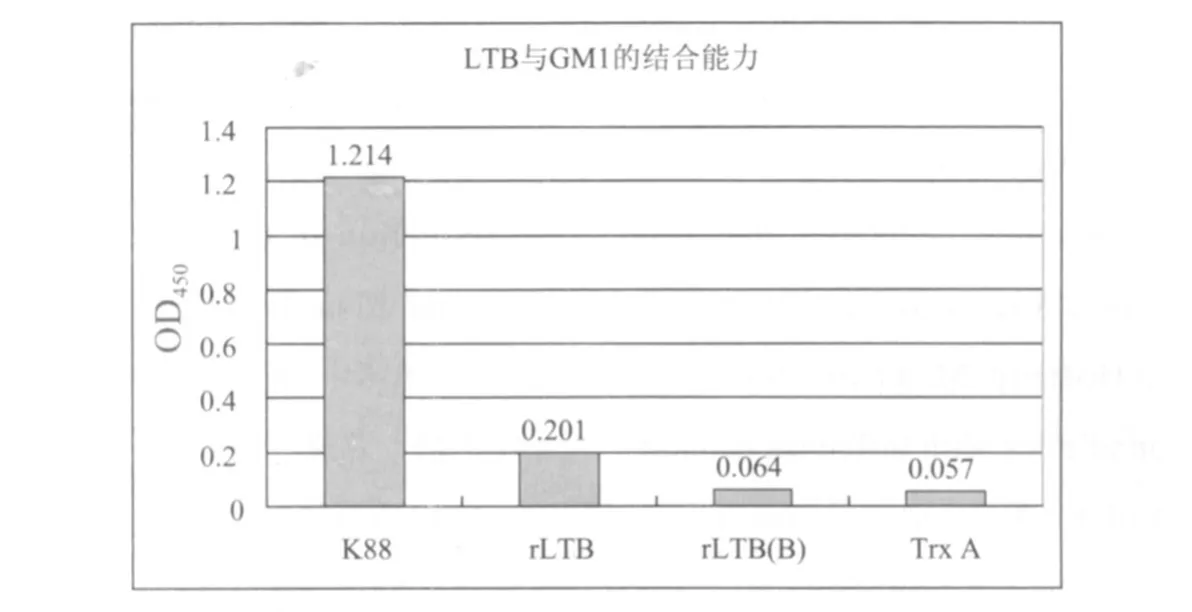
图10 复性后LTB融合蛋白生物学活性检测结果Fig.10 Nature characfer of fuse profein ofter renatured
3 讨论
本实验所选用的pET32a表达系统为融合表达载体,在T7启动子的控制下进行融合蛋白表达。融合蛋白比非融合蛋白更稳定,另外载体本身表达的硫氧环蛋白(Trx A)有6个组氨酸(His)标签,利于蛋白的提取与纯化。
完整的LT和霍乱毒素(cholera toxin, CT)分子均由一个A亚单位(LTA,CTA)和5个B亚单位(LTB,CTB)组成。A亚单位具有ADP-核糖基化转移酶活性,也是毒素毒性所在部位;B亚单位无毒性,但能与哺乳动物细胞表面神经节昔脂GM1结合[2,4]。霍乱肠毒家B亚单位(CTB)一直是较为公认的黏膜免疫佐剂,但近年文献报道重组CTB与抗原混合后刺激产生S-IgA能力弱或无,但作为皮下免疫佐剂刺激产生血清S-IgG作用较强[5]。CTB激活的Th2途径可产生IL-4,IL-4则能选择性地促进IgE合成,因而有可能引起变态反应。LTB主要激活不产生IL4的Th1途径,故认为LTB一般不引起变态反应[4]。因此,LTB较CTB更适合作为口服基因工程疫苗的佐剂。
另外有报道显示,LTB有复杂的免疫调节功能,如LTB除具有与LT相似的黏膜佐剂活性外,还具有免疫抑制作用,从而用于某些自身免疫病的防治[6-8],其具体功能的发挥可能与LTB作用的途径有关[9]。当LTB以黏膜途径与外来抗原共免疫时,发挥黏膜佐剂作用, 而当LTB直接与脾细胞作用时,则发挥免疫抑制作用。关于这两种相反作用的机制,我们推测可能是LTB对黏膜淋巴细胞和脾淋巴细胞上的GM1 受体有不同的作用,从而激发了两种不同的信号通路,分别导致促进免疫应答和抑制免疫应答的细胞因子的分泌,至于其具体的调节通路还有待于进一步深入研究。但可以肯定的是,由于LTB 兼有黏膜免疫佐剂和免疫抑制两种免疫调节功能,这将为新型黏膜疫苗的研制及移植排斥和细胞毒性T 细胞介导的自身免疫病的防治提供新的思路,也为LTB在医学和生物学中的应用提供了一定的实验依据。
[1][美]J. 萨姆布鲁克 J, 拉塞尔 D W.分子克隆实验指南[M].3版. 北京: 科学出版社, 2002.
[2]de Haan L,Holtrop M, Verweij W R, et al. Mucosal immunogenicity of the Escherichia coli heat-labile enterotoxin:role of the A subunit[J]. Vaccine, 1996, 14(4):260-266.
[3]de Haan L, Verweij W R, Feil I K, et al. Role of GM1-binding in the mucosal immunogenicity and adjuvant activity of the Escherichia coli heat labile enterotoxin and its B subunit [J]. Immunology, 1998; 94(3): 424-430.
[4]Yamamoto M, Mcghee J R, Hagiwara Y H, et al. Genetically manipulated bacterial toxin as a new genetation mucosal adjuvant[J]. Scand J Immunol, 2001, 53(3): 211-217.
[5]Haan L, Verweij W R, Holtrop M, et al. Nasal or intramuscular immunization of mice with influenza subunit antigen and the B subunit of Escherichia coli heat-labile toxin induces IgA-or IgG-mediated protective mucosal immunity[J]. Vaccine, 2001, 19(20-22): 2898-2907.
[6]Millar D G, Hirst T R, Snider D P, et al. Escherichia coli heat-labile enterotoxin B subunit is a more potent mucosal adjuvant than its vlosely related homologue, the B subunit of cholera toxin[J]. Infect Immun, 2001, 69 (5): 3476-3482.
[7]Williams N, Hirst T, Nashar T. Immune modulation by the choleralike entero-toxins: from adjuvant to therapeutic [J].Immnol Today, 1999, 20 (2): 95- 101.
[8]Richards C M, Aman A T, Hirst T R, et al. Protective mucosal immunity to ocular herpes simplex virus type 1 infection in mice by using Escherichia coli heat-labile enterotoxin B subunit as an adjuvant [J]. J Virol, 2001, 75(4): 1664-1671.
[9]王静, 郑瑾, 杨筱凤,等. 热不稳定大肠杆菌肠毒素B亚单位免疫调节功能的实验研究[J]. 细胞与分子免疫学杂志, 2003, 19(2): 112-114.

