利用血细胞计数板检测牛冻精活精子百分率和活力的效果分析
陈 军,韩 东,邓 强
(新疆畜牧总站,乌鲁木齐 830009)
利用血细胞计数板检测牛冻精活精子百分率和活力的效果分析
陈 军,韩 东,邓 强
(新疆畜牧总站,乌鲁木齐 830009)
使用血细胞计数板对牛细管冻精的活精子百分率和活力进行了检测。结果表明:在检测活精子百分率时,血细胞计数板与台盼兰染色两者差异不显著(P>0.05);解冻后1 h、 2 h和3 h,用计数板方法连续检测解冻后精子活力,检测数据重复性较好。使用血细胞计数板直接检测冻精的活精子百分率和活力方便有效。
冻精 ;活精子百分率 ;活力;血细胞计数板
冻精品质分析是判断种公牛繁殖力和冻存效果的有效手段[1]。精子的活力、活精子百分率、顶体完整率和畸形率与受胎率的关系密切。Woelders等[2]分析了牛和猪冻精和鲜精受胎率后指出,活精子百分率和顶体形态指标可作为判断受胎率的指标。Januskauskas等[3]研究发现,牛冷冻精液解冻后的镜检活率与穿卵精子数及56天不返情率呈极显著的正相关。
分析冻精质量时,由于受实验条件的限制,尤其在人工授精现场分析时,大部分都采用目测评估。该法简单快捷易于操作,但经验性较强,不易掌握,分析结果因人而异变化较大,对奶牛场生产安排和经济效益产生一定的影响。而血细胞计数板法作为一种最为可靠和最为经典的计数技术,重复性好、准确率高、方法简便,它不仅适用于血细胞计数,还可用于其他动物细胞在显微镜下计数。本实验探讨采用血细胞计数板观察冻精的活力和活精子百分率,并就这种方法的检测结果与常规方法进行了比较。
1 材料与方法
1.1 冻精
西安德瑞良种奶牛推广中心制。
1.2 器材
血细胞计数板(简称血球板):QIU JING制造(02270113号),倒置显微镜:Nikon TS100。
1.3 精液稀释液
配制参见[4]。
1.4 精液解冻
将细管冻精置于37℃温水中30 s内解冻,立即用38.5℃的TAPL液稀释3倍,置于38.5℃的CO2培养箱,供后续检测分析。
1.5 精子密度测定
取干净的计数板平放于实验桌上,用少量水浸湿平行小沟的外沿,然后放上干净的盖玻片。吸取少量待测精液用超纯水稀释10倍,用移液枪取10 μl稀释后的精液样,拭净枪头,将枪头轻轻置于盖玻片边缘,让精液悬心平稳地缓慢流出,通过毛细管作用进入计数室内。准备一大的培养皿,下垫一块浸湿的滤纸,将计数板放入其中,盖上盖子,静止5 min。小心取出计数板,放于显微镜载物台上静止2~3 min, 待精子不再浮动后便可计数。先在低倍镜下找到计数室的中央大方格,然后在高倍镜(40×物镜)下计数,求出每毫升精液中精子的密度。
1.6 精子活力测定
目测评估(简称估测):为便于在显微镜下计数,用移液枪取10 μl待测精液,滴在载玻片,加上盖玻片,置于显微镜下放大250~400倍检查,计数一个视野下直线前进运动精子与非直线运动精子的比例,求出活力;血细胞计数板计数(简称血球板计数):吸取待测精子用TAPL液再次稀释(稀释倍数以便于观察计数为易),用移液枪取10 μl TAPL液稀释后的精子样,让精液通过毛细管作用进入计数室内,统计出4个角及中央共5个中方格中的非直线运动的(包括死精子、摆动、旋转运动)的精子数,求出每毫升精液中非直线运动的精子数。每份精液在解冻后0 h、1 h、2 h和3 h分别计数精子活力,且每个时间段分别用2种方法重复计数5次,求其均值。
1.7 精子存活率
台盼兰染色法:100 μl待测精子加10 μl 0.4 g/L台盼兰溶液,38.5℃、CO2培养箱孵育3~5 min后制板,自然干燥,显微镜下观察200个精子。活精子不着色,死精子呈红色或蓝色。血细胞计数板计数法:操作同精子活力检测,统计出4个角及中央共5个中方格中的死精子数,求出每毫升精液中死精子数。每份精液解冻后立即检测,分别用两种方法重复计数5次,求其均值。
1.8 统计分析
配对比较总体均数进行t检验。
2 结果
2.1 两种方法计数精子存活率的比较
从表1可知,两种分析方法之间差异不显著(P>0.05)。血球板变异系数(CV)与台盼兰染色计数法的变异系数相近,重复性也较好。
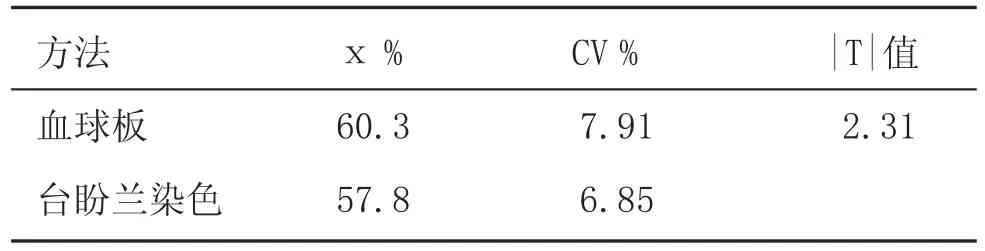
表1 两种方法计数精子活率的比较
2.2 3个时间段精子活力的分析
由表2统计分析表明,3个时间段冻精活力的检测数据随着时间的延长变异系数逐渐增大,组内重复性好。
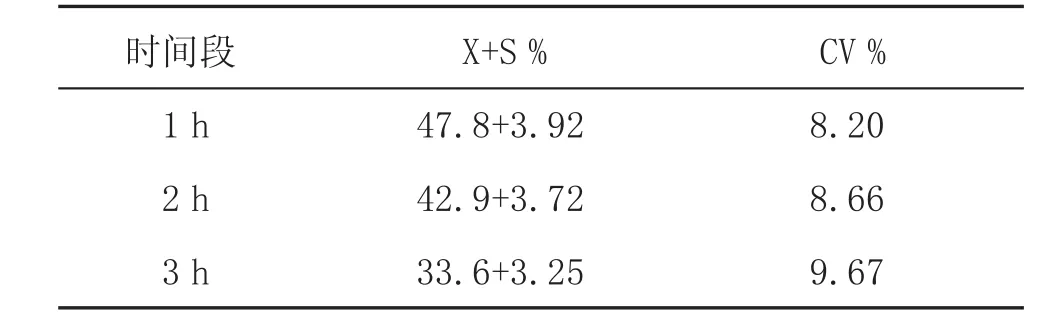
表2 3个时间段精子活力的分析
3 讨论
在1852年就有人开始设计对红细胞的计数办法,1855年发明了用于计数血细胞的计数板。目前仍然使用的改良Neubauer计数板就是应用最为广泛和持续时间最为长久的一种。虽然各种类型的血细胞计数仪已在广泛使用,但血细胞计数板法仍然是最为可靠和最为经典的计数技术。血细胞计数板用于精子计数目的,主要是在制作冻精和体外受精时测定精子的密度,而不用于活精子百分率或精子活力的测定。可能是由于计数板的计数池深0.1 mm,活精子和死精子不处于同一焦平面上,往往造成计数结果误差。本实验以TAPL液为稀释液,用血细胞板计数法分析冻精品质,取得了较好的检测效果。从表1和表2可知,冻精活率检测与台盼兰染色法无显著差异,而且冻精活力检测数据重复性好,说明用血细胞计数板法检测精子活力和活精子百分率是可行的。
为了便于观测和保持精子活力,本试验采用了较为复杂的TAPL液,而在实际的应运中用灭菌生理盐水,即可保证检测分析进行。由表2数据说明,经3个时间段对解冻后精子活力进行连续检测,随着存放时间的延长监测数据变异系数逐渐增大。可能是随时间的延长,精子活力下降,出现扎堆现象,造成计数结果不准确。所以,解冻后尽快进行精子常规检测,以保证分析结果的准确性。而3个时间段血细胞计数板法重复性好,准确性高,方法简便,不失为一种提高牛精液常规检查质量,客观反映精液情况的好方法。
[1] 董伟.家畜繁殖学[M].北京:中国农业出版社,1999, 144.
[2] Waelders H. Fundamentals and recent development in cryopreservation of bull and boar semen[J].Vet Q, 1997, 19: 135-138.
[3] Januskauskas A, Johannisson A, Rodriguez-Martine H. Assessment of sperm quality through fluorometry and sperm chromatin structure assay in relation to field fertility of frozen-thawed semen from sedish AI bulls[J]. Theriogenology,2001, 55:947-961.
[4] Nolan JP, Graham JK, Hammerstedt RH. Artificial induction of exocytosis in bull sperm. Arch Biochem Biophys 1992, 292:311-322.
S823.3
A
1005-2739(2011)06-0015-02
2011-09-26
陈军(1978-),男,硕士,畜牧师。
E-mail:junchen08@163.com

