功能性寡糖对奶山羊瘤胃发酵功能的影响
肖 宇王利华程 明祁 茹褚永康林英庭*
(1.青岛农业大学动物科技学院,青岛 266109;2.青岛市畜牧兽医研究所,青岛 266100)
寡糖(oligosaccharides)是由2~10个单糖以糖苷键连接起来形成的一类糖,根据单糖分子间结合位置的不同,可分为普通寡糖和功能性寡糖。大量研究表明,功能性寡糖具有无污染、无残留等优点,能够改善动物胃肠道微生物区系,增强机体免疫功能,改善脂类代谢,提高饲料养分利用率,改善动物生产性能[1-5]。因此,功能性寡糖作为一种替代抗生素的新型饲料添加剂越来越受到人们的关注。目前国内外有关功能性寡糖在反刍动物的研究主要集中在犊牛、奶牛以及绵羊上。任海军[6]报道,0.1%壳聚糖能够明显增加奶牛肠道乳酸杆菌的数量,降低大肠杆菌的数量。Heinrichs等[7]报道,甘露寡糖能够优化牛的胃肠道微生态环境,促进双歧杆菌等有益菌的增殖,抑制大肠杆菌等致病菌的数量。邰秀林等[8]报道,果寡糖可缓解早期断奶对犊牛的应激,提高犊牛血清免疫球蛋白A(IgA)和免疫球蛋白G(IgG)含量。王喜明等[9]报道,5 g/d低聚木糖可显著提高4周末犊牛的平均日增重和体重。瞿明仁等[10]报道,瘤胃和十二指肠灌注大豆寡糖能够提高绵羊外周血液免疫细胞CD4细胞数量、CD4/CD8值及血清IgA和IgG含量。而寡糖对山羊尤其是奶山羊的研究报道极少。因此,本试验拟通过研究饲粮中添加5种不同的功能性寡糖对奶山羊瘤胃发酵功能的影响,筛选和确定适宜作为奶山羊饲料添加剂的寡糖种类,为寡糖在奶山羊领域的合理应用提供理论依据。
1 材料与方法
1.1 试验材料
寡木糖(XOS,纯度为70%),异麦芽寡糖(IMO,纯 度 为 90%),果寡糖(FOS,纯 度 为90%),半乳甘露寡糖(GMOS,纯度为80%),甘露寡糖(MOS,纯度为50%),均为商业产品。
1.2 试验动物及试验设计
试验选用6只体况良好,体重(32.80±2.45)kg装有永久性瘤胃瘘管的6月龄去势崂山奶山羊。采用分期分组试验设计,每期中1只羊饲喂以混合精料为基础不添加寡糖的对照饲粮(CT),其他羊分别饲喂添加1%(以有效含量计)不同外源寡糖的试验饲粮。试验共分4期,每期15 d,其中预试期13 d,正试期2 d。试验动物及分组见表1。
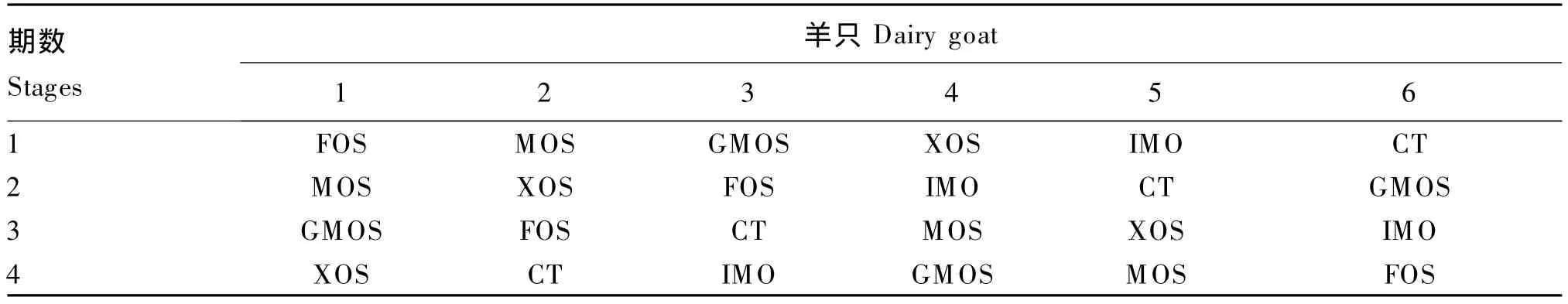
表1 试验动物及分组Table 1 Dairy goats and groups of the test
1.3 试验饲粮及饲养管理
试验精料组成及营养水平见表2。试验期间奶山羊单笼饲养,每日07:00和17:00分2次等量饲喂,先精后粗,精料425 g/d,粗料1 000 g/d(全株玉米青贮及花生蔓,比例为1∶2),精粗比约30∶70,自由饮水,各组间饲养管理完全一致。
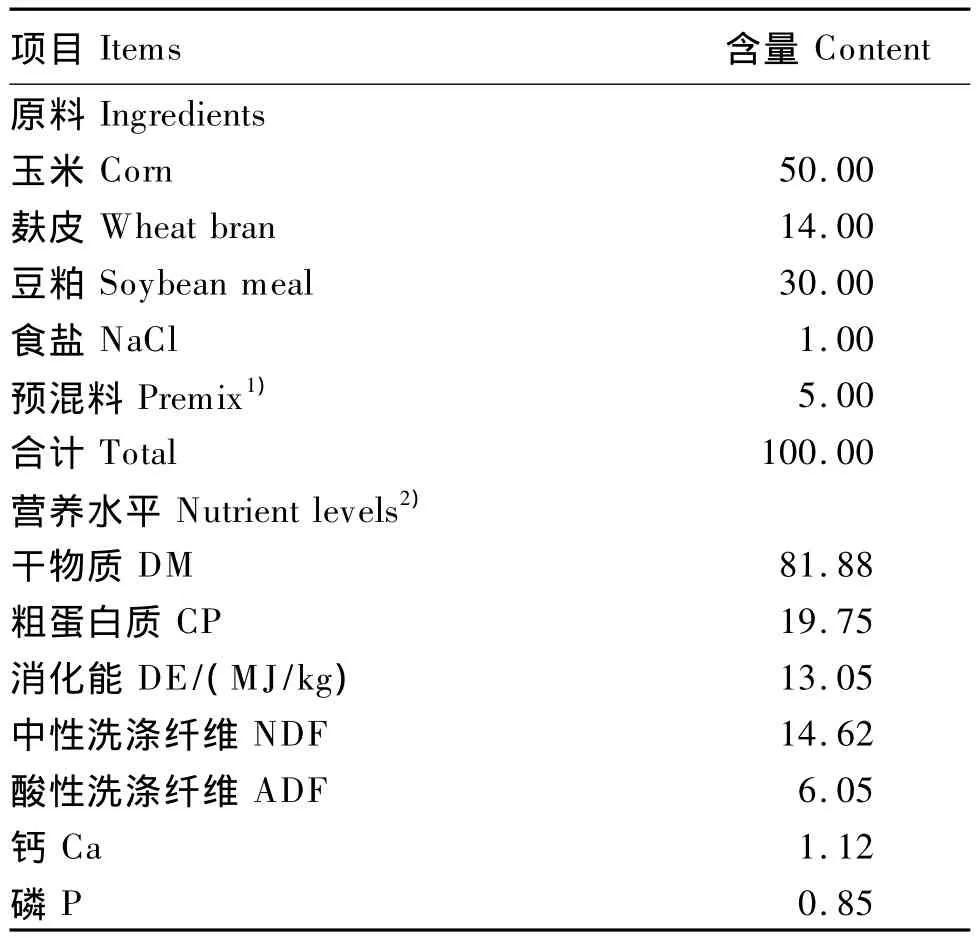
表2 精料组成及营养水平(风干基础)Table 2 Composition and nutrient levels of the concentrate(air-dry basis) %
1.4 样品采集
晨饲前采集瘤胃液作为0 h样品进行分析,同时按饲喂后 1、2、3、4、6、8、10 h 分别采集瘤胃液样品,每次约30 mL。采集的瘤胃液经4层纱布过滤后立即测定pH。取10 mL加入1 mL 6 mol/L盐酸,用于测定氨态氮(NH3-N)浓度;取10 mL加入1 mL 25%的偏磷酸,用于测定挥发性脂肪酸(VFA)浓度。样品放入干净的离心管中于-20℃冰箱中保存。
1.5 测定指标及方法
pH采用Sartotius普及型pH计测定(PB-10);NH3-N浓度的测定参照冯宗慈等[11]比色法;VFA浓度的测定按照曹庆云等[12]气相色谱法。
1.6 数据处理与统计分析
试验数据采用Excel软件整理,SPSS 17.0软件One-way ANOVA进行方差分析,LSD法进行组间差异显著性检验。试验数据以“平均值±标准差”表示。
2 结果
2.1 不同寡糖对奶山羊瘤胃pH的影响
由表3可见,各寡糖组的瘤胃pH在采食后各个时间点较对照组大致都有降低的趋势(P>0.05)。半乳甘露寡糖组的瘤胃pH在采食后6、8、10 h极显著低于对照组、寡木糖组、异麦芽寡糖组和果寡糖组(P<0.01)。甘露寡糖组的瘤胃pH在采食后6、10 h极显著低于对照组和寡木糖组(P<0.01)。果寡糖组的瘤胃pH在采食后10 h显著低于对照组和寡木糖组(P<0.05)。从平均值来看,半乳甘露寡糖组和甘露寡糖组的瘤胃pH极显著低于对照组(P<0.01),甘露寡糖组显著低于寡木糖组、异麦芽寡糖组和果寡糖组(P<0.05),半乳甘露寡糖组极显著低于寡木糖组、异麦芽寡糖组和果寡糖组(P<0.01),寡木糖组、异麦芽寡糖组和果寡糖组与对照组差异不显著(P>0.05),但较对照组都有降低的趋势。
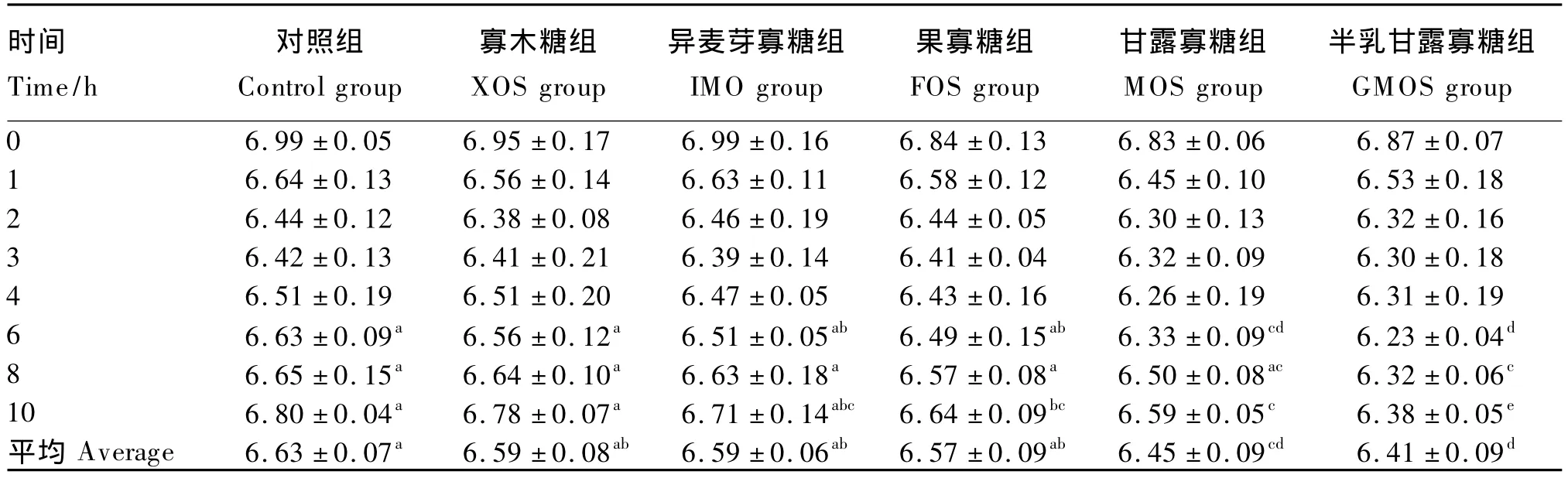
表3 饲粮中不同寡糖对奶山羊瘤胃pH的影响Table 3 Effects of different oligosaccharides on rumen pH of dairy goats
2.2 不同寡糖对奶山羊瘤胃NH3-N的影响
由表4可见,从平均值来看,半乳甘露寡糖组和果寡糖组的瘤胃NH3-N浓度显著低于对照组,分别比对照组降低了 5.68%和 5.77%(P<0.05);寡木糖组、异麦芽寡糖组、甘露寡糖组的瘤胃NH3-N浓度较对照组有降低的趋势(P>0.05)。从不同时间点来看,果寡糖组的瘤胃NH3-N浓度在采食后2 h显著低于对照组(P<0.05);半乳甘露寡糖组瘤胃NH3-N浓度在采食后3和4 h显著低于对照组和异麦芽寡糖组(P<0.05);甘露寡糖组和寡木糖组在采食后8 h显著低于对照组(P<0.05)。
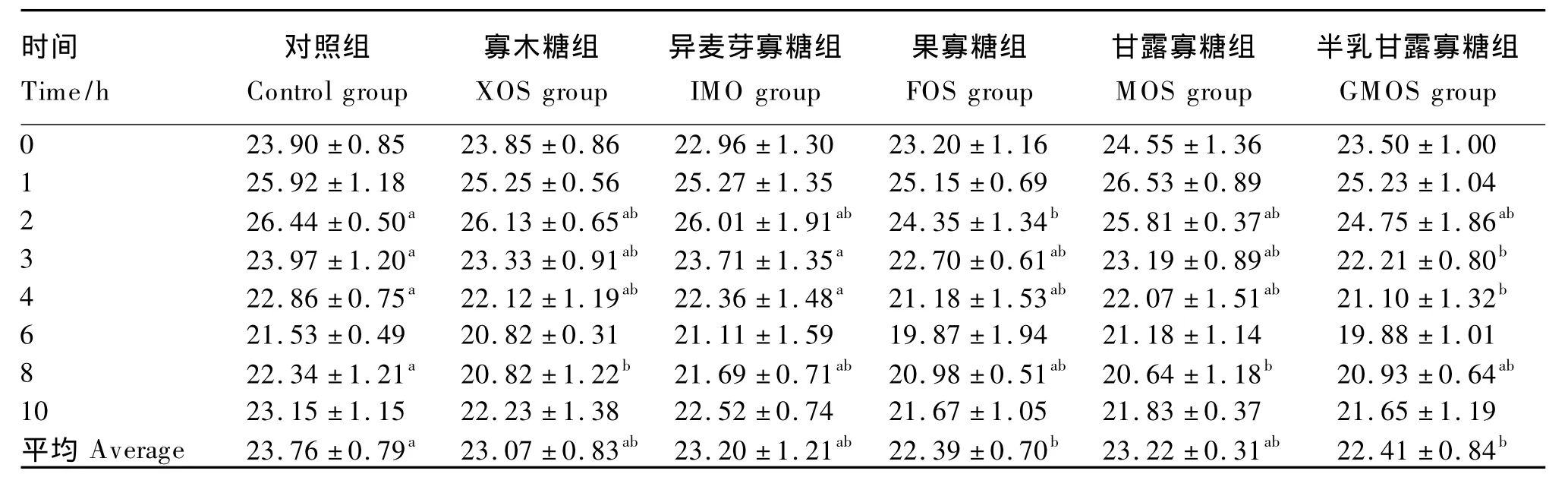
表4 饲粮中不同寡糖对奶山羊瘤胃NH3-N浓度的影响Table 4 Effects of different oligosaccharides on rumen NH3-N concentration of dairy goats mg/dL
2.3 不同寡糖对奶山羊瘤胃VFA含量的影响
由表5可见,从平均值来看,半乳甘露寡糖组对奶山羊瘤胃内乙酸含量的影响极显著(P<0.01),其他寡糖组见差异不显著(P >0.05),但乙酸含量较对照组相比都有升高的趋势;半乳甘露寡糖组乙酸含量在采食后2、4、10 h均显著高于对照组(P<0.05);甘露寡糖组乙酸含量在采食后4 h显著高于对照组(P<0.05)。奶山羊瘤胃内丙酸含量以半乳甘露寡糖组和果寡糖组较高,但是采食后各组间大多数时间点差异不显著(P>0.05),只有半乳甘露寡糖组和寡木糖组的丙酸含量在采食后2 h显著高于对照组(P<0.05)。奶山羊各寡糖组瘤胃内丁酸的含量在各个时间点与对照组差异不显著(P>0.05);半乳甘露寡糖组的丁酸含量在采食后4 h显著高于寡木糖组(P<0.05),采食后4、8 h显著高于甘露寡糖组(P<0.05),采食后 8、10 h显著高于异麦芽寡糖组(P<0.05)。奶山羊瘤胃内总挥发性脂肪酸(TVFA)的含量从平均值来看,半乳甘露寡糖组的TVFA含量显著高于对照组、甘露寡糖组、果寡糖组和异麦芽寡糖组(P<0.05),其他各寡糖组虽与对照组差异不显著,但TVFA含量都有升高趋势(P>0.05)。半乳甘露寡糖组和寡木糖组的乙酸/丙酸(A/P)值在采食后2 h显著低于对照组、异麦芽寡糖组和果寡糖组(P<0.05);甘露寡糖组采食后4 h显著高于寡木糖组(P<0.05);其他时间点各组间均差异不显著(P>0.05)。
3 讨论
3.1 不同寡糖对奶山羊瘤胃pH的影响
瘤胃pH作为瘤胃发酵水平的一项重要指标,受饲粮性质、唾液分泌、瘤胃内VFA、NH3-N浓度、动物本身生理状况及饲养条件等多方面因素的影响。在本试验中,各寡糖组瘤胃pH的动态变化规律为采食后3~6 h降至最低,然后升高;不同寡糖都有降低奶山羊瘤胃pH的作用,半乳甘露寡糖与甘露寡糖的效果尤为明显;而且各组瘤胃液各个时间点的pH在6.23~6.99之间变动,均处于正常生理范围 5.5 ~ 7.5 之间[13]。Mwenya 等[14]研究表明,在荷斯坦奶牛基础饲粮中单独添加2%低聚半乳糖可以降低奶牛瘤胃pH。瞿明仁等[15]研究表明,在内蒙古半细毛羯羊瘤胃内灌注1%和2%的果寡糖,均能显著降低瘤胃pH。刘光斌等[16]采用体外批次培养法研究大豆寡糖对生长绵羊瘤胃发酵特性的影响,结果发现,饲粮中添加1.2%、1.6%、2.0%的大豆寡糖可以显著降低瘤胃 pH。
不同寡糖对奶山羊瘤胃pH的影响不同,这可能与添加寡糖的种类和纯度不同、寡糖的添加量不足或过量、试验动物自身生理状态不同等因素有关。本试验中功能性寡糖的纯度不同,例如:虽然甘露寡糖纯度仅为50%,却显著降低了瘤胃pH;异麦芽寡糖纯度为90%,仅有降低瘤胃pH的趋势。这可能是由于寡糖间的生理活性不同、与其他物质的协同与拮抗作用、饲粮成分含糖量存在差异所致。
3.2 不同寡糖对奶山羊瘤胃NH3-N浓度的影响
NH3-N是瘤胃代谢中外源蛋白质和内源含氮物质降解的重要产物,同时也是瘤胃微生物发酵的主要氮源,适宜的瘤胃NH3-N浓度是保证微生物蛋白合成效率的首要条件,在一定程度上反映了瘤胃微生物利用含氮物质产生氨的速度及对氨的摄取利用情况。本试验各组奶山羊瘤胃液NH3-N浓度的变化趋势为采食后1~2 h升高到最大值,之后下降,6 h降至最低,然后升高,但仍低于晨饲前的瘤胃NH3-N浓度。各组奶山羊瘤胃NH3-N浓度的变化范围为19.87~26.53 mg/dL,均处于Preston等[17]报道的瘤胃最适NH3-N浓度范围内。出现上述结果可能是因为寡糖使瘤胃微生物活性增强,使得饲料中蛋白氮和非蛋白氮不断降解,引起NH3-N浓度的迅速升高,然后,瘤胃微生物利用NH3-N合成微生物蛋白以及瘤胃壁的吸收等因素,引起NH3-N浓度逐渐下降。其中以半乳甘露寡糖组的NH3-N浓度下降最多,推测半乳甘露寡糖组的瘤胃微生物利用NH3-N合成菌体蛋白的能力也可能是最强的。
3.3 不同寡糖对奶山羊瘤胃VFA含量的影响
VFA是瘤胃中碳水化合物发酵的主要产物。乙酸是反刍动物体内脂肪合成的主要前体物。丙酸是唯一能净生成葡萄糖的VFA,足够的丙酸能满足动物对葡萄糖的需要。丁酸在经瘤胃壁吸收的过程中,大部分转变为β-羟丁酸,而作为几种体组织尤其是肌肉组织的能量来源,也可用于脂肪组织和乳腺的脂肪酸合成。凌宝明等[18-20]采用批次培养的方法,研究体外条件下饲粮中添加甘露寡糖、果寡糖、异麦芽寡糖对生长绵羊瘤胃发酵功能的影响,结果表明:饲粮添加甘露寡糖可以提高培养液中VFA含量并以0.60%的添加效果最佳;饲粮添加果寡糖可以显著提高培养液中VFA含量;饲粮添加异麦芽寡糖也可以提高培养液中VFA含量。凌宝明等[21]采用营养灌注技术研究发现,1.00%和2.00%的果寡糖可以显著提高内蒙古半细毛羯羊瘤胃VFA含量。本试验结果显示,功能性寡糖的添加可以显著增加奶山羊瘤胃内乙酸和TVFA的含量,这与本试验中瘤胃pH降低的结果相一致。分析其原因可能有二:其一,瘤胃微生物利用外源寡糖作为发酵底物[22],降解产生大量VFA;其二,外源寡糖促使瘤胃内有益菌的生长增殖[23],增强其对碳水化合物的降解能力,从而产生更多的VFA。
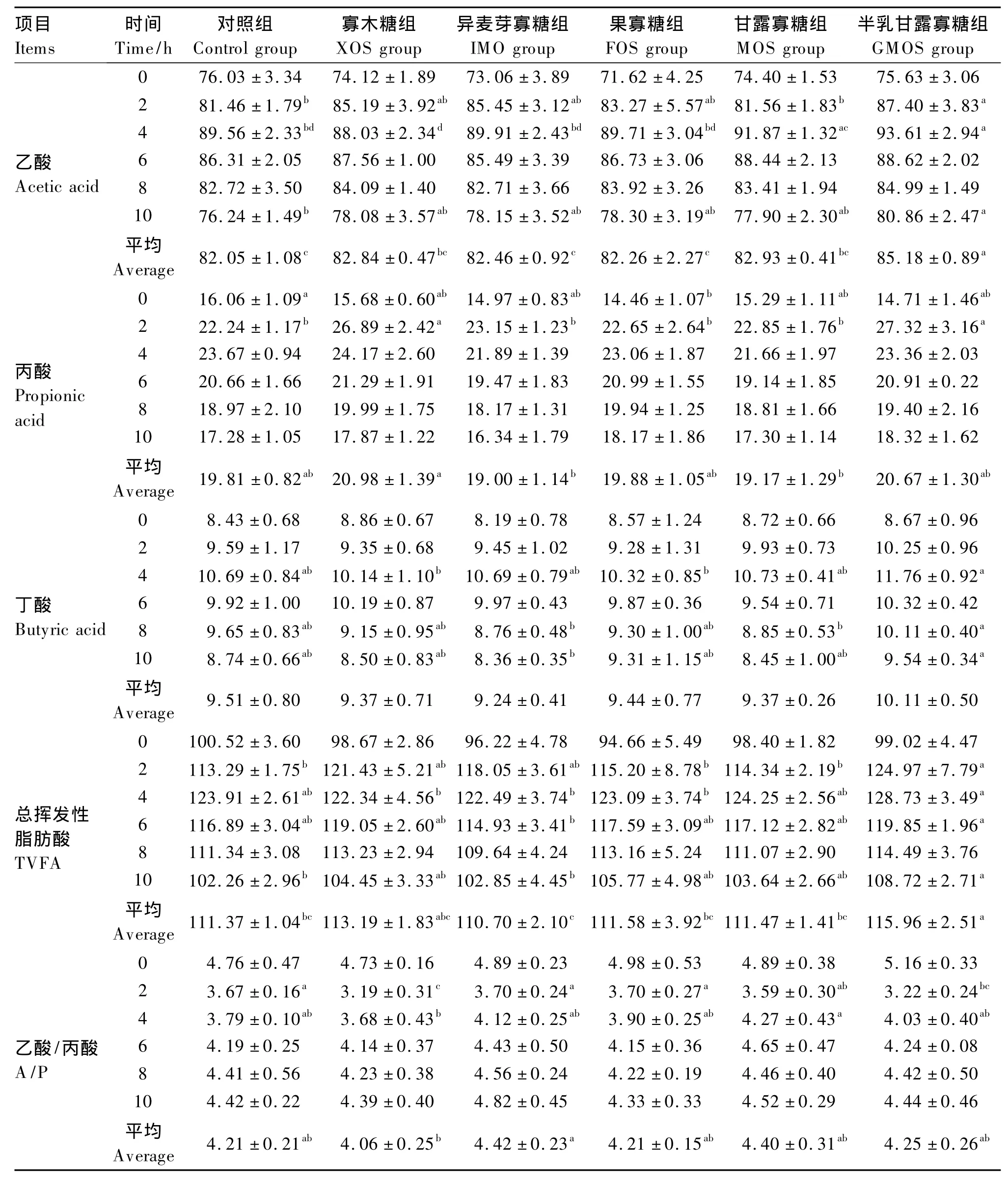
表5 饲粮中不同寡糖对奶山羊瘤胃挥发性脂肪酸含量的影响Table 5 Effects of different oligosaccharides on rumen VFA concentration of dairy goats mmol/L
本试验结果还发现,不同寡糖组的瘤胃丙酸、丁酸含量和A/P值与对照组差异不显著,这与刘光斌等[16]在大豆寡糖对生长绵羊中的试验结果相近,与之不同的是本试验中只有寡木糖和果寡糖有降低A/P值的趋势,而异麦芽寡糖、甘露寡糖和半乳甘露寡糖有升高A/P值的趋势。A/P值降低有助于葡萄糖的沉积,A/P值升高保证乳脂的合成。另外,本试验各寡糖组A/P值均大于3.0,高于Woodford等[24]得出的可维持正常的乳脂合成的A/P值(大于2.5),有利于促进奶山羊的乳脂合成。
4 结论
本试验条件下,饲粮中添加不同功能性寡糖对奶山羊的瘤胃发酵功能产生不同的影响,其中甘露寡糖与半乳甘露寡糖显著降低瘤胃pH,半乳甘露寡糖与果寡糖显著降低瘤胃NH3-N浓度,半乳甘露寡糖显著提高乙酸含量和TVFA含量。综合各项指标,半乳甘露寡糖对提高奶山羊的瘤胃发酵功能效果较好。
[1]CAMPBELL J M,FAHEY G C,Jr.,WOLF B W.Selected indigestible oligosaccharides affect large bowel mass,cecal and fecal short-chain fatty acids,pH and microflora in rats[J].The Journal of Nutrition,1997,127(1):130-136.
[2]张学锋,刘兵,瞿明仁,等.大豆寡糖对绵羊免疫功能的影响[J].中国饲料,2008(16):30-32.
[3]王定发,刘晓华,阮征,等.甘露寡糖与其他生化制剂复合饲喂犊牛试验研究[J].黑龙江畜牧兽医,2005(9):63-64.
[4]张建斌,车向荣,杨华.大豆寡糖替代抗生素对蛋雏鸡生长性能和肠道菌群的影响[J].饲料工业,2010,31(10):7 -9.
[5]李海峰.低聚果糖对仔猪血液生化指标和生产性能的影响[J].福建畜牧兽医,2004,26(6):12 -14.
[6]任海军.壳聚糖对奶牛产奶性能和免疫功能影响的研究[D].硕士学位论文.呼和浩特:内蒙古农业大学,2008.
[7]HEINRICHS A J,JONES C M,HEINRICHS B S.Effects of mannan oligosaccharide or antibiotics in neonatal diets on health and growth of dairy calves[J].Journal of Dairy Science,2003,86(12):4064-4069.
[8]邰秀林,龙翔,向钊,等.低聚果糖对早期断奶犊牛生长性能和血液理化指标及肠黏膜形态的影响[J].中国畜牧杂志,2009,45(11):34 -38.
[9]王喜明,许丽,袁玲,等.低聚木糖对犊牛生长性能和血液生化指标的影响[J].东北农业大学学报,2008,39(7):61 -64.
[10]瞿明仁,刘兵,张学峰,等.消化道不同部位灌注大豆寡糖对绵羊几个免疫指标影响[J].动物营养学报,2007,19(6):678 -683.
[11]冯宗慈,高民.通过比色测定瘤胃液氨氮含量方法的改进[J].畜牧与饲料科学,1993(4):40-41.
[12]曹庆云,周武艺,朱贵钊,等.气相色谱测定羊瘤胃液中挥发性脂肪酸的方法研究[J].中国饲料,2006(24):26-28.
[13]王加启,冯仰廉.不同粗饲料日粮发酵规律及合成瘤胃微生物蛋白质效率研究[J].黄牛杂志,1994,20(71):82-85.
[14]MWENYA B,SANTOSO B,SAR C B,et al.Effects of yeast culture and galacto-oligosaccharides on ruminal fermentation in Holstein cows[J].Journal of Dairy Science,2005,88:1404-1412.
[15]瞿明仁,凌宝明,卢德勋,等.灌注果寡糖对生长绵羊瘤胃发酵功能的影响[J].畜牧兽医学报,2006,37(8):779-784.
[16]刘光斌,刘兵,张学峰,等.不同水平大豆寡糖(SBOS)对生长绵羊瘤胃发酵的影响[J].江西农业大学学报,2007,29(6):871 -875.
[17]PRESTON T R,LENG K A.Matching ruminant production systems with available resources in the tropics and sub-tropics[M].Armidale:Penambul Books,1987.
[18]凌宝明,瞿明仁,卢德勋.甘露寡糖对生长绵羊瘤胃发酵功能(体外)的影响[J].饲料博览,2006(9):6-9.
[19]凌宝明,瞿明仁,卢德勋.果寡糖对生长绵羊瘤胃发酵功能(体外)的影响[J].饲料广角,2006,17:29 -31.
[20]凌宝明,瞿明仁,卢德勋.体外法研究异麦芽寡糖对生长绵羊瘤胃发酵功能的影响[J].中国饲料,2006(13):21-24.
[21]凌宝明,瞿明仁,卢德勋,等.灌注果寡糖对生长绵羊瘤胃发酵功能的影响[J].粮食与饲料工业,2007(6):41-44.
[22]OGIMOTO K,IMAI S.Atlas of rumen microbiology[M].Tokyo:Japan Scientific Societies Press,1981.
[23]赵晓静,李建国,李秋凤,等.甘露寡糖对犊牛粪便菌群影响的研究[J].中国畜牧杂志,2007,43(5):32-34.
[24]WOODFORD S T,MURPHY M R.Effect of forage physical form on chewing activity,dry matter intake and rumen function of dairy cows in early lactation[J].Journal of Dairy Science,1988,71(3):674 -686.

