抗菌肽对蛋鸡血清免疫指标及脾脏白细胞介素2 mRNA 表达量的影响
吕尊周 袁肖笑 蔡兆伟 尹兆正
(浙江大学动物科学学院,杭州 310029)
抗菌肽(AMPs)是一类小于100个氨基酸的小分子多肽,广泛存在于生物体内,其具有广谱的抗菌活性,是生物体先天免疫系统的组成成分。抗菌肽具有不同于抗生素的作用特点,不易产生耐药性,是今后替代抗生素的理想饲料添加剂之一,在畜牧业中具有广阔的应用前景。迄今为止已发现的抗菌肽种类已达上千种,但由于抗菌肽的来源问题以及作用机制不明确,可作为饲料添加剂的抗菌肽种类较少。已有研究表明,饲粮中添加抗菌肽对肉鸡、肉鸭和断奶仔猪均具有促生长的作用[1-3]。在免疫方面,饲喂动物肠道来源的抗菌肽可以提高雏鸡的体液免疫反应,增强肠道黏膜的免疫功能[4-6]。但目前关于抗菌肽在蛋鸡产蛋阶段的研究还鲜有报道。作者在前期的饲养试验中发现枯草芽孢杆菌抗菌肽能改善蛋鸡的产蛋性能。因此,本试验在前期试验的基础上,研究不同水平抗菌肽对蛋鸡免疫功能的影响,通过对蛋鸡脾脏系数、血清免疫指标以及脾脏白细胞介素2(IL-2)mRNA表达量的测定分析,初步探讨抗菌肽对机体免疫调控的作用机制,为今后在蛋鸡生产中的应用提供科学依据。
1 材料和方法
1.1 试验动物及试验饲粮
试验动物为30周龄海塞克斯褐壳蛋鸡。试验基础饲粮在参照美国NRC(1994)蛋鸡营养需要量的基础上,结合海塞克斯蛋鸡饲养手册配制而成(表1)。试验用抗菌肽由杭州保安康生物技术有限公司提供(枯草芽孢杆菌天然抗菌肽,有效含量1%),由37个氨基酸组成,分子质量为3~5 ku。
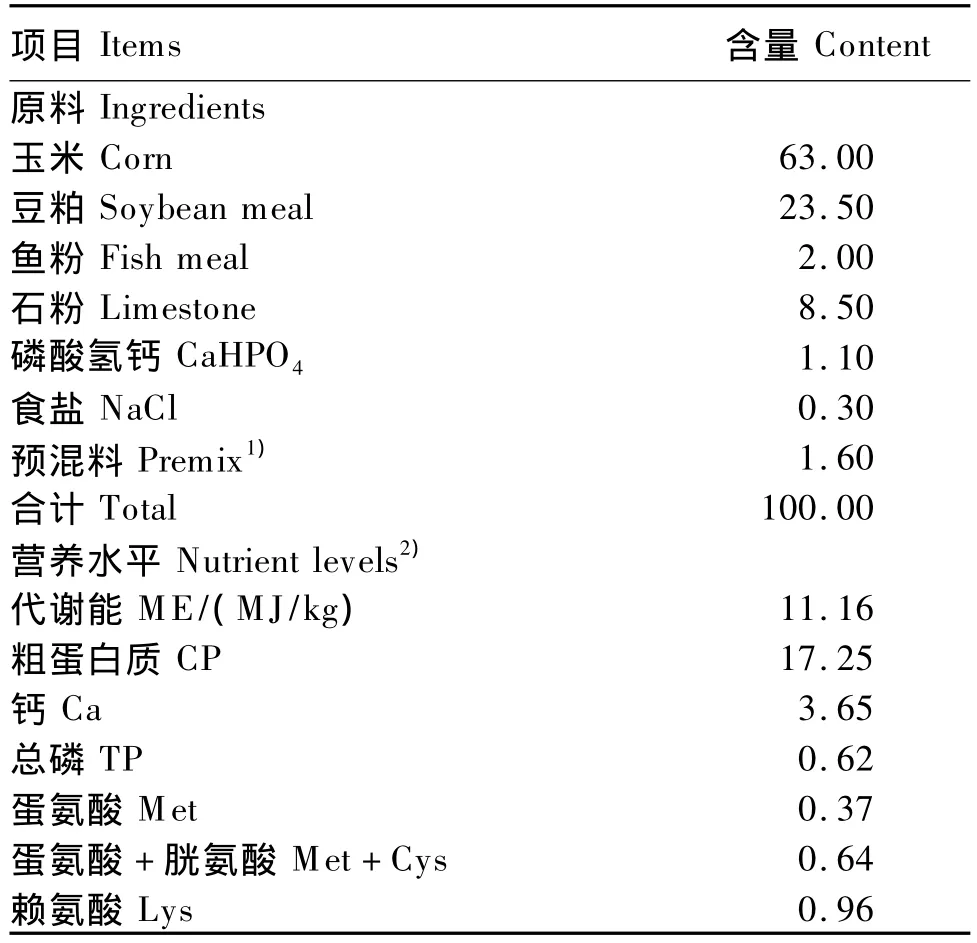
表1 基础饲粮组成及营养水平(风干基础)Table 1 Composition and nutrient levels of the basal diet(air-dry basis) %
1.2 试验设计
选择480只30周龄、体重及产蛋率基本一致的海塞克斯褐壳商品蛋鸡,随机分成4个组,每组4个重复,每个重复30只鸡。Ⅰ组为对照组,饲喂基础饲粮;Ⅱ~Ⅳ组为试验组,分别在基础饲粮中添加200、400、600 mg/kg抗菌肽。预试期7 d,正试期28 d。采用4层阶梯式笼养,自由采食及饮水,光照16 h,免疫程序按常规进行。
1.3 屠宰及样品采集
试验结束最后1 d,每组随机选取12只鸡(每个重复3只)空腹称重,颈动脉放血、自然析出血清,离心后分装,-20℃保存待测。采集脾脏,迅速称重后剪成小块,液氮中速冻,-70℃保存。
1.4 脾脏系数测定
屠宰鸡全部测定脾脏系数。
脾脏系数(g/kg)=脾脏重(g)/活重(kg)。
1.5 血清免疫指标测定
每组随机取8个样本测定血清免疫指标,血清免疫球蛋白A(IgA)、免疫球蛋白G(IgG)、免疫球蛋白M(IgM)、补体3(C3)和补体4(C4)含量采用免疫比浊法测定,试剂盒购自上海复星长征医学科学有限公司,分析仪器为Rx Daytona全自动生化分析仪。
1.6 脾脏IL-2 mRNA相对表达量检测
1.6.1 总RNA的提取和cDNA的合成
每组随机取8个样本提取总RNA,RNA提取所用的试管、器皿、枪头均用0.1%焦碳酸二乙酯(diethypyrocarbonate,DEPC)水处理过夜后,高压灭菌。提取步骤按照RNA prep pure动物组织总RNA提取试剂盒(天根生化科技有限公司)操作说明进行。经琼脂糖凝胶电泳检测RNA的完整性,利用紫外分光光度计检测其浓度和纯度。
取1 μg总RNA按照TIANScript cDNA第一链合成试剂盒(天根生化科技有限公司)操作说明反转录得到cDNA。
1.6.2 引物的设计和合成
根据GenBank上公布的鸡的IL-2基因mRNA序列,使用Primer 3.0设计1对引物,内参基因β肌动蛋白(β-actin)引物序列参照Higgs等[7]设计。引物由上海英潍捷基贸易有限公司合成,引物详细信息见表2。
1.6.3 标准曲线的建立和IL-2 mRNA荧光定量PCR检测
随机取一个 cDNA样本,取2 μL,依次10倍梯度稀释获得 1 ×10-1、1 ×10-2、1 ×10-3、1 ×10-4浓度的稀释产物。以稀释的cDNA作为标准品模板,每个稀释浓度设3个重复,采用SYBR GreenⅠ染料法在ABI StepOnePlusTM实时荧光定量PCR扩增仪上进行扩增。反应体系:SYBR Premix Ex TaqTM10 μL,上下游引物(10 μmol/L)各 0.4 μL,ROX Reference Dye 0.4 μL,cDNA 2.0 μL,加 dH2O 至 20 μL。反应程序:95 ℃ 预变性30 s,95 ℃变性 5 s,58 ℃ 退火 30 s,72 ℃ 延伸30 s,40个循环。反应结束后进行熔解曲线分析,判定引物的特异性。采用上述反应体系和条件对各样本进行实时荧光定量PCR扩增。
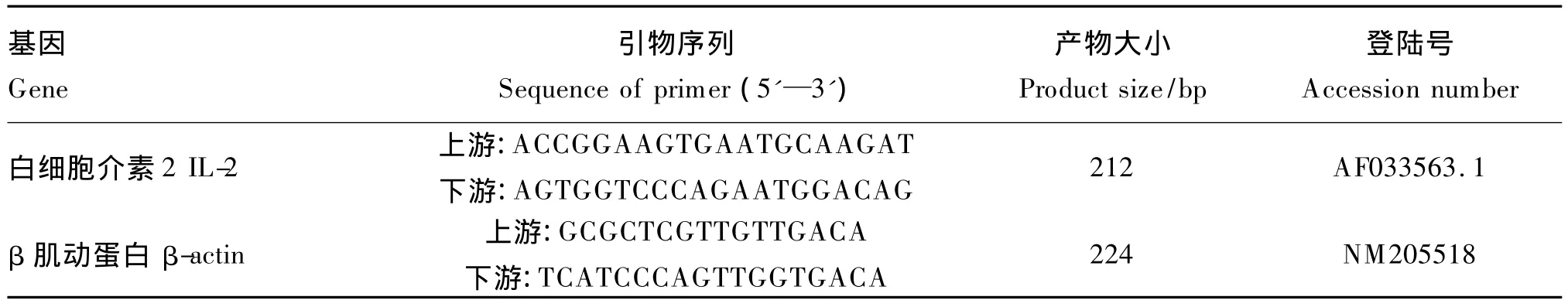
表2 引物序列及参数Table 2 Primer sequences and parameters
1.7 数据分析
目的基因相对表达量按以下公式计算:

式中:Ct为阈值循环。
所有数据采用SPSS 13.0统计软件中ANOVA进行分析,结果以“平均值±标准误”表示,各组间平均值的比较采用LSD多重比较进行差异性显著检验,以P<0.05作为显著性判断标准。
2 结果
2.1 抗菌肽对蛋鸡脾脏系数的影响
由表3可知,抗菌肽能不同程度地提高蛋鸡的脾脏系数。与对照组相比,Ⅱ、Ⅲ、Ⅳ组蛋鸡脾脏系数分别提高了 11.54%(P >0.05)、27.99(P <0.05)、11.65%(P >0.05)。

表3 抗菌肽对蛋鸡脾脏系数的影响Table 3 Effects of AMPs on spleen coefficient of laying hens
2.2 抗菌肽对蛋鸡血清免疫指标的影响
由表4可见,与对照组相比,添加抗菌肽能不同程度地提高蛋鸡的血清免疫水平。抗菌肽组IgA 含量分别提高了 7.69%(P >0.05)、19.40%(P <0.05)和 14.38%(P >0.05),IgG 含量分别提高了 12.69%(P > 0.05)、21.24%(P < 0.05)和 9.10%(P >0.05),IgM 含量分别提高了3.12%(P >0.05)、7.23%(P > 0.05)和 13.6%(P>0.05),C3含量分别提高了 12.12%(P >0.05)、11.85%(P > 0.05)和 15.56%(P >0.05),但抗菌肽的添加对C4含量并没有显著影响(P >0.05)。
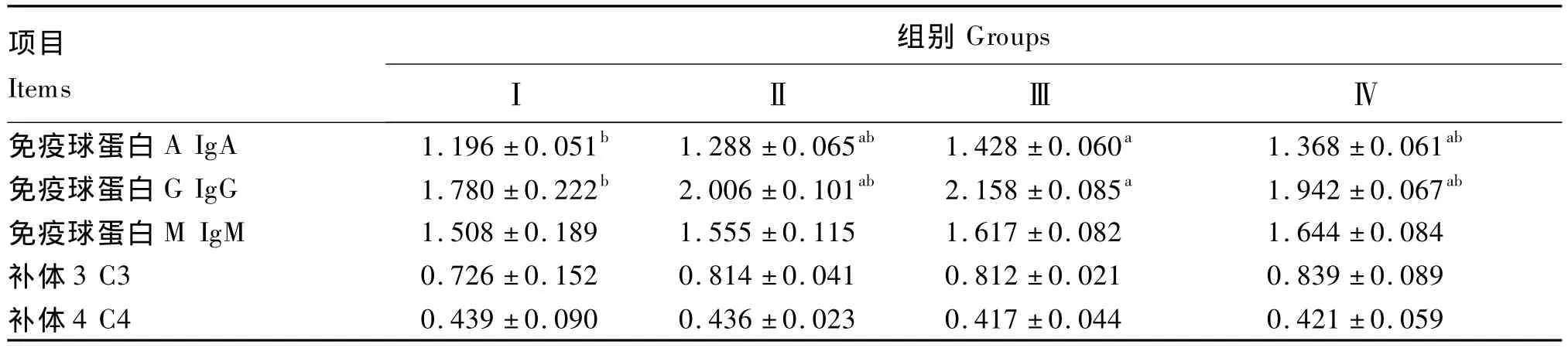
表4 抗菌肽对蛋鸡血清免疫指标的影响Table 4 Effects of AMPs on serum Immune indices of laying hens g/L
2.3 标准曲线和熔解曲线分析
用ABI StepOnePlusTM实时荧光定量PCR扩增仪建立目的基因和内参基因的标准曲线,并检验引物的特异性。由图1和图2可知,IL-2和β-actin基因标准曲线的线性拟合较好,两者扩增效率相差5%以内。2-△△Ct法是一种在实时荧光定量PCR中分析基因表达相对变化的最简便的方法,但使用的前提是目的基因和内参基因的扩增效率基本相同,本试验的扩增效率符合这一要求,可以使用该方法对结果进行分析。PCR反应结束后进行熔解曲线分析表明,熔解曲线平稳且峰形单一,说明无引物二聚体及非特异性产物形成。
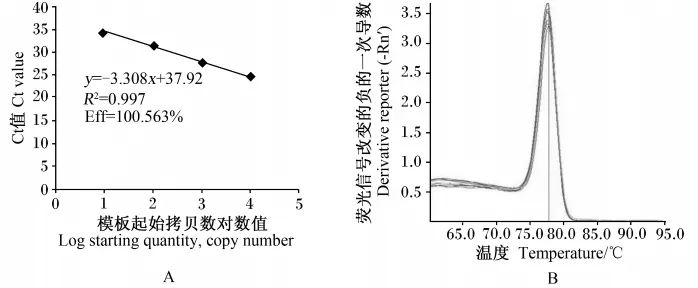
图1 IL-2 cDNA片段实时荧光定量PCR标准曲线(A)和熔解曲线(B)Fig.1 Real-time quantitative PCR standard curves(A)and melt curves(B)of IL-2 cDNA fragment
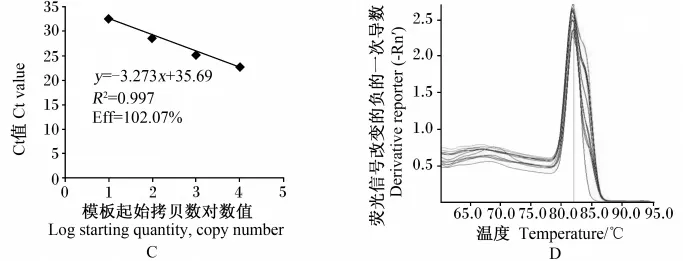
图2 β-actin cDNA片段实时荧光定量PCR标准曲线(C)和熔解曲线(D)Fig.2 Real-time quantitative PCR standard curves(C)and melt curves(D)of β-actin cDNA fragment
2.4 抗菌肽对蛋鸡脾脏IL-2 mRNA表达量的影响
由图3可见,与对照组相比,Ⅱ组和Ⅲ组能显著提高脾脏中IL-2 mRNA的表达量(P<0.05),而Ⅳ组虽有一定程度的提高(P>0.05),但表达量在抗菌肽组中为最低。
3 讨论
脾脏是禽类重要的外周免疫器官,是免疫应答以及抗体产生的主要器官。免疫器官重量是反映免疫器官功能状态的一个重要指标。马卫明[8]研究表明,猪小肠抗菌肽能显著提高雏鸡脾脏、胸腺和法氏囊指数。杨玉荣等[9]报道,鸵鸟皮肤抗菌肽能显著提高4~7日龄雏鸡的免疫器官指数,对其他日龄鸡免疫器官影响不显著。但也有研究表明抗菌肽对肉鸭或肉鸡的免疫器官并无显著影响[10-11]。研究结果不同的原因可能是选用的抗菌肽种类以及动物品种不同所致。本研究表明,添加抗菌肽后蛋鸡的脾脏指数有不同程度的提高,其中400 mg/kg组显著提高。但添加高剂量的抗菌肽时,脾脏指数有下降的趋势,表明脾脏对抗菌肽有一定的耐受范围,过高剂量有可能抑制免疫器官的发育,至于抗菌肽如何影响免疫器官发育尚有待进一步的探讨。
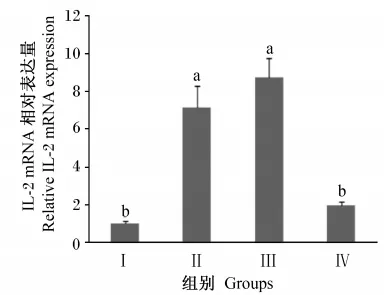
图3 抗菌肽对蛋鸡脾脏IL-2 mRNA表达量的影响Fig.3 Effects of AMPs on expression of IL-2 mRNA in spleen of laying hens
免疫球蛋白是机体对抗原物质产生免疫应答的重要产物,具有各种免疫功能。补体是存在于血清中不耐热具有酶活性的球蛋白,激活后具有细胞溶解、细胞黏附、调理、免疫调节、介导炎症反应、中和病毒等重要的生物学效应。抗菌肽是体内防御体系重要的组成成分,研究表明,用人的α-防御素注射小鼠14 d后其血清中免疫球蛋白G1(IgG1)、免疫球蛋白G2a(IgG2a)、免疫球蛋白G2b(IgG2b)含量显著升高[12]。Yang 等[4]报道,1日龄雏鸡饲喂鸡小肠抗菌肽后,血清IgG和IgM的含量分别在第4~10天和第10~17天显著提高,其特异性免疫也得到加强。姚俊等[13]研究发现无特定病原体(SPF)鸡肌肉注射猪肠道抗菌肽后能显著增加各段肠道内杯状细胞的数量,同时各肠段分泌型免疫球蛋白A(sIgA)分泌量也显著增加,说明猪小肠抗菌肽能提高肠道黏膜的免疫功能。本研究与上述研究结果基本一致,所选用的枯草芽孢杆菌抗菌肽也具有类似的免疫增强效果,蛋鸡血清中IgA、IgG、IgM和C3含量均有一定程度的提高,其中400 mg/kg抗菌肽能显著提高IgA和IgG的含量,但补体C4的含量有一定的降低,但不显著。作者在前期的饲养试验中对蛋鸡的生产性能进行分析,发现400 mg/kg组能显著提高蛋鸡的产蛋率,而另外2个试验组与对照组差异并不显著,同时抗菌肽有提高平均蛋重的趋势,但差异并不显著。这说明上述免疫指标的改变并未影响蛋鸡的生产性能。
Tani等[12]报道,体外培养的小鼠脾细胞用人的的α-防御素刺激后能增殖并促进细胞因子干扰素γ(IFN-γ)和白细胞介素4(IL-4)的分泌。在对人类防御素研究中发现,人抗菌肽LL-37能通过受体依赖机制刺激先天性免疫细胞释放细胞因子白细胞介素 1β(IL-1β)[14],并能够协同 IL-1β提高人外周血液单核细胞中细胞因子白细胞介素6(IL-6)、白细胞介素10(IL-10)和趋化因子的产生[15]。但 Hancock 等[16]认为抗菌肽除了可以直接在溶菌酶协助下杀死微生物,还在细胞介素反应中扮演反馈调节的作用,例如昆虫抗菌肽CEMA能够抑制RAW细胞中白细胞介素15(IL-15)的表达。目前,抗菌肽对蛋鸡脾脏IL-2 mRNA表达量的影响还鲜有报道。IL-2对于机体的免疫应答起着重要的作用,IL-2主要有辅助性 T细胞1(Th1)、细胞毒性T细胞(Tc)以及自然杀伤细胞(NK)产生,它能促进T细胞增殖分化和细胞因子的形成,增强Tc、NK和淋巴因子激活的杀伤细胞(LAK)活性,促进B细胞增殖和抗体生成。本研究发现,抗菌肽能促进鸡脾脏IL-2 mRNA的表达量,其中200和400 mg/kg抗菌肽组能显著提高其表达量,但600 mg/kg组与400 mg/kg组相比,脾脏IL-2 mRNA的表达量有降低的趋势,这与本试验中蛋鸡脾脏系数以及血清免疫球蛋白的变化具有一致性,说明高剂量的抗菌肽有可能对动物产生免疫抑制作用,这有可能是抗菌肽在细胞介素的反应中存在负反馈调节的作用导致对免疫的负向调节。作者推测,抗菌肽可能通过促进脾脏中IL-2的表达进而促进抗体的生成,从而提高了血清中抗体的含量,而高剂量的抗菌肽由于负反馈的调节使得抗体含量下降。
4 结论
本试验结果表明,饲粮中添加抗菌肽能不同程度地提高蛋鸡的脾脏系数,调节血清免疫水平,200和400 mg/kg抗菌肽添加水平能显著促进脾脏IL-2 mRNA的表达量。综合本试验结果,饲粮中以添加400 mg/kg抗菌肽对蛋鸡的免疫效果为最佳。
[1]温刘发,张常明.抗菌肽代替抗生素在断奶仔猪饲粮中的应用效果[J].中国饲料,2001(18):13-14.
[2]黄永彤,黄自然,黄建清,等.抗菌肽与抗生素饲喂肉鸡的效果比较[J].广东饲料,2004,13(2):24-25.
[3]陈晓生,刘为民,周庆国,等.饲粮中添加抗菌肽对肉鸭血清代谢激素及生理生化指标的影响[J].兽药与饲料添加剂,2005,10(2):4 -6.
[4]YANG Y R,JIANG Y B,SHE R P,et al.Effects of chicken intestinal antimicrobial peptides on humoral immunity of chickens and antibody titres after vaccination with infectious bursal disease virus vaccine in chicken[J].Archives of Animal Nutrition,2006,60(5):427-435.
[5]BAO H,SHE R,LIU T,et al.Effects of pig antibacterial peptides on growth performance and intestine mucosal immunity of broiler chickens[J].Poultry Science,2009,88(2):291-297.
[6]WANG D,MA W,SHE R,et al.Effects of swine gut antimicrobial peptides on the intestinal mucosal immunity in specific-pathogen-freechickens[J].Poultry Science,2009,88(5):967-974.
[7]HIGGS R,LYNN D J,GAINES S,et al.The synthetic form of a novel chicken beta-defensin identified in silico is predominantly active against intestinal pathogens[J].Immunogenetics,2005,57:90 - 98.
[8]马卫明.猪小肠抗菌肽分离鉴定及其生物学活性研究[D].博士学位论文.北京:中国农业大学,2004:78-79.
[9]杨玉荣,梁宏德,卫红丽.鸵鸟皮肤抗菌肽对雏鸡免疫器官指数及T淋巴细胞数量的影响初探[J].中国农学通报,2009,25(20):46 -48.
[10]陈晓生,温刘发,张辉华,等.饲粮中添加抗菌肽对肉鸭生产性能及免疫器官、内脏器官的影响[J].畜禽业,2005(2):12-13.
[11]厉宝林,赵东伟,蒲俊华,等.日粮中添加不同生物制剂对鸡免疫机能的影响[J].中国家禽,2007,29(9):22-24.
[12]TANI K,MURPHY W J,CHERTOV O,et al.Defensins act as potent adjuvants that promote cellular and humoral immune responses in mice to a lymphoma idiotype and carrier antigens[J].International Immunology,2000,12(5):691-700.
[13]姚俊,王德成,佘锐萍,等.猪小肠抗菌肽对SPF鸡肠道黏膜免疫功能的影响[J].科学技术与工程,2009(17):4918-4923.
[14]ELSSNER A,DUNCAN M,GAVRILIN M,et al.A novel P2X7receptor activator,the human cathelicidin-derived peptide LL37,induces IL-1β processing and release[J].The Journal of Immunology,2004,172(8):4987-4994.
[15]YU J,MOOKHERJEE N,WEE K,et al.Host defense peptide LL-37,in synergy with inflammatory mediator IL-1β,augments immune responses by multiple pathways[J].The Journal of Immunology,2007,179(11):7684-7691.
[16]HANCOCK R E W,SCOTT M G.The role of antimicrobial peptides in animal defenses[J].PNAS,2000,97(16):8856-8861.

