多梳基因-1在肠癌组织中的表达及其临床意义
高 健 李相良 .吉林省永吉县计划生育服务站综合门诊,吉林永吉300;. 解放军第四六五医院普外科,吉林吉林300
目前大肠癌的预后仍不理想,约有50%的患者死于治疗后的复发或远处转移,患者预后差与其不能早期诊断密切相关[1]。多梳基因-1(Bmi-1)为多梳基因家族(PcG)成员之一,研究显示其在肿瘤的诊断和预后判断中具有广阔的前景[2-3]。因此,笔者采用免疫组化技术,检测了大肠癌患者组织中Bmi-1蛋白的表达情况,以探讨其与大肠癌的关系及相关的临床意义。
1 材料与方法
1.1 一般资料
收集2007年1月~2009年1月来笔者所在医院进行治疗的大肠癌癌患者32例,所有病例均经活检病理诊断证实为大肠癌。其中,男19例,女13例。年龄25~79岁,平均(60.2±11.8)岁。按照大肠癌的Dukes分期分为A、B、C、D四期。其中,A期6例,B期8例,C期11例,D期7例。另取活检的20例正常组织作为对照组。
1.2 主要试剂
Bmi-1蛋白抗体购自美国Santa Cruz公司,浓缩型SP免疫组化超敏试剂盒及DAB显色试剂盒购自福州迈新生物公司。
1.3 Bmi-1蛋白的免疫组化染色
实验所取标本置于4%多聚甲醛固定,4~6 μm石蜡切片常规脱蜡后,分别用于常规HE染色和免疫组化染色。免疫组化染色按照试剂盒的说明操作。
结果判断:Bmi-1阳性表达定位于细胞核,呈黄色或棕黄色。阳性标准:高倍镜下计数100个细胞,阳性细胞数<10%为阴性表达,>10%为阳性表达。
1.4 统计学处理
应用SPSS12.0统计软件处理数据,计数资料使用x2检验。P<0.05为差异有统计学意义。
2 结果
2.1 Bmi-1蛋白在大肠癌组织中的表达
Bmi-1蛋白阳性染色定位于细胞核,Bmi-1蛋白在大肠癌组织中的表达率为56.3%(18/32),而在正常对照组织中仅有15.0%(3/20)的表达,两者差异有统计学意义(P<0.01)。见图1。

图1 Bmi-1蛋白在大肠癌组织中的表达
2.2 Bmi-1蛋白的表达与大肠癌临床特征的关系 (表1)
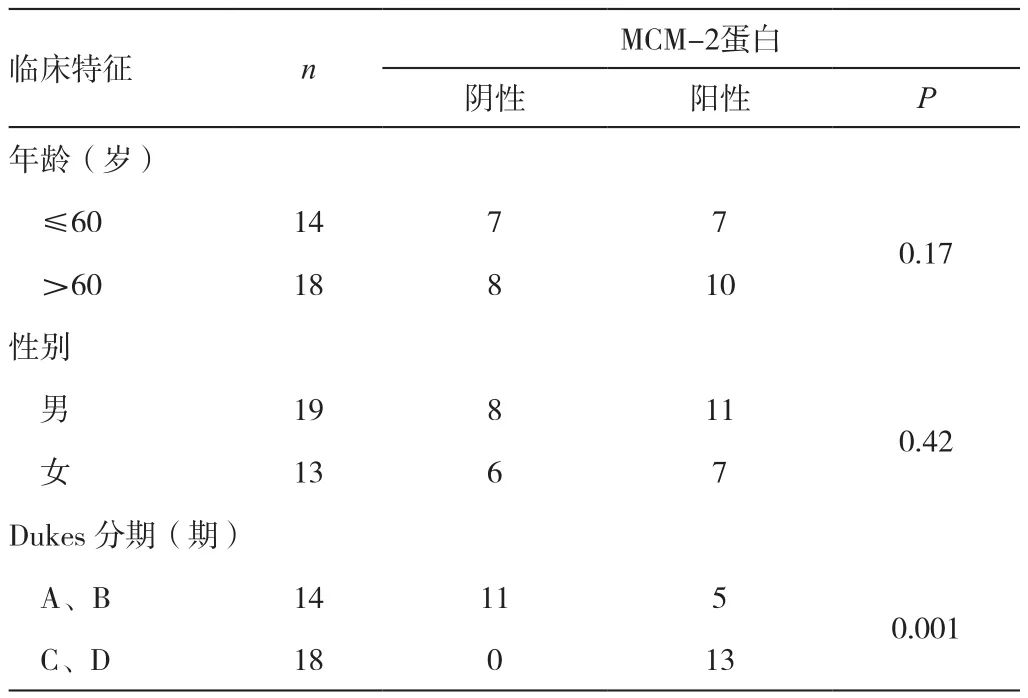
表1 Bmi-1蛋白的表达与大肠癌临床特征的关系
3 讨论
近半个世纪以来世界各国肿瘤的发病率和死亡率逐渐上升,已超过心血管疾病成为新世纪人类的头号杀手,其中由大肠癌所导致的死亡占整个肿瘤死亡的9%[1]。大肠癌的发生、发展伴有多种癌基因的激活和抑癌基因的失活,近年来的统计显示大肠癌的发病率逐年增高,且有年轻化的趋势,大多数患者死亡率高的原因主要是大部分患者明确诊断时已处于中晚期,错过了治疗的时机。有统计显示处于Dukes A期的患者5年生存率可以高达90%以上,说明早期诊断在大肠癌预后中的重要作用[4]。因此,寻找一种能早诊断并监测其复发和预后判断的生物学指标是目前研究的热点。Bmi-1基因是已被实验证实的癌基因,主要是负性下调抑癌基因p16和p14,使p16和p14丧失抑制细胞G1-S期过度的功能,从而导致细胞恶性克隆性增生[5],大量研究显示Bmi-1蛋白在肺癌、卵巢癌、鼻咽癌、乳腺癌等人类多种恶性肿瘤中表达升高,笔者的研究也显示Bmi-1蛋白在大肠癌组织中的表达率为56.3%,显著高于正常对照组织中的15.0%,说明Bmi-1蛋白可以作为大肠癌鉴别诊断的1个标志蛋白。
Dukes分期中A、B期无淋巴结转移,C、D期有淋巴结转移,笔者的结果显示分期之间Bmi-1蛋白的表达也存在统计学差异,提示其与肿瘤的转移有一定的相关性,可成为大肠癌患者预后不良的一个参考指标。
综上所述,Bmi-1蛋白在大肠癌的发生发展中起到一定的作用,可以用于肿瘤的良恶性鉴别诊断、临床分级以及判断预后等方面,具有显著的临床意义。
[1] Jemal A,Siegel R,Xu J,et al.Cancer statistics,2010[J].CA Cancer J Clin, 2011, 60(5): 277-300.
[2] Haupt Y,Alexander WS,Barri G,et a1.Novel zinc finger gene implicated as myc collaborator by retrovirally accelerated lymphomagenesis in Emu-myc transgenic mice[J].Cell,1991,65(5):753-763.
[3] 阚方功,彭开桂.Bmi-1与实体瘤的关系研究进展[J].蚌埠医学院学报,2010,35(11):1193-1196.
[4] 吕洋,刘博,吴靖芳.大肠癌相关生物标志物的病理学进展[J].河北北方学院学报 (医学版 ),2007,24(1):80-82.
[5] 胡中华,胡义德.BMI-1基因与肿瘤关系研究进展[J].中华肿瘤防止杂志,2006,13(23):1824-1827.

