猪链球菌BALB/c小鼠感染模型的初步建立*
张奕强,刘文倩,刘永生,王 印,姚学萍,张 杰
2.四川农业大学动物医学院,动物检疫实验室,雅安625014
猪链球菌(Streptococcus suis)属球菌科(Coccaceae),链球菌属(Streptococcus),为革兰氏阳性兼性厌氧菌。根据荚膜多糖抗原差异,可将其分为35个血清型,分别为1/2型及1~34型。该菌感染宿主范围宽,致病性强,猪感染后可发生淋巴结脓肿、肺炎、脑膜炎、关节炎以及败血症等症状,并且人通过特定的传播途径亦可感染该菌[1-2]。国外自1968年丹麦首次报道了猪链球菌导致人严重感染病例后,已有数十个国家报道了此类病例,在1968-1989年间,全球共报道人感染Ⅱ型链球菌病例108例[3-4]。1998年江苏发生猪链球菌小范围爆发[5],2005年6-8月四川省发生了人-猪链球菌病疫情,导致204人感染,38人死亡,引起了国内外的重视[6]。仔猪感染猪链球菌后的病死率达 10%~25%,育肥猪的发病率为 2%~20%,死亡率逐年升高,严重威胁全国的生猪养殖业,造成巨大的经济损失。由于临床上常见猪链球菌与猪瘟、猪伪狂犬病、猪肺疫、蓝耳病等混合感染或继发感染,这不仅使病情复杂化,而且增大了病死率和防治的难度[7],所以建立良好的动物感染模型,对研究猪链球菌感染的致病机理,以及其与宿主之间的相互作用有极其重要的意义,对开发防治猪链球菌感染的药物和疫苗有积极作用。本文旨在观察猪链球菌感染BALB/c小鼠后的各种临床症状,各器官大体病变,并通过病理切片从组织学水平观察、分析各器官病变,为将BALB/c小鼠作为实验室研究猪链球菌的实验动物提供依据。
1 材料与方法
1.1 菌株 SS-sic05株由四川农业大学动物检疫实验室于2005年分离自四川某猪场一病死仔猪淋巴结。
1.2 实验动物 选取8周龄,体重 16~20g,体况良好的BALB/c小鼠14只,雌雄各半,由中国农业科学院兰州兽医研究所提供。
1.3 实验动物的感染 将菌种接种10%血琼脂平板(按文献8所述方法配制)在有氧条件下置于37℃恒温培养箱中培养24h后,用适量PBS洗下菌落。菌液按麦氏比浊法确定浓度,然后将其稀释到约1×109CFU/mL,经腹腔注射感染10只小鼠,雌雄各半,每只注射0.2mL,另取4只注射等量PBS作为对照。每日观察感染后小鼠的各种行为及症状并做记录。
1.4 病死小鼠的解剖及病理切片制作 无菌选取病变组织或器官接种10%血琼脂平板作病原的分离鉴定,并将选取的病变组织或器官浸泡于10%中性福尔马林中固定。将经固定的样品做常规脱水,石蜡包埋,连续切片,切片厚度5μ m,HE染色后观察、拍照。
1.5 病原的分离 将1.2.2中所述血琼脂平板置于37℃温箱培养24~48h,挑取平板上单个菌落作革兰氏染色,观察其形态和染色特性,根据镜检结果挑取疑似链球菌的单个菌落作纯化培养,分别接种于血琼脂平板和血清肉汤(按文献8所述方法配制)。
1.6 PCR鉴定 用细菌基因组DNA提取试剂盒(购自 TianGen公司)提取纯化后的疑似菌株的DNA,选用能扩增大多数细菌的近乎全长的 16s RNA基因的通用引物对27F/1522R[9](由上海生工生物工程有限公司合成,序列见表1)进行PCR扩增,产物经胶回收试剂盒(购自AXYGEN公司)回收后连接pMD-18T载体(购自大连宝生物工程有限公司),转化入DH5α感受态细胞(购自TianGen公司),经菌落PCR和质粒载体双酶切鉴定后,挑选阳性克隆送上海桑尼生物科技有限公司测序。测序结果在GenBank上进行Blast比对。PCR反应条件:94℃预变性5min;然后94℃变性1min,55℃退火1min,72℃延伸1.5min,循环35次;最后72℃延伸10min。

表1 用于扩增猪链球菌16s RNA基因的通用引物T able 1 Primers for amplification of 16s RNA fragment from Streptococcussuis
1.7 生化试验 将血清肉汤中的菌液以无菌操作分别对葡萄糖、乳糖、甘露醇、山梨醇、尿素、七叶苷、水杨素生化发酵管(购自杭州微生物试剂有限公司)作穿刺接种。接种后,置37℃恒温培养箱培养24~48 h后观察结果。结果判断依据参照文献10。
1.8 药敏试验 用先锋霉素Ⅴ、先锋霉素Ⅵ、头孢呋肟、氯霉素、红霉素、新霉素、四环素、青霉素、氨苄青霉素、羧苄青霉素、苯唑青霉素和氧哌嗪青霉素等12种常用抗菌药物的药敏纸片(购自杭州微生物试剂有限公司)对分离菌进行抑菌试验。将分离菌用接种环致密划线于鲜血琼脂平板,用无菌镊子将以上抗菌药物的药敏纸片分别贴于培养基表面,各片距离要相等,37℃培养24h后观察测量抑菌圈的直径并记录结果。判定标准以抑菌圈直径小于10mm为耐药,直径在10~15mm为中度敏感,直径大于15mm以上为高度敏感[11]。
2 结 果
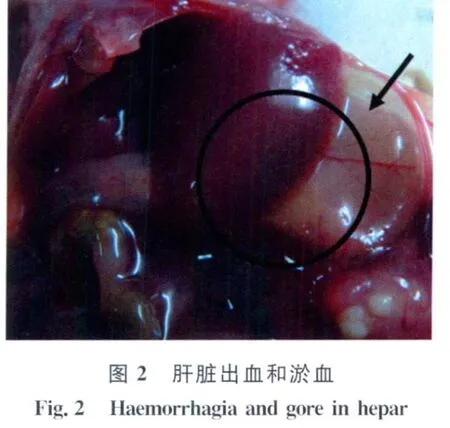
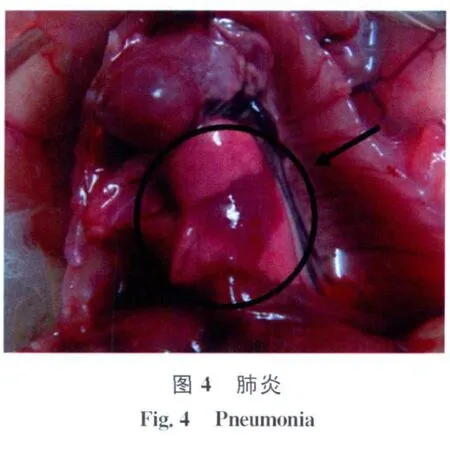
2.1 小鼠致病性 感染3d后对照组小鼠均健康存活;实验组小鼠感染9h后开始出现精神萎靡,随后先后出现扎堆、颤抖、厌食、四肢瘫痪等症状。第一只小鼠死亡时间是感染22h后,感染68h后最后1只小鼠死亡。死后解剖可见皮下出血,血液凝固不良;打开腹腔可见肠道有多量浆液性渗出,小肠肠壁变薄并充满黄色液状内容物,见图1。肝脏明显淤血或出血,质地易碎,见图2。脾脏肿大,边缘钝圆,有明显出血或淤血,见图3。肾脏一定程度肿胀,有淤血或出血;打开胸腔可见肺部有明显的出血或淤血,严重者可在其表面见灰白色坏死灶或发生肺肉变,见图4。
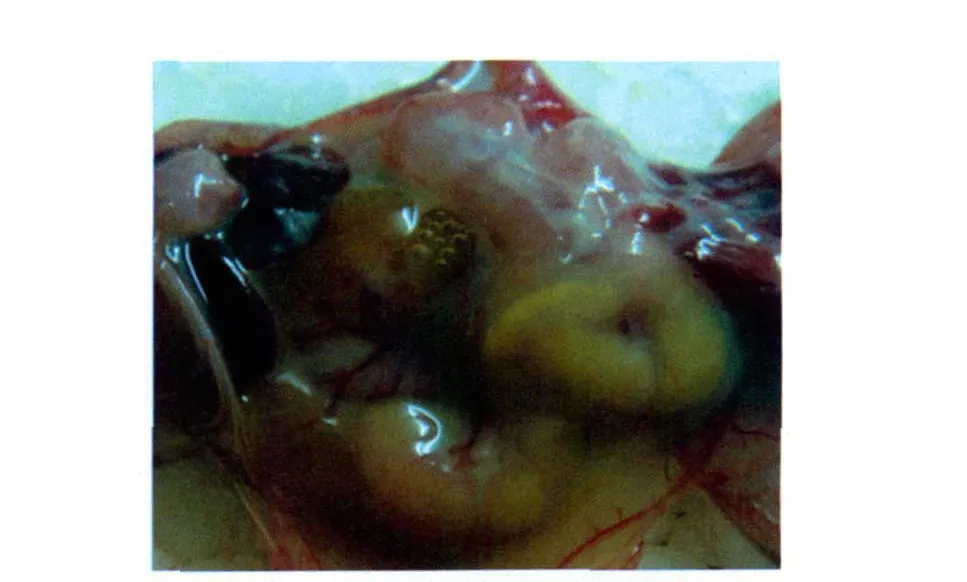
图1 小肠肠炎Fig.1 Enteritis
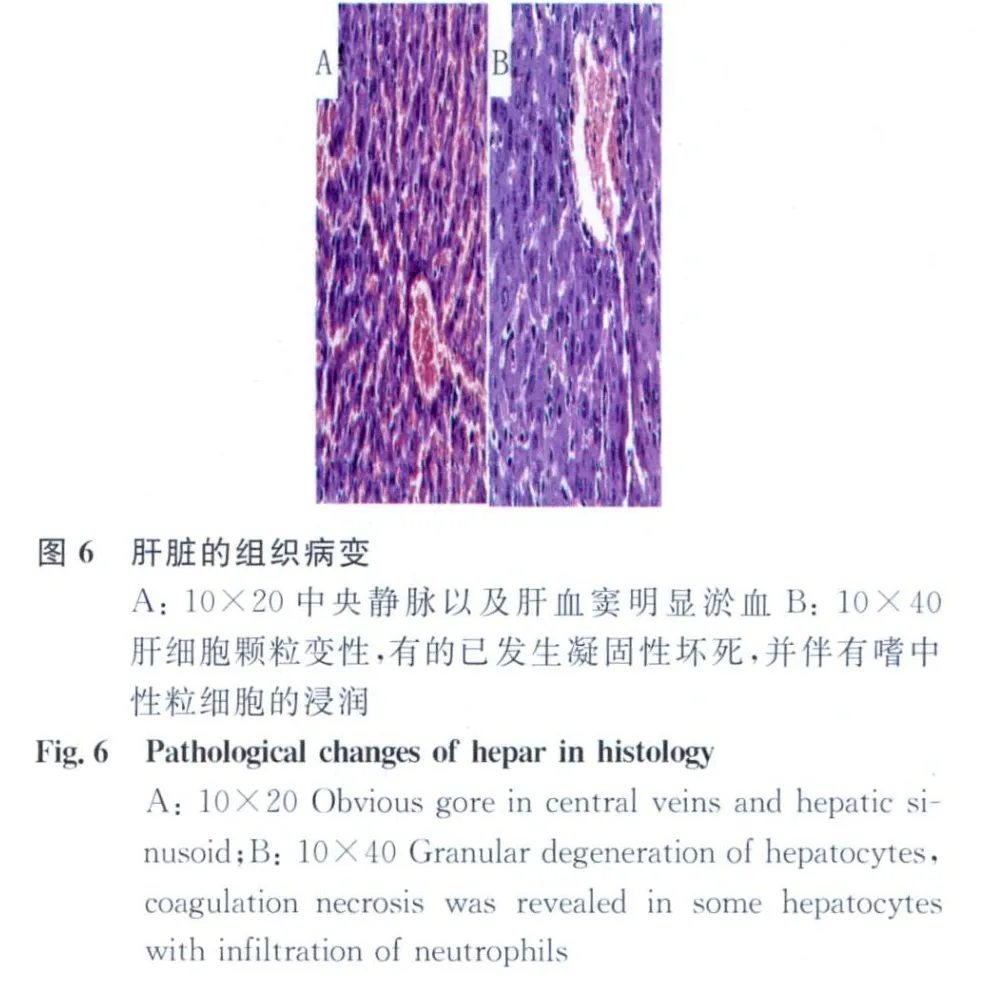
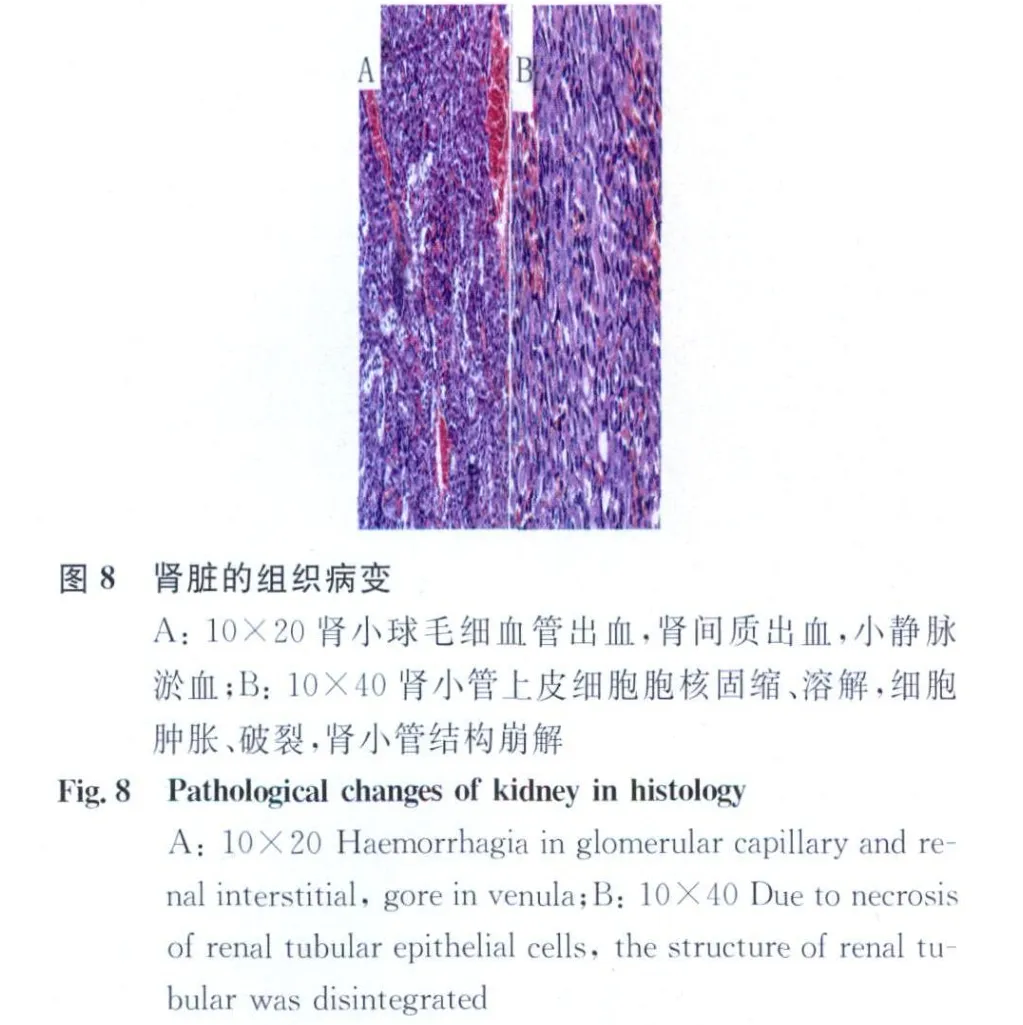
2.2 组织病理变化 小鼠肺部出现以充血、出血以及炎性细胞大量炎性细胞浸润为主的病理变化,见图5。肝脏中央静脉以及肝血窦明显淤血,肝细胞颗粒变性,后期发生凝固性坏死,并伴有大量嗜中性粒细胞的浸润,见图6。脾脏大量炎性细胞增生,包括多核巨细胞、嗜中性粒细胞、单核巨噬细胞增生,见图7。肾脏的肾小球毛细血管出血,肾间质出血,肾小管上皮细胞胞核固缩、溶解,细胞肿胀、破裂,肾小管结构崩解,见图8。
2.3 分离细菌的形态特征及培养特性 37℃恒温培养24h后,在血琼脂培养基上形成表面光滑、透明、圆形、湿润、边缘整齐、针尖大小的露滴样的无色小菌落,直径约1mm。并且在菌落周围形成明显的β溶血环,直径3~5mm。在血清肉汤试管底部形成絮状沉淀,上部澄清。显微镜检查均为革兰氏阳性球菌,鲜血琼脂平板培养物中多呈2~5个短链状排列,血清肉汤培养物呈长链状排列。


2.4 生化试验 生化糖发酵管的结果与猪链球菌的生化特性相符,见表2,说明该分离菌株为猪链球菌。

表2 生化试验结果T able 2 Result of biochemistry properties test

2.5 16s RNA鉴定 经过PCR扩增出现了一条约1500bp的条带,与预期片段大小相当,见图9。PCR产物经纯化后,连接pMD-18T载体,经菌落PCR和质粒载体双酶切鉴定后(图10),挑选阳性克隆送测序。将所得测序结果进行Blast比对,其16s RNA与Streptococcussuis P1/7(AM946016.1),Streptococcus suis SC84(FM252031.1)以及 Streptococcus suis BM407(FM252032.1)等菌株的16s RNA同源性达99%,仅有几个碱基差别,再次证明该菌株为猪链球菌。
2.6 药敏试验 12种药物所形成的抑菌圈的直径见如表3。从不同药物产生的抑菌圈的直径可以看出:所用的12种药物对猪链球菌均有不同程度的抑菌作用。该菌株对先锋霉素Ⅴ、先锋霉素Ⅵ、头孢呋肟、氯霉素、红霉素、青霉素、氨苄青霉素、羧苄青霉素、苯唑青霉素和氧哌嗪青霉素高度敏感,而对新霉素中度敏感,对四环素耐药。



表3 药敏试验结果Table 3 Sensitivity to antibiotics
3 讨 论
随着集约化养猪业的发展,猪链球菌感染及流行严重威胁着世界各国的生猪养殖业,导致巨大的经济损失。2005年四川所暴发的人-猪链球菌病疫情更是引起了社会的广泛关注。因而建立合适的动物模型,对于展开猪链球菌的致病机理及免疫机制等的深入研究就显得尤为重要。小鼠因其具有遗传背景清楚,个体差异小,饲养管理方便,费用相对低廉以及实验技术相对成熟等优点,所以成为大多数研究者优先考虑的实验动物。Daminguez-Punaro等[12]在以猪链球菌血源性感染CD1小鼠成功建立感染模型的基础上,又进一步建立了C57BL/6和A/J小鼠模型,并进行了对比试验,发现两种小鼠对猪链球菌都敏感,A/J小鼠在早期感染中更为敏感,说明小鼠可以作为猪链球菌感染的动物模型。
本研究中,通过分离细菌的形态观察、培养特性、生化试验和PCR鉴定结果,表明小鼠确由感染猪链球菌致死,体内各组织器官病变均由感染猪链球菌而引起。通过解剖和组织学观察,发现小鼠全身皮肤、浆膜、粘膜及各主要器官发生不同程度的出血与淤血,即在BALB/c小鼠上成功模拟出典型的败血症病变,说明BALB/c小鼠能够作为良好的实验室研究猪链球菌的感染动物。值得一提的是,小鼠感染猪链球菌后,在各主要器官发生大量嗜中性粒细胞、淋巴细胞以及单核巨噬细胞等炎性细胞浸润时,脾脏的淋巴细胞却在减少。这可能是由于在发生急性脾炎时,脾脏的淋巴细胞、网状内皮细胞发生弥漫性或局灶性的坏死、崩解,致使脾脏固有的组织细胞成分明显减少,增生的嗜中性粒细胞与单核巨噬细胞除了要清除病原菌外,还要吞噬、清除坏死区崩解、破碎后的细胞成分,所以在显微镜下观察脾脏的实质结构发生了明显的变化。
根据药敏试验的结果可以知道,通常的抗革兰氏阳性菌的药物对该株猪链球菌均有一定的作用,但是四环素与氨基糖苷类的新霉素效果不佳,可能是由于该株猪链球菌对四环素与新霉素产生了耐药性。红霉素、氯霉素、青霉素类、头孢菌素类药物的效果十分良好,可以用于临床上对患病动物的治疗。但是,由于各地各个猪场猪链球菌的流行情况与平常用药的情况不尽相同,所以此药敏试验的结果仅供参考。再次,在治疗时应根据患病动物的症状,正确的选择特异有效的抗生素,注意用药剂量和疗程,不能滥用抗生素。
目前为止,虽然已有许多有关猪链球菌动物感染模型的报道,各类动物模型各有特点,但是对于动物模型的选择还是没有定论。所以,还要不断地对猪链球菌的动物感染模型进行研究,改良出能更真实地反映猪链球菌感染后各种病理生理变化过程的动物模型,更好地开发出防治猪链球菌的药物和疫苗,来更有效地防控猪链球菌病的危害。
[1]Gottschalk M,Xu J,Calzas C,et al.Streptococcus suis:a new emerging or an old neglected zoonotic pathogen[J].Future Microbiol,2010,5(3):371-391.
[2]Baums CG,Verkuhlen GJ,Rehm T,et al.Prevalence of Streptococcus suis genotypes in wild boars of Northwestern Germany[J].Appl Environ Microbiol,2007,73(3):711-717.
[3]Dupas D,Vignon M.Streptococcus suis meningitis:A sever noncompensated occupational disease[J].Occup Med,1992,34:1102-1105.
[4]Wertheim HF,Nghia HD,Taylor W,et al.Streptococcussuis:an emerging human pathogen[J].Clin Infect Dis,2009,48(5):617-625.
[5]朱善冰,林上统.浙江省苍南县首例人感染猪链球菌病流行病学调查[J].上海预防医学杂志,2008,20(12):577-578.
[6]熊忠良,徐涤平.我国重大动物疫病流行现状及其防控策略[J].湖北畜牧兽医,2007,12:22-24.
[7]万遂如.人兽共患病的现状与防制(十)猪链球菌2型流行与公共卫生安全[J].动物保健,2005,8:22-23.
[8]姚火春.兽医微生物学实习指导[M].2版.北京:中国农业出版社,2002:20-21.
[9]Giovannoni SJ.(1991)T he poly merase chain reaction.In:Sequencing and Hybridization Techniques in Bacterial Systematics.Stackebrandt E,and Goodfellow M.(eds).New Yo rk:John Wiley&Sons,pp:177-201.
[10]陆承平.兽医微生物学[M].3版.北京:中国农业出版社,2001:204-212.
[11]王双山,张敬礼,袁逢新.猪链球菌的分离鉴定[J].中国畜牧兽医,2007,34(1):108-109.
[12]Dominguez-Punaro ML,Segura M,Radzioch D,et al.Comparison of the susceptibilities of C57BL/6 and A/J mouse strains to Streptococcus suis serotype 2 infection[J].Infect Immun,2008,76(9):3901-3910.

