巯基壳聚糖性能的体外评价*
吕占国 王立强
1.解放军第二○二医院,辽宁沈阳110016;2.华侨大学分子药物学研究所,福建泉州362021
目前,药学研究中广泛应用合成的巯基壳聚糖(TGA)是一种新型的膜黏性聚合物,生物相容性和黏附性好是其最大特点。在未来药用辅料的应用中,巯基壳聚糖作为一种功能性敷料应用前景十分广阔[1]。目前国外对巯基壳聚糖的研究表明,合成方法所得产物中巯基的最大含量仅为0.36%[2]。本研究尝试巯基壳聚糖不同的合成方法。结果表明,新的合成方法所得产物中的巯基最大含量达到7.56%,显著提高其黏附性和功能性。
1 材料与方法
1.1 药品与试剂
巯基壳聚糖相对分子质量为(1.0~4.0)×105,巯基含量(%,w/w)为0.32%~7.56%,由本单位自制,批号091123。母鸡蛋白溶菌酶由中山大学生命科学学院提供。其他试剂均购买于沈阳市化学试剂公司。
1.2 仪器
采用日本岛津公司生产的FTIR-8201红外光谱和UV-160A紫外可见光谱仪,DELTA-320-S pH剂(梅特勒-托利多仪器上海有限公司);荧光显微镜(Hitachi,日本)。
1.3 考察溶胀性能
溶胀性能主要体现在吸水能力上,本方法通过重量法来测定溶胀性能[3]。分别取30 mg不同巯基含量的冻干巯基壳聚糖和对照品均匀压成平片,每片直径为5.0 mm。在制备平片的过程中保持压力不变。在钉上将平片固定,放进磷酸盐缓冲液(37℃ pH6.0的100 mmol/L)中吸水溶胀。从孵化介质中取出钉上的溶胀测试片,用重量法在预定的时间间隔内测试其吸水量。
1.4 分析
通过溶菌酶降解壳聚糖和巯基壳聚糖[5],将400 mg壳聚糖在2.6 mL(0.1M)盐酸和7.4 mL去离子水中溶解,得到的3%壳聚糖溶液再用离子水对其进行透析,调节pH值至5.0。同时,新配制100 mmol/L的醋酸盐缓冲液,制备浓度为3%的冻干巯基壳聚糖溶液,pH调至5.0。然后将鸡蛋白溶菌酶分别加入各个样品中,使其最终浓度达到2.0 mg/mL。取1 mL混合物,用锥板式黏度计在(25.0±0.5)℃时测其在预定时间内的黏度。锥板式黏度计连接到设置分析参数的电脑后,通过the Phoe Win Pro 2.64程序来处理实验过程和数据记录[5]。通过同样方法为对照品(不含溶菌酶的聚合物)进行分析。
2 结果
2.1 溶胀性能考察
片剂(30 mg),未经修饰的对照品壳聚糖盐酸盐(■)、巯基壳聚糖(巯基含量0.32%)(●)、巯基壳聚糖(巯基含量1.31%)(▲)、巯基壳聚糖(巯基含量5.56%)(▼)在100 mmol/L,pH6.0,37℃磷酸盐缓冲液中的溶胀过程。与未经修饰的壳聚糖盐酸盐溶液相比较,三个实验组均显示显著性差异(P<0.01)。见图1。
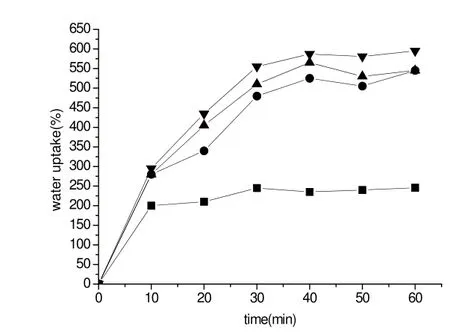
图1 经修饰壳聚糖与未经修饰壳聚糖在磷酸盐缓冲液中的溶胀过程比较
2.2 壳聚糖和巯基壳聚糖的降解结果比较
至少通过4个实验取标准偏差值。与未经修饰的壳聚糖盐酸盐溶液相比较,4个实验组差异均有统计学意义(P<0.01)。见图2。
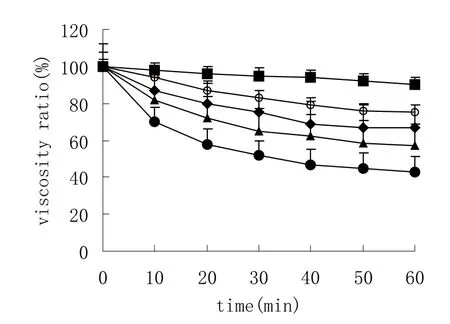
图2 比较溶菌酶对壳聚糖和巯基壳聚糖的降解
3 讨论
如图1所示,受试片在水中的水化过程中表现出较高的黏结性和稳定性,相比对照组TGA的键合对壳聚糖的溶胀行为没影响。相反,修饰、未透析的壳聚糖-盐酸盐的溶胀行为与未修饰的壳聚糖-盐酸盐的对照底物相比存在差异。形成这种差异的原因被认为是壳聚糖的构象在和1%氯化钠溶液和酸溶液中透析时发生了变化。
从图2中可见,温度是影响壳聚糖自动降解的唯一因素,通常在25℃进行降解研究操作。在加了溶菌酶后,壳聚糖在经修饰和经修饰两种情况下,其黏性减少程度非常相似,60 min内测得2种形式的壳聚糖黏度均减少了60%。在人体内各种体液和组织中都能找到这种能降解壳聚糖的溶菌酶,例如血清、眼泪和黏膜中[6]。降解速度受偶合率的影响,偶合率越高则降解越慢。因为TGA对酶有抑制作用,溶菌酶的活性在巯基壳聚糖中降低,加酶的偶合物比未经修饰聚合物的降解速度慢,可能是由于酶中二硫键与聚合物的巯基相互作用的结果。
巯基壳聚糖在新反应条件下合成后,巯基含量显著提高,其膜黏性、溶胀性等也同时随着巯基含量的增加而提高。尽管在现有条件下经过化学修饰,但是所得产物的可降解性改变却不是十分明显,预示着巯基壳聚糖既有良好的生物相溶性,同时具有安全性,这个发现具有一定的特殊意义。
[1]Bernkop SA,Schwarz V,Artursson P,et al.Polymers with thiol groups:a new generation of mucoadhesive polymers?[J].Pharm Res,2004,16(6):876-881.
[2]Bernkop SA,Steininger S.Synthesis and characterisation of mucoadhesive thiolated polymers [J].Int J Pharmaceutics,2000,194(2):239-247.
[3]Snyder GH,Reddy MK,Cennerazzo MJ,et al.Use of local electrostatic environments of cysteines to enhance formation of a desired species in a reversible disulfide exchange reaction[J].Biochim Biophys Acta,2003,749(219):26.
[4]Artursson P,Lindmark T,Stanley S,et al.Effect of chitosan on the permeability of monolayers of intestinal epithelial cells[J].Pharm Res,2004,11(9):1358-1360.
[5]Illum L,Farraj NF,Davis SS.Chitosan as a novel nasal delivery system for peptide drugs[J].Pharm Res, 2001,23(9):48-51.
[6]Bernkop SA,Biebel RG,Scholler S.Development of controlled drug release systems based on thiolated polymers[J].J Controll Rel,2000,166(1):39-48.

