灰树花多糖的分步酶解法提取工艺研究1)
韦朝阳,徐财泉,茆广华,叶长文,吴应淼,李卫旗*
(1.浙江大学生命科学学院,杭州 310058;2.浙江方格药业有限公司;3.浙江庆元县食用菌科学技术研究中心)
灰树花(Grifolafrondosa)属担子菌亚门、多孔菌科、树花属。又名、栗子蘑、莲花菌、千佛菌、云蕈。日本称舞茸、叶状奇果菌。是食、药用菌。灰树花子实体具有独特的芳香味,口味鲜美,富含多种维生素、矿物质与生物活性物质,是近年来我国和日本正在推广的一种珍贵食、药兼用真菌[1]。自1984年 Ohno等[2]报道了灰树花多糖具有抗肿瘤活性以来,对灰树花多糖的化学结构及保健功能的研究已逐步展开,其对人体良好的生理功能调节作用也逐渐被人们认识。大量的药理分析与临床实验证实,灰树花多糖具有明显的抗肿瘤、改善免疫系统功能、抗HIV病毒、调节血糖、血脂及胆固醇水平,对防止癌细胞的生成和转移、高血压、肥胖症、糖尿病、艾滋病及免疫系统功能的紊乱都有一定的疗效。特别是其抗肿瘤活性,日本医学专家用灰树花多糖进行抗肿瘤实验结果表明,灰树花多糖的抑瘤率可达86.2%,比国际公认的抗癌新药香菇多糖抑制率高32%[3]。对灰树花多糖的分离提取,传统的方法是对子实体热水浸提后再用乙醇沉淀。
由于灰树花中含有大量的纤维素﹑果胶﹑蛋白质等非多糖类大分子物质,形成了较为致密的子实体结构,大大阻碍了多糖在浸提过程中的释放。进而人们使用含纤维素酶﹑果胶酶﹑蛋白酶等生物酶类组合的复合酶制剂对灰树花子实体进行处理,以降解非多糖类物质,使细胞内外的多糖更有效地被提取出来[4]。由于不同的酶类达到最高酶活力所需的酶解温度和酶解时间等条件各不相同,一次性地使用复合酶制剂对多糖提取效果的改善仍不理想。因此,本文在优化各单一酶的作用条件下,将灰树花子实体干粉依次采用纤维素酶﹑果胶酶﹑蛋白酶分步处理,使每种酶的活力得到充分发挥,从而最大程度地提高灰树花多糖提取率和纯度。
1 材料与方法
1.1 材料
灰树花子实体(去柄),由浙江方格药业有限公司提供。
1.2 试剂
纤维素酶,上海伯奥生物试剂厂;木瓜蛋白酶,四川攀枝花市酶制剂厂;果胶酶,Fluka公司产品;其它试剂均为国产分析纯试剂。
1.3 灰树花多糖的热水浸提
取100g灰树花子实体干燥粉碎后,加入2000mL蒸馏水90℃下浸提4h,真空抽滤后滤液浓缩至原体积的1/10,向浓缩液中加入其4倍体积的95%乙醇,搅拌后静止12h,3000rpm离心10min,去除上清液,沉淀用无水乙醇和丙酮交替润洗两次60℃烘干后得灰树花粗多糖,称重。
1.4 灰树花多糖的酶法提取
取100g灰树花子实体干燥粉碎后,加入2000mL蒸馏水,常温浸泡2h,调整pH值和温度至设定值,加入设定量的酶制剂,按设定时间进行酶解,真空抽滤后滤液浓缩至原体积的1/10,向浓缩液中加入4倍体积95%乙醇,搅拌后静止12h,3000rpm离心10min,去除上清液,沉淀用无水乙醇和丙酮交替润洗两次,60℃烘干后得灰树花粗多糖,称重。
1.5 灰树花多糖的分步酶解法提取
首先采用纤维素酶﹑果胶酶﹑木瓜蛋白酶分别单独对灰树花子实体样本进行酶解提取多糖,计算各自的多糖提取率,获得各种酶的最佳工艺参数。然后在各种酶的最佳工艺条件下,依次采用三种酶对同一灰树花子实体样本进行分步处理,最终计算多糖的提取率,并与热水浸提法及单一酶法提取灰树花粗多糖提取率的结果进行对照。本实验对三种酶的四个工艺条件因素设定如下:因素A(相对灰树花原料的加酶量,%),因素B(酶解温度,℃),因素 C(酶解pH值),因素D(酶解时间,h)。参照各种酶产品说明书提供的酶活条件范围,各因素设置三个水平,采用四因素三水平的L9(34)正交表设计因素水平表,以多糖的提取率为指标,通过极差分析,确定各种酶的最佳工艺组合。
1.6 多糖提取率公式
多糖提取率=(粗多糖质量/灰树花粗粉质量)×100%
1.7 多糖的纯化与光谱分析
灰树花多糖的纯化采用Sevag法[5-6];样品水溶液在200~400nm区间722型光栅分光光度计扫描进行紫外光谱分析;红外光谱分析采用Specerd IP红外光谱仪,KBr压片。
2 结果与分析
2.1 纤维素酶提取灰树花多糖的工艺条件优化
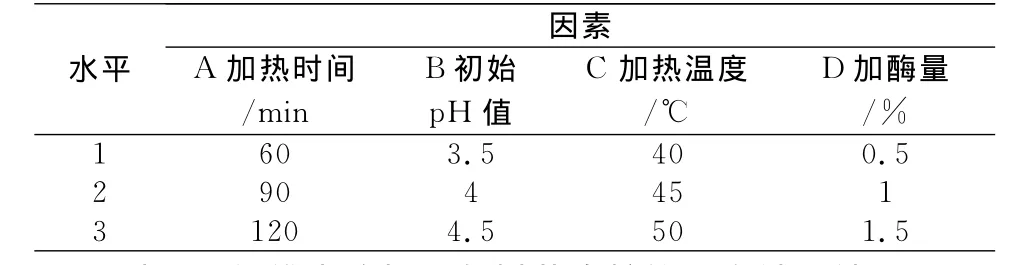
表1 纤维素酶正交试验因素水平表
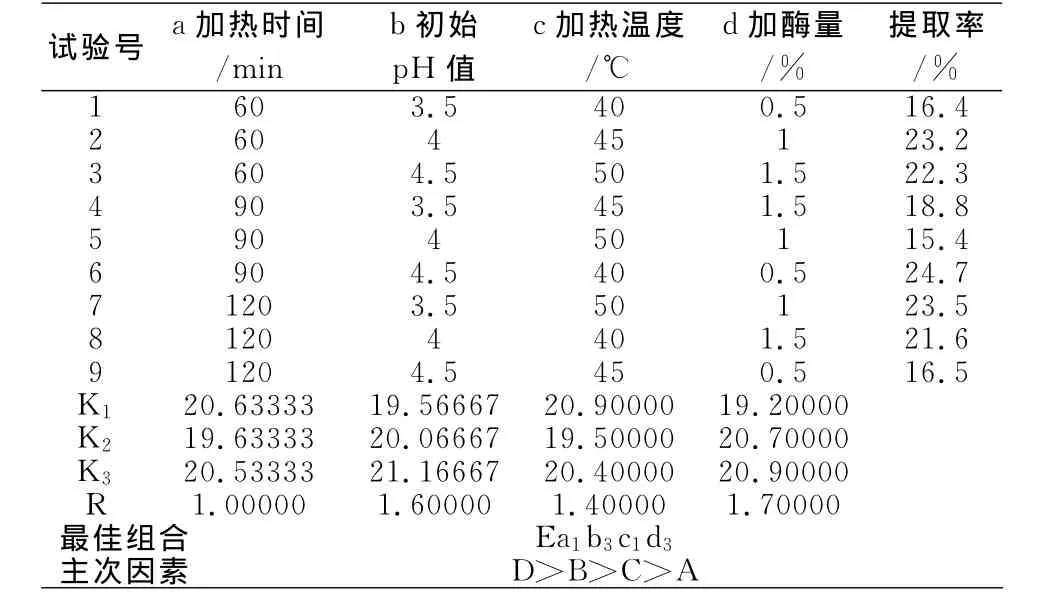
表2 纤维素酶提取灰树花多糖的正交试验结果
对纤维素酶设定的工艺因素水平见表1。以多糖提取率为指标进行正交试验,结果见表2。由正交试验表的极差分析看出,其中各因素对提取率的影响顺序依次为:d加酶量>b初始pH值>c加热温度>a加热时间。由直观分析得到最佳纤维素酶提取工艺组合为Ea1b3c1d3,即当加热时间为60min,初始pH值调至4.5,加热温度40℃,加酶量为1.5%。实验证明,在此条件下,灰树花多糖提取率可达23.41%。
2.2 果胶酶提取灰树花多糖的工艺条件优化
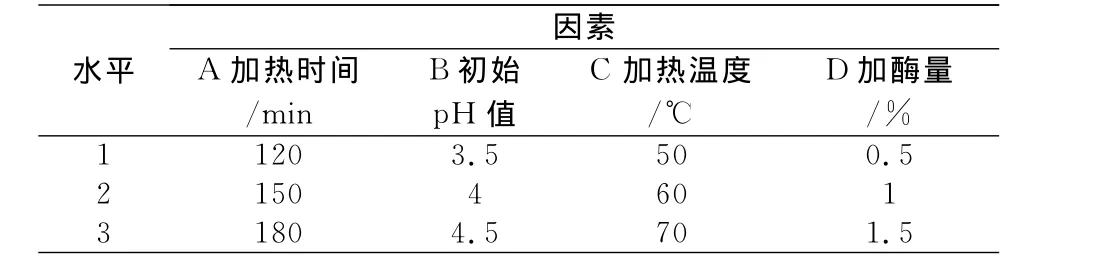
表3 果胶酶正交试验因素水平表
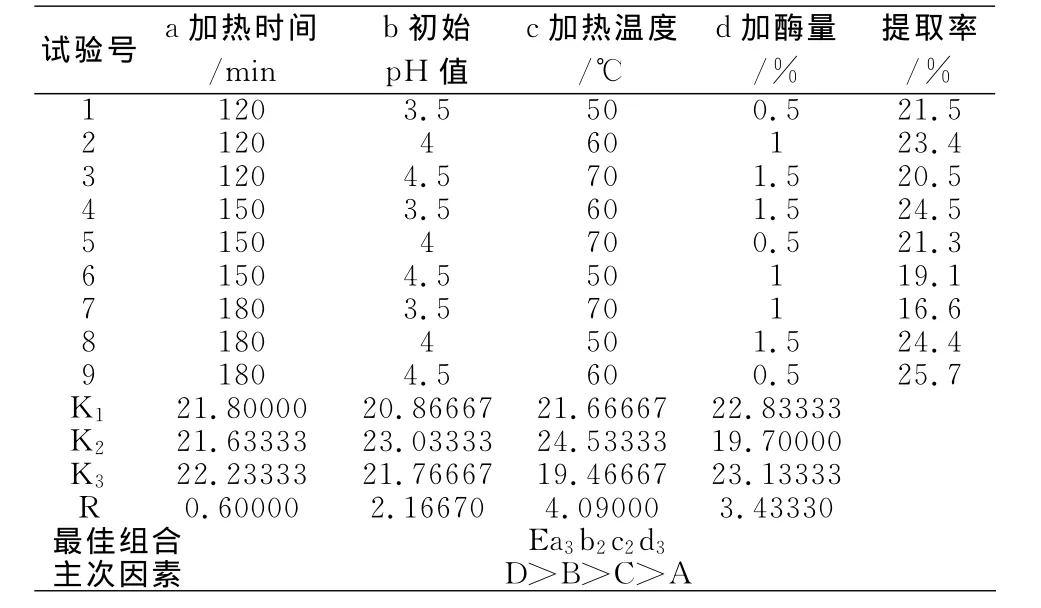
表4 果胶酶提取灰树花多糖的正交实验结果
由正交试验表的极差分析看出,其中各因素对提取率的影响顺序依次为:c加热温度>d加酶量>b初始pH值>a加热时间。由直观分析得到最佳果胶酶提取工艺组合为Ea3b2c2d3,即当加热时间为180min,初始pH值调至4,加热温度60℃,加酶量为1.5%。实验证明,在此条件下,灰树花多糖提取率可达24.53%。
2.3 木瓜蛋白酶提取灰树花多糖的工艺条件优化
对木瓜蛋白酶设定的工艺因素水平见表5,以多糖提取率为指标进行正交试验,正交试验结果分析见表6。
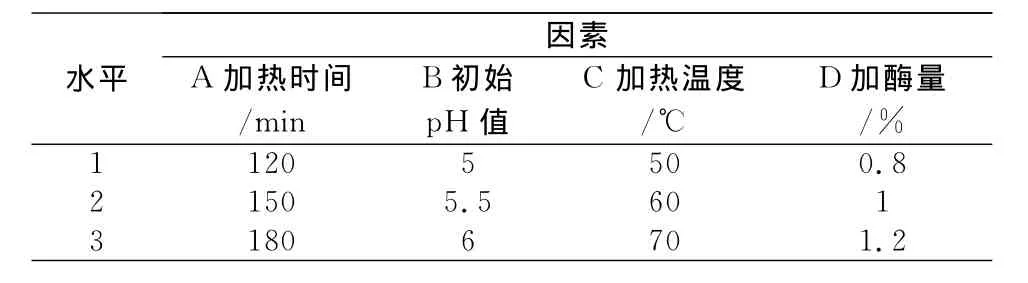
表5 木瓜蛋白酶正交试验因素水平表
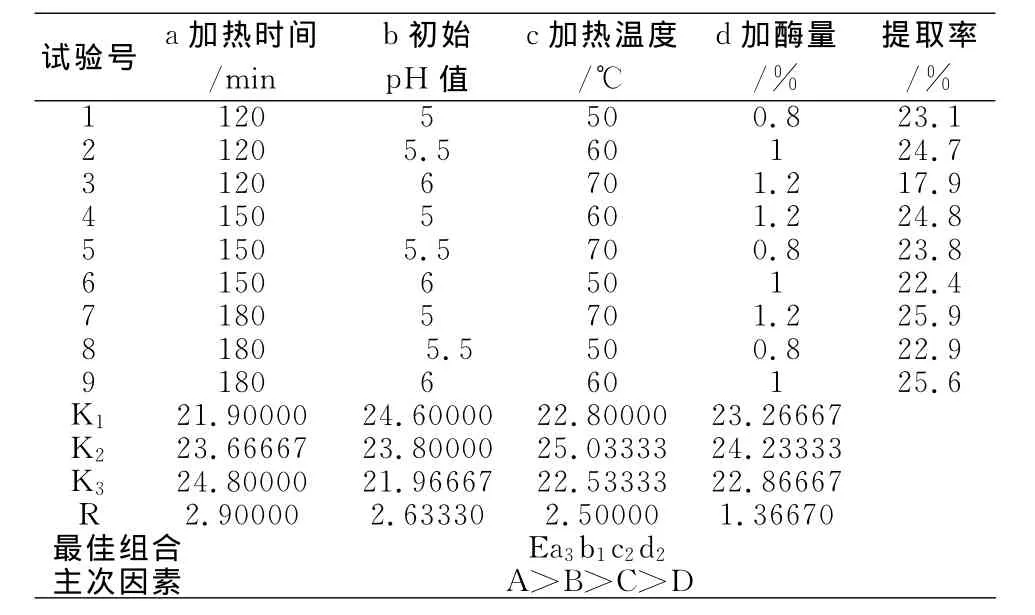
表6 木瓜蛋白酶法提取多糖的正交实验结果
表6结果表明,对木瓜蛋白酶而言,因素A(加热时间)的极差值最大,对多糖的提取率影响最大,因素D(加酶量)影响最小。由直观分析得到最佳果胶酶提取工艺组合为Ea3b1c2d2,即当加热时间为180min,初始pH值调至5,加热温度60℃,加酶量为1.0%。实验证明,在此条件下,灰树花多糖提取率可达25.78%。
2.4 分步酶解法提取的粗多糖提取率对比试验
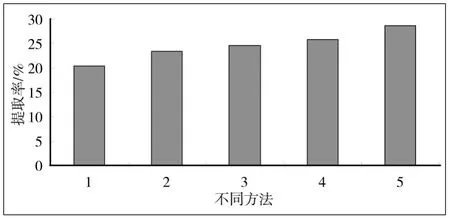
图1 多种提取方法的多糖提取率比较
采用以上3种酶的最佳工艺条件依次对同一批灰树花子实体样品进行处理后,并与热水浸提法及单一酶法提取灰树花粗多糖提取率的结果进行对照,结果如图1。由图1可知,相对热水浸提法,3种单一酶提取灰树花子实体多糖都不同程度地提高了多糖的提取率。采用3种酶依次对同一批灰树花子实体样本进行分步处理后(即分步酶解法提取多糖),粗多糖提取率有了显著提高。对照热水浸提法的多糖提取率为20.38%,依次采用纤维素酶﹑果胶酶﹑木瓜蛋白酶分步酶解法提取灰树花多糖的提取率达28.62%,提高了40.4%。由此可见在对灰树花子实体中的纤维素、果胶及游离蛋白等非多糖类大分子进行充分酶解后,细胞内外的多糖成分获得了有效的释放。
2.5 灰树花多糖的紫外光谱分析
将热水浸提的粗多糖和分步酶法提取获得的粗多糖各进行5次Sevag法去蛋白萃取处理后,获得提纯后的灰树花多糖样品1和样品2,作紫外光谱分析,结果如图2、图3。由图2、图3可见,样品1在280nm波长处仍有明显吸收峰,说明由热水浸提法提取的粗多糖中由于结合蛋白较为牢固,经Sevag法去蛋白处理后仍不能完全去除。而样品2在280nm波长处已没有吸收峰,说明由分步酶解提取法提取的粗多糖中的结合蛋白在经Sevag法去蛋白处理后即能较完全地去除,多糖纯度得以提高[7]。
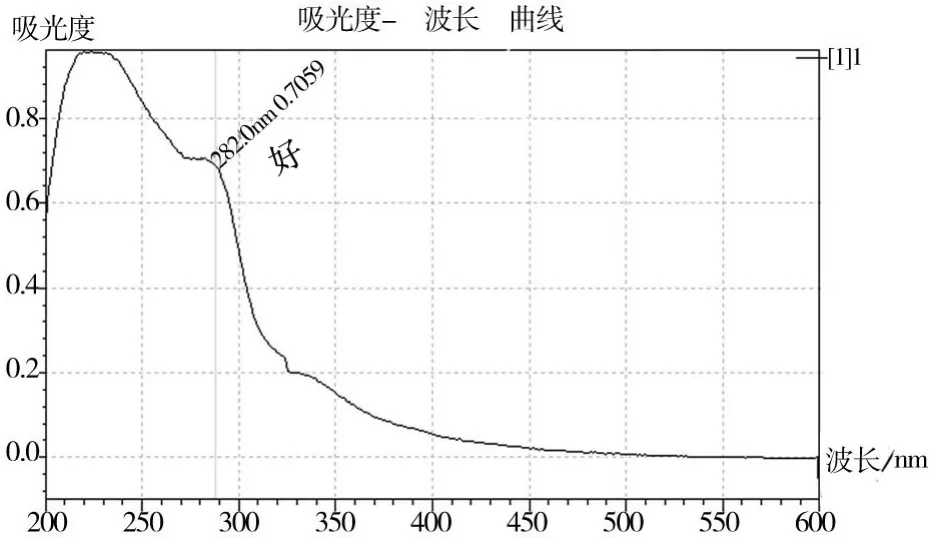
图2 样品1的紫外光谱
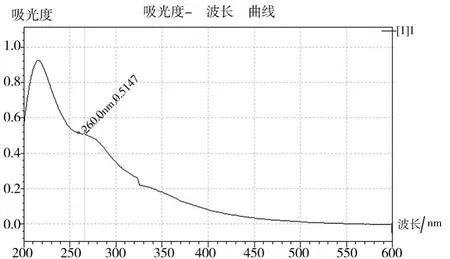
图3 样品2的紫外光谱
2.6 灰树花多糖的红外光谱分析
将提纯后的灰树花多糖样品2再进行红外光谱测试,图4为其红外图谱。图4中的峰很好地反映了灰树花多糖的β-葡聚糖的特性。3422cm-1出现一宽峰表示有O-H的伸缩振动,2927cm-1的弱吸收是C-H的特征峰,1634cm-1是C=O的伸缩振动造成的1389cm-1的峰是 C-H 的变角振动,1250cm-1~950 cm-1的这组强吸收峰是吡喃糖环的醚键(C-O-C)和羟基的吸收峰。化合物分子在红外光谱图谱上的每一个吸收峰,都对应于分子中原子或官能团的振动情况。不同的分子具有一系列不同的吸收峰。多糖化合物在红外光谱图中具有一些特征峰,利用这些特征峰就能够确定多糖的一些基本结构。以上红外光谱的基本信息与作为吡喃型β-葡聚糖的灰树花多糖的一些基本结构的信息是完全符合的。
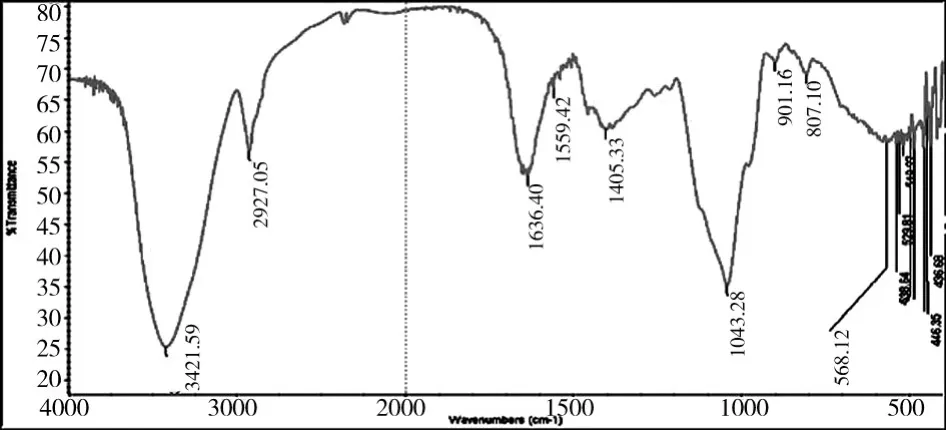
3 讨论
本实验结果表明,利用纤维素酶﹑果胶酶﹑木瓜蛋白酶在各自的最佳酶解条件下分步处理灰树花子实体后,多糖能有效地得到释放,灰树花粗多糖的提取率可达28.62%,比传统的热水浸提法要提高40.4%,灰树花多糖提取率得到大幅提高,从而为灰树花多糖的高效提取提供了一种新的工艺。通过紫外光谱扫描分析表明,经分步酶解法提取灰树花多糖中的蛋白含量远低于热水浸提法提取的灰树花多糖,多糖纯度明显提高。通过红外光谱检测结果显示,经分步酶解法提取的灰树花多糖含有吡喃型β-葡聚糖的结构,与常规提取方法所得的灰树花多糖具有一致的结构特征。
[1]李小定,荣建华,吴谋成.灰树花多糖药理研究进展[J].天然产物研究与开发,2003,15(4):364-369.
[2]Ohno N,Suzuke I,Oikawa S,et al.Effect of glucans on the antitumor activity of Grifolan[J].Chemical and pharmaceutical Bulletin,1986,34(5):2149-2151.
[3]边衫,叶波平,奚涛,等.灰树花多糖的研究进展[J].药物生物技术,2004,11(1):60-63.
[4]Ohno N,Adachi Y,Suzuki L,et al.Characterization of the antitumor glucan obtained from liquid-cultured Grifola frondosa[J].Chemical and pharmaceutical bulletin,1986 ,34(4):1709-1715.
[5]张惟杰.糖类复合物生化研究技术[M].杭州:浙江大学出版社,1994:87-95.
[6]陈石良,孙震,谷文英,等.灰树花深层发酵菌丝体多糖的酶法提取及其抗肿瘤作用[J].无锡轻工业学报,2000 ,19(4):732-738.
[7]刘红梅,李栋,樊梦丹,等.灰树花多糖的复合酶-微波提取、超滤纯化及生物学评价[J].中成药,2011,33(4):594-560.

