硬溶质型桃果实成熟过程中细胞壁多糖降解特性及其相关酶研究
阚 娟,刘 涛,金昌海,*,谢海艳
硬溶质型桃果实成熟过程中细胞壁多糖降解特性及其相关酶研究
阚 娟1,刘 涛1,金昌海1,*,谢海艳2
(1.扬州大学食品科学与工程学院,江苏 扬州 225127;2.扬州大学生物科学与技术学院, 江苏 扬州 225009)
以硬溶质型桃‘晚湖景’为试材,研究细胞壁多糖降解以及细胞壁多糖降解相关酶对硬溶质型桃果实成熟软化的影响。结果表明:硬溶质型桃果实成熟过程中,CDTA-1果胶含量上升,两种Na2CO3溶性果胶含量在成熟末期减少率分别为22.5%和27.4%。KOH溶性果胶含量在整个成熟过程中变化不明显。果实CDTA、Na2CO3组分中果胶多糖主链的断裂、半纤维素和纤维素组分中阿拉伯糖和半乳糖的降解主要发生在成熟末期;β-半乳糖苷酶(β-Gal)与桃果实成熟软化启动密切相关,多聚半乳糖醛酸酶(PG)和纤维素酶(Cx)对桃果实成熟后期快速软化起重要作用。Na2CO3-1溶性果胶多糖的降解与硬溶质型果实采后软化密切相关,KOH-1、KOH-2半纤维素多糖的降解可能促进硬溶质型桃果实成熟软化进程,富含半乳糖醛酸的果胶多糖主链的断裂以及果胶、半纤维素、纤维素中阿拉伯糖、半乳糖等中性糖的降解都可能是果肉软化的重要因素,并有多种多糖降解酶参与其中。
桃;成熟软化;细胞壁多糖;单糖组成
桃果实成熟过程中果肉硬度下降可分为两个阶段,在成熟早期,果肉硬度不断下降但很慢;在成熟的后期,果肉硬度下降很快,这一阶段也被叫做“溶质”阶段[1]。桃根据果肉结构常被分为两大类:溶质型桃和硬肉型桃(stony-hard-flesh)。而溶质型桃又细分为软溶质型(melting-flesh)和硬溶质型(non-melting-flesh)[2]。成熟的桃无论是软溶质型还是硬溶质型在其成熟过程中都会产生乙烯。软溶质型桃的特点是成熟过程中乙烯大量释放,果肉迅速软化,而硬溶质型桃的软化过程会受到更多的限制,成熟过程中乙烯释放一直很少,软化过程缓慢,果肉坚硬,直到后期在溶解的时候,才会通过不停的释放乙烯来加速其软化,有着很高的保鲜品质,在市场上的流通时间和供货期比普通的软溶质型水蜜桃明显延长。目前,对桃果实的研究主要集中在软溶质型桃果实,系统全面的研究硬溶质型桃果实成熟过程中各细胞壁多糖组分的降解特性以及相关降解酶在桃果实软化中的作用鲜有报道。本实验以硬溶质型桃‘晚湖景’为试材,分析细胞壁多糖降解以及细胞壁多糖降解相关酶对硬溶质型桃果实成熟软化的影响,探讨硬溶质型桃果实成熟软化的机理,为完善桃果实成熟软化机理及延长贮藏期的研究提供一定的理论基础。
1 材料与方法
1.1 材料与处理
供试桃品种为‘晚湖景’,采自无锡阳山,分批采收后即刻运抵实验室,剔除病果、伤果,选取大小相近的按成熟度不同分为四组。
成熟度Ⅰ:表示成熟前期,果皮颜色白绿,基部很硬;成熟度Ⅱ:表示开始成熟,果皮颜色黄带微红,基部很硬;成熟度Ⅲ:表示中等成熟,果皮颜色有二分之一左右为红色,基部很硬;成熟度Ⅳ:表示完全成熟,果皮颜色全红,基部较硬。
在采收当天去掉果皮和果核,将果肉部分切成小块,用液氮处理后装在聚乙烯薄膜塑料袋中,并立即保存于-80℃超低温冰箱中用于试验分析。
1.2 试剂与仪器
对硝基酚半乳糖苷、对硝基酚、多聚半乳糖醛酸、D-半乳糖醛酸 美国Sigma公司;鼠李糖、半乳糖醛酸、岩藻糖、CDTA 瑞士Fluka公司;阿拉伯糖 上海悦耳化学品有限公司;木糖、甘露糖、半乳糖、葡萄糖、肌醇为色谱纯;甲醇为优级纯;氢氧化钾、吡啶、三甲基氯硅烷、六甲基二硅胺烷、乙酰氯、乙醇、氯仿、正己烷、丙酮、无水碳酸钠、氯化钠、硫酸铵、醋酸钠、硼氢化钠等为分析纯。
GY-1型果实硬度计 牡丹江市机械研究所;GC-14B型气相色谱仪 日本岛津公司;RE-52型旋转蒸发器 上海青浦沪西仪器厂;5804R型高速冷冻离心机 德国Eppendorf公司。
1.3 果实硬度的测定
采用果实硬度计(测头直径为3.5mm)测定去除果皮后果肉的硬度。
1.4 乙烯释放量的测定
参照Jin等[3]的方法。气相色谱条件为:FID检测器,SPB-1毛细管柱(0.25mm×30m,0.25μm),载气为N2,柱温40℃,检测器温度120℃,重复3次。
1.5 果实细胞壁物质(cell wall materials,CWM)提取
参照Rose等[4]的方法进行。
1.6 果实细胞壁多糖的分步提取
参照Brett等[5]和金昌海等[6]的方法。称取上步所得CWM 0.5g,依次用50mL 50mmol/L pH6.5环己二胺四乙酸(CDTA)于20℃振荡提取5、2h;50mL 50mmol/L Na2CO3(含20mmol/L NaBH4)溶液1℃通N2振荡提取20h,20℃通N2振荡提取2h,0.5、1.0、4.0mol/L KOH(含20mmol/L NaBH4) 20℃通N2振荡提取2h。每步所得混和物 4℃离心分离,上清液过滤,滤渣加入沉淀,沉淀用蒸馏水洗1次,水洗液加入上清中。上清液和最终所得不溶物(CWM-残渣) 4℃透析充分(透析袋分子质量截留值3500D)。35℃减压浓缩,冻干,称质量,分别得CDTA-1、CDTA-2、Na2CO3-1、Na2CO3-2、KOH-1、KOH-2、KOH-3、CWM-残渣8种细胞壁多糖物质。每样重复3次,结果用平均值表示。所提多糖样品真空干燥保存待分析。
1.7 细胞壁多糖中单糖组成色谱分析
参照Jin等[3]方法,采用GC-14B气相色谱仪,OV-1气相色谱柱(30m×0.25mm,0.33μm),FID检测器。载气N2,氢气流量60mL/min,进样量1μL,检测器及进样温度250℃。柱温采用程序式升温:起始柱温150℃,保持1min,10℃/min升至200℃,保持10min,5℃/min升至220℃,保持10min,5℃/min升至240℃,保持1min。用肌醇作为内标物。
1.8 酶活性测定
多聚半乳糖醛酸酶(polygalacturonase,PG)活性测定:参照Huber等[7]方法;果胶甲酯酶(pectin methylesterase,PME)活性测定:参照Hagerman等[8]方法;纤维素酶活性测定:参照Xu等[9]方法;β-半乳糖苷酶(β-Gal)活性测定:参照金昌海等[6]方法。
2 结果与分析
2.1 桃果实成熟过程中硬度和乙烯释放量的变化
果实硬度是反映果实质地的一个重要指标,也是反映果实成熟衰老的重要指标之一。如图1所示,硬溶质型桃果实在成熟前期硬度下降不明显,一直保持较高的硬度,到成熟度Ⅳ时迅速下降。表明硬溶质型桃硬度下降只出现在成熟末期。软溶质型桃果实在成熟中期硬度就开始迅速下降[10]。可以看出,硬溶质型与软溶质型桃果实相比,成熟过程中硬度有更长的保持期。
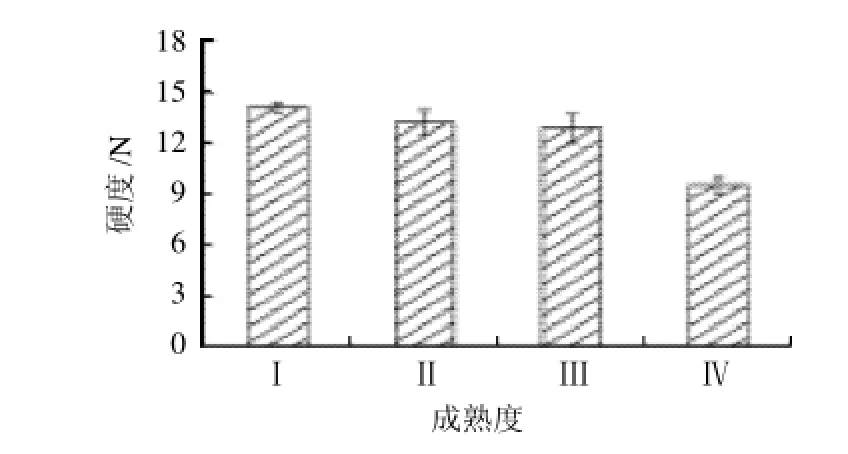
图1 桃果实成熟过程中硬度的变化Fig.1 Change in firmness during maturation of peach fruit
如图2所示,硬溶质型桃果实成熟过程中,成熟前期乙烯释放量很低,成熟度Ⅲ乙烯释放开始增加,到成熟度Ⅳ时乙烯释放显著增加,是成熟度Ⅱ乙烯释放量的14倍,乙烯释放量最高。硬溶质型桃果实同一时期乙烯释放量明显低于软溶质型[10],到成熟末期才有大量释放,而且乙烯释放高峰明显推迟。
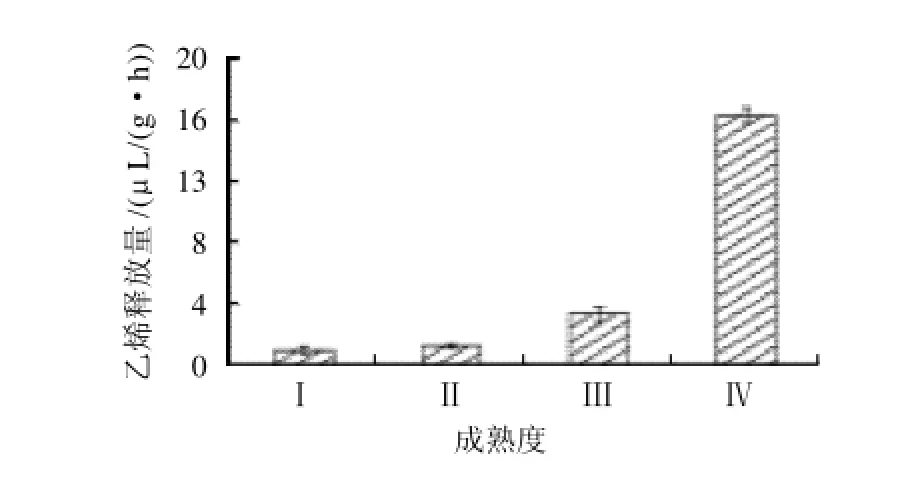
图2 桃果实成熟过程中乙烯释放量的变化Fig.2 Change in ethylene production during maturation of peach fruit
2.2 桃果实成熟过程中细胞壁多糖组分含量的变化

表1 桃果实成熟过程中细胞壁多糖组分含量的变化Table 1 Quantitative changes in various cell wall polysaccharides during maturation of peach fruit mg/100g
由表1可以看出,硬溶质型桃果实树体成熟过程中CDTA-1和CDTA-2溶性果胶多糖都逐渐增大。两种Na2CO3溶性果胶含量在成熟末期下降明显,减少率为22.5%和27.4%。KOH溶性果胶含量在整个成熟过程中变化不明显。由此看出,硬溶质型桃果实的软化特性与Na2CO3溶性果胶多糖等细胞壁多糖组分的降解密切相关。对软溶质型桃果实的研究发现[11],除了两种Na2CO3溶性果胶含量下降明显外,KOH-1、KOH-2、CWM-残渣等组分含量在果实成熟软化过程中也逐渐下降。
2.3 桃果实成熟过程中CDTA溶性果胶中单糖组成的变化
用50mmol/L CDTA提取的两种螯合剂溶性果胶主要为离子结合型果胶,20℃提取温度有利于最大限度地减少果胶在提取过程中的降解。CDTA-1组分主要为以Ca2+铰链的半乳糖醛酸聚糖主链,主链上间隔插入单个鼠李糖残基。而用CDTA溶液提取5h后,再在相同条件下提取2h所得的CDTA-2组分中还含有富含羟脯氨酸的糖蛋白。由表2可以看出,构成CDTA-1和CDTA-2溶性果胶多糖组分的单糖中半乳糖醛酸的含量明显高于其他单糖,且在成熟过程中发生了明显的降解。CDTA-1组分中半乳糖醛酸与鼠李糖含量比值由成熟度Ⅰ的17.18、成熟度Ⅱ的20.06、成熟度Ⅲ的17.5下降到成熟度Ⅳ的7.05,该比值在CDTA-2组分中由成熟度Ⅰ的11.98、成熟度Ⅱ的10.96下降至成熟度Ⅲ的7.63、成熟度Ⅳ6.88,说明在硬溶质型桃果实中,两种CDTA溶性果胶多糖中主链半乳糖醛酸的降解主要发生在成熟后期,而软溶质型桃果实成熟前期才是果胶主链半乳糖醛酸的快速下降时期[11]。衡量果胶多糖主链变化指标,即半乳糖醛酸与鼠李糖含量比值在CDTA-1、CDTA-2中随着果实硬度的下降而迅速下降。
构成细胞壁果胶多糖主链的半乳糖醛酸聚糖(homogalacturonan,HGA)是由半乳糖醛酸组成,鼠李半乳糖醛酸聚糖Ⅰ(rhamnogalacturonanI,RG-Ⅰ)是由半乳糖醛酸和鼠李糖组成,阿拉伯糖、半乳糖是构成RG-Ⅰ侧链的主要成分。分析结果表明,桃果实CDTA溶性果胶多糖组分中富含HGA主链和少量带有阿拉伯半乳聚糖、阿拉伯聚糖和半乳聚糖等侧链成分的RG-Ⅰ,说明桃果实细胞壁中多聚半乳糖醛酸与富含阿拉伯聚糖、半乳聚糖、阿拉伯半乳聚糖支链的鼠李糖半乳聚糖相互交联在一起[12-13]。果胶内半乳糖糖醛酸的支链富含阿拉伯糖、半乳糖。它们的解离,会分别导致阿拉伯糖与鼠李糖含量的比值、半乳糖与鼠李糖含量的比值的下降。 CDTA-1组分中阿拉伯糖与鼠李糖的比值由成熟度Ⅰ的7.82下降到成熟度Ⅳ的5.38。半乳糖与鼠李糖的比值由成熟度Ⅰ的13.59下降至成熟度Ⅳ的5.25。成熟末期支链阿拉伯糖和半乳糖都发生了明显的降解。CDTA-2组分中阿拉伯糖与鼠李糖的比值成熟度Ⅰ和成熟度Ⅳ分别为6.6和6.2,降解不明显。半乳糖与鼠李糖的比值由成熟度Ⅰ的10.37下降至成熟度Ⅳ的6.03。由此可见,在硬溶质型桃果实树体成熟后期CDTA溶性果胶中主链半乳糖醛酸,支链阿拉伯糖、半乳糖发生了明显的降解,明显滞后于软溶质型桃果实[11]。衡量果胶支链变化的指标,半乳糖与鼠李糖含量的比值以及阿拉伯糖与鼠李糖含量的比值在CDTA-1、CDTA-2组分中的下降也说明了果胶中半乳糖、阿拉伯糖这两种支链中性糖的降解与硬溶质型桃果实的成熟软化密切相关。

表2 桃果实成熟过程中CDTA溶性果胶多糖的单糖组分摩尔分数变化Table 2 Changes in monopolysaccharide composition of CDTA fractions during maturation of peach fruit %
2.4 桃果实成熟过程中Na2CO3溶性果胶中单糖组成的变化
用50mmol/L Na2CO3(含20mmol/L NaBH4)在不同温度下提取的多糖成分,主要为共价结合型果胶鼠李半乳糖醛酸聚糖,先在1℃条件提取该果胶,有利于消除以后碱提取操作中由β-消去而发生的多糖解聚。由表3可以看出,Na2CO3溶性果胶成分中含有大量半乳糖醛酸、阿拉伯糖、半乳糖等果胶特性单糖成分,证明了该果胶半乳糖醛酸和鼠李糖构成的主链上连接有富含阿拉伯糖、半乳糖的支链[12-13]。Na2CO3溶性果胶多糖成分的单糖类中半乳糖醛酸摩尔分数相对于CDTA溶性果胶多糖明显减少,阿拉伯糖和半乳糖摩尔分数较高,表明桃果实Na2CO3溶性果胶多糖成分有别于CDTA溶性果胶多糖,其多糖组分中富含RG-Ⅰ主链成分,并带有阿拉伯半乳聚糖、阿拉伯聚糖和半乳聚糖等侧链,构成了结构比较复杂的果胶多糖。硬溶质型桃果实Na2CO3-1组分中,果胶鼠李半乳糖醛酸聚糖主链在成熟后期迅速降解,而软溶质型桃果实果胶鼠李半乳糖醛酸聚糖主链主要发生在前期[11]。支链半乳糖与鼠李糖含量的比值由成熟度Ⅰ的10.36迅速降至成熟度Ⅳ的8.68,在果实成熟前期变化不明显。半乳糖醛酸与鼠李糖含量比值在Na2CO3-1中随着果实硬度的下降而迅速下降。在Na2CO3-2组分中,果胶支链阿拉伯糖降解最为明显,成熟度Ⅰ阿拉伯糖与鼠李糖含量比值为7.57,成熟度Ⅳ该比值为5.17,说明该组分中阿拉伯糖的降解主要发生在果实树体成熟后期,这与软溶质型桃果实相似[11]。

表3 桃果实成熟过程中Na2CO3溶性果胶多糖的单糖组分摩尔分数变化Table 3 Changes in monopolysaccharide composition of Na2CO3soluble fractions during maturation of peach fruit%
2.5 桃果实成熟过程中KOH溶性半纤维素中单糖组成的变化
KOH-1、KOH-2主要为与细胞壁结合疏松的半纤维素多糖,KOH-3主要为与细胞壁结合紧密的半纤维素多糖。由表4可以看出,桃果实KOH溶性多糖组分中最显著的特点就是木糖和葡萄糖等半纤维特征性单糖的摩尔分数相对于CDTA、Na2CO3溶性果胶多糖明显增多,同时阿拉伯糖和半乳糖的摩尔分数也较高,而半乳糖醛酸的摩尔分数却明显减少。说明KOH溶性多糖组分中富含以木葡聚糖为主链的半纤维素多糖成分,而且由一定量的果胶嵌入半纤维素中形成网络状结构,这种交联是RG-Ⅰ主链通过侧链相联系而形成骨架[14]。在硬溶质型桃果实树体成熟过程中,KOH溶性多糖组分组成侧链的阿拉伯糖和半乳糖的摩尔分数逐渐减少。
KOH-1组分中,阿拉伯糖的摩尔分数由成熟度Ⅰ的14.10%逐渐下降至成熟度Ⅳ的11.02%,半乳糖的摩尔分数下降不明显。KOH-2组分中,阿拉伯糖的摩尔分数从成熟度Ⅰ的6.90%、成熟度Ⅱ的7.34%、成熟度Ⅲ的7.01%下降至成熟度Ⅳ的4.89%,半乳糖摩尔分数也由成熟度Ⅰ的25.05%逐渐下降至成熟度Ⅳ的24.46%。KOH-3组分中,阿拉伯糖和半乳糖摩尔分数在成熟后期也明显下降。与硬溶质型桃果实不同,软溶质型桃果实半乳糖的降解只发生在与细胞壁连接松散的半纤维素多糖中,在紧密连接的半纤维素多糖中未发生降解[11]。主链木葡聚糖成分中木糖和葡萄糖的摩尔分数没有减少,可见桃果实树体成熟过程中KOH溶性多糖组分摩尔分数的减少受木葡聚糖侧链或存在于KOH溶性多糖组分中果胶多糖侧链结构变化的影响,半纤维素多糖组分中阿拉伯糖、半乳糖等中性糖的降解与果肉的软化有密切的联系。

表4 桃果实成熟过程中KOH溶性半纤维素多糖的单糖组分摩尔分数变化Table 4 Changes in monopolysaccharide composition of KOH soluble fractions during maturation of peach fruit%
2.6 桃果实成熟过程中CMW-残渣中单糖组成的变化
CWM-残渣为KOH不溶物,主要成分为纤维素,由表5可以看出,CMW-残渣多糖组分中含有大量的阿拉伯糖和半乳糖成分,可能是桃果实细胞壁多糖中果胶多糖能紧密结合到纤维素上,或者是这些多糖链比较复杂,物理结构上相互缠绕,因此不为高浓度的KOH降解。果胶通过RG-Ⅰ的阿拉伯糖和半乳糖侧链锚定在细胞壁上,或者通过共价键连接到基质多糖-纤维素网络,氢键连接到纤维素[14],或者通过物理缠绕结合到其他细胞壁多聚体。Redgwell等[15]选取8个不同物种的KOH提取后的残渣,加入从番茄中纯化的内切PG酶,从中释放出一半的阿拉伯糖,说明一定比例的果胶关联到纤维素,并不是通过侧链,而是通过多聚半乳糖醛酸骨架。阿拉伯糖的摩尔分数从成熟度Ⅲ的22.06%下降至成熟度Ⅳ的16.70%,半乳糖摩尔分数从成熟度Ⅲ的37.04%下降至成熟度Ⅳ的32.91%,在硬溶质型桃果实成熟后期阿拉伯糖和半乳糖显著减少。软溶质型桃果实中主要是半乳糖的解离,且主要发生在成熟前期[11]。

表5 桃果实成熟过程中CMW-残渣纤维素多糖的单糖组分摩尔分数变化Table 5 Changes in monopolysaccharide composition of CMW-residue fractions during maturation of peach fruit %
2.7 桃果实成熟过程中PG、PME、纤维素酶和β-半乳糖苷酶活性的变化
PG能够水解切开α-(1,4)半乳糖糖苷键,断裂多聚半乳糖醛酸链,将果实细胞壁中多聚半乳糖醛酸降解为寡聚半乳糖醛酸和半乳糖醛酸,使细胞壁结构解体,导致果实软化。如图3所示,在硬溶质型桃果实成熟过程中,成熟前期PG活性很低,随着果实硬度下降和乙烯释放量的增加,PG活性逐渐增加,在成熟度Ⅳ时PG活性达到最高值为1.37mg/(g·h)。与软溶质型桃果实相似[10],PG活性高峰都出现在成熟后期,表明该酶对桃果实成熟后期快速软化起重要作用,只是硬溶质型桃果实中PG活性高峰来的更迟。
PME能够去除多聚半乳糖醛酸的半乳糖醛酸残基的C6酯化基团,催化果胶酯酸转化为果胶酸,以利于PG发挥其生理作用。如图3所示,PME活性在整个成熟过程中呈现明显的上升趋势,成熟前期,PME活性很低,随着果实成熟,PME活性逐渐增大,同PG活性表现出相同的变化趋势。在PME的作用下,果胶甲酯化程度降低,更有利于PG对果胶的水解作用。PME在软溶质型桃果实中比硬溶质型更早的发挥作用[16]。
纤维素酶是在细胞壁降解过程中起重要作用的一种细胞壁酶,能够分解含β-(1,4)糖苷键的半纤维素,但并不作用于水溶性纤维素。纤维素酶使纤维素降解,从而导致细胞壁纤维素微纤丝-半纤维素-果胶质“经纬结构”的松散。果胶酶趁机分解果胶质,导致果实成熟软化过程的进行。由图3可以看出,在硬溶质型桃果实成熟前期,纤维素酶活性变化不明显,都保持在3.6mg/(g·h)左右,直到成熟后期,活性才突然增加至5.3mg/(g·h)。由此看出,纤维素酶在硬溶质型桃果实前期软化中的作用不明显,主要在后期起作用。
β-Gal作用于鼠李半乳聚糖骨架的支链残基,降解果胶聚合体,破坏细胞壁结构,从而使果实软化。如图3所示,硬溶质型桃果实β-Gal活性在成熟前期迅速上升,在成熟度Ⅲ达到最大值,随后又逐渐降低。软溶质型桃果实β-Gal活性在成熟Ⅰ最高,比硬溶质型桃果实更提前发挥作用[10]。由β-Gal在成熟前期到中期时活性的快速增加可以看出,β-Gal不仅与桃果实成熟软化密切相关,而且其对桃果实软化的作用不同于PG,它主要与桃果实成熟前期的果实软化启动相关。
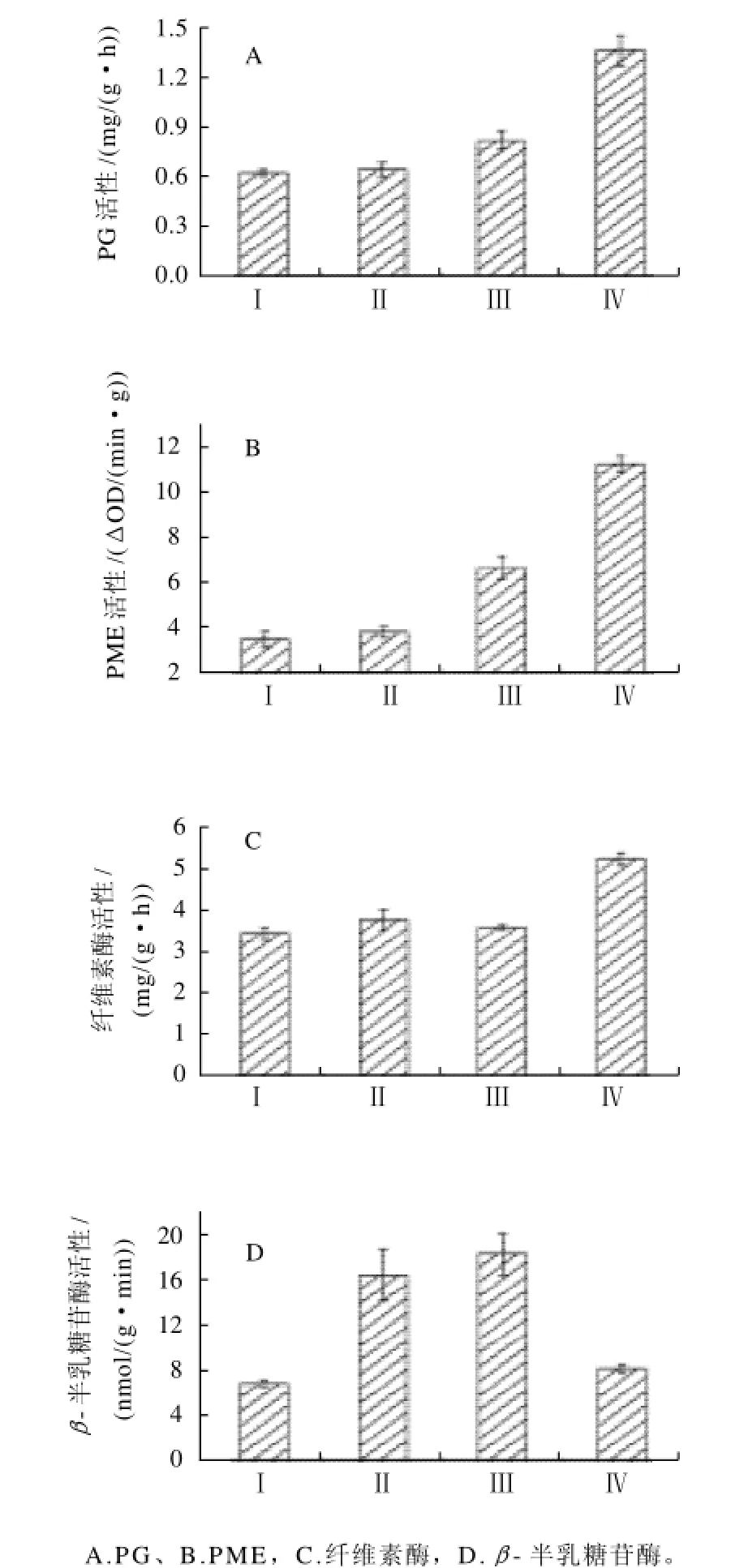
图3 桃果实成熟过程中细胞壁降解相关酶活性的变化Fig.3 Changes in the activities of several enzymes related to cell wall degradation during maturation of peach fruit
3 讨 论
果实硬度是反映果实软化的重要外在指标。果实成熟时最显著的变化特征就是果肉硬度的变化。本实验研究发现,硬溶质型桃果实在树体成熟过程中,硬度下降只出现在成熟末期,前期一直保持较高的硬度(图1),软溶质型桃果实在成熟中期硬度就开始迅速下降[10]。硬溶质型与软溶质型桃果实相比,成熟过程中硬度有更长的保持期,更利于采后贮藏,延长货架期。
乙烯诱导了果实的成熟,所以要控制果实成熟必须要控制乙烯的生成[17]。与软溶质型桃果实相比[10],硬溶质型桃果实同一时期乙烯释放量明显低于软溶质型,到成熟末期才有大量释放,而且乙烯释放高峰明显推迟。说明硬溶质型桃果实更利于采后贮藏的特性与其生理生化变化密切相关。
高等植物细胞壁的共同特征是均由纤维素、半纤维素、果胶物质和糖蛋白等大分子组成。Trainotti等[18]对桃果实细胞壁基因组表达的分析结果表明桃果实的软化过程极为复杂,有许多酶类参与其中。果实成熟软化过程中,在各种酶的作用下,溶解度较低的高分子质量细胞壁多糖发生降解或解聚,使得大分子长链多糖的含量减少,溶解度较大的小分子质量组分含量增多,从而造成果实细胞壁 CDTA组分含量增多,与芒果[19]、甜瓜[20]等水果成熟过程中CDTA溶性果胶含量增加结果相一致,而其他多糖组分摩尔分数逐渐减少[21](表1)。由单糖成分分析结果推测,衡量果胶多糖主链变化指标,即半乳糖醛酸与鼠李糖含量比值在CDTA-1、CDTA-2、Na2CO3-1中随着果实硬度的下降而迅速下降(表2、3)。说明桃果实树体成熟过程中,尤其在成熟后期,富含半乳糖醛酸的果胶主链发生了断裂。研究表明,甜瓜[20]等果实的成熟软化过程中细胞壁半纤维素多糖的变化与果实的成熟软化有紧密的联系。半乳糖含量在KOH-2、KOH-3、CWM-残渣组分中,阿拉伯糖含量在KOH-1、KOH-2、KOH-3、CWM-残渣组分中的下降,说明了硬溶质型桃果实细胞壁半纤维素、纤维素多糖组分中这两种支链中性糖的解离可能是多糖解聚、果实变软的原因之一。因此看出,桃果实成熟软化过程中细胞壁多糖的变化非常复杂,富含半乳糖醛酸的果胶多糖主链的断裂以及果胶、半纤维素、纤维素中阿拉伯糖、半乳糖等中性糖的降解都可能是果肉软化的重要因素,并有多种多糖降解酶参与其中。
硬溶质型桃果实树体成熟过程中,果实CDTA、Na2CO3组分中果胶多糖主链的断裂(表2、3)、半纤维素和纤维素组分中阿拉伯糖和半乳糖的降解主要发生在成熟末期(表4、5),而软溶质型桃果实多糖主链断裂和支链降解主要发生在成熟中后期[11],说明细胞壁多糖的降解与各类型桃果实的软化进程密切相关。硬溶质型桃果实成熟过程中KOH-1、KOH-2组分中组成侧链的阿拉伯糖逐渐下降,半乳糖下降不明显。KOH-3组分中,阿拉伯糖和半乳糖含量在成熟后期也明显下降(表4)。而软溶质型桃果实半乳糖的降解只发生在与细胞壁连接松散的半纤维素多糖中,在紧密连接的半纤维素多糖中未发生降解[11]。CMW-残渣组分在硬溶质型桃果实成熟后期阿拉伯糖和半乳糖显著减少,软溶质型桃果实CMW-残渣组分中主要是半乳糖的解离,且解离主要发生在成熟前期[11]。这可能跟果实品种细胞壁结构的差异性和果实成熟过程中细胞壁多糖降解相关酶在不同品种间发挥功效的时间和作用不尽相同有关。
对果实成熟过程中多种细胞壁降解酶编码基因表达水平变化的研究表明,果实的成熟软化与多种多糖降解酶活性密切相关[22]。PG在果实软化中主要作用于富含半乳糖醛酸的多糖主链,是细胞壁多糖主链断裂的重要作用酶,有关PG在果肉软化中的重要作用已在许多果实中得以证明,在桃果实树体成熟过程中能造成长而细的果胶多聚体解聚,成为短而粗的多聚体。PME能够去除多聚半乳糖醛酸的半乳糖醛酸残基的C6酯化基团,催化果胶酯酸转化为果胶酸,以利于PG发挥其生理作用。纤维素酶能够分解含β-(1,4)糖苷键的半纤维素。β-Gal能切除多糖侧链中非还原末端半乳糖残基,可造成细胞壁多糖中半乳糖、阿拉伯糖含量的降低,阿拉伯半乳聚糖、阿拉伯苷露聚糖等多聚物的解聚。在苹果果实成熟前期β-Gal活性较低,完熟后达到最高,但是在整个生长成熟过程中β-Gal总的活性没有变化[23]。本实验研究表明,β-Gal作用下的支链半乳糖的降解则可能与果实成熟软化启动密切相关(图3)。硬溶质型桃果实树体成熟过程中PG及其起辅助作用的PME变化趋势大致相同,活性都在成熟后期达到最大(图3),纤维素酶也在成熟后期活性增大(图3)。PG和纤维素酶对桃果实成熟后期快速软化起重要作用。PG、PME、纤维素酶和β-Gal都是硬溶质型桃果实成熟软化的重要作用酶,分别在果实成熟的不同阶段起作用。研究发现,与硬溶质型相比,细胞壁多糖降解相关酶活性高峰更早的在软溶质型桃果实中表现出来,这可能是导致软溶质型桃果实在树体成熟过程中更容易软化的原因之一。
桃果实的成熟软化受到多种内外因素的影响,乙烯的积累与多糖降解相关酶的表达以及对酶蛋白激活的作用都有待于进一步的证实。为此,可以采用分子生物学手段进一步研究乙烯的生物合成与细胞壁多糖降解酶以及它们之间的相互关系对桃果实成熟软化的作用。
[1]SHERMAN W B, TOPP B L, LYRENE P M. Non-melting flesh for fresh market peaches[J]. Proceedings of the Florida State Horticultural Society, 1990, 103: 293-294.
[2]HAJI T, YAEGAKI H, YAMAGUCHI M. Inheritance and expression of fruit texture melting, non-melting and stony hard in peach[J]. Scientia Horticulturae, 2005, 105(2):241-248.
[3]JIN C H, KASHIWAGI T, MIZUNO M, et al. Structural changes in the cell wall pectic polysaccharides accompanied by softening of apple (Malus pumila Mill) cultivars Fuji and Kinsei[J]. Food Preserva Sci, 1999, 25 (6): 293-300.
[4]ROSE J K C, HADFIELD K A, LABAVITCH J M, et al. Temporal sequence of cell wall disassembly in rapidly ripening melon fruit[J]. Plant Physiology, 1998, 117(2): 345-361.
[5]BRETT C T, WALDRON K W. Physiology and biochemistry of plant cell walls[M]. London: Unwin-Hyman, 1990: 6-43.
[6]金昌海, 水野雅史, 汪志君, 等. 苹果β-半乳糖苷酶对细胞壁多糖降解特性的研究[J]. 扬州大学学报: 农业与生命科学版, 2002, 23 (4): 71-74.
[7]KHAN A S, SINGH Z. 1-MCP regulates ethylene biosynthesis and fruit softening during ripening of Tegan Blue plum[J]. Postharvest Biology and Technology, 2007, 43(3): 298-306.
[8]HAGERMAN A E, AUSTIN P J. Continuous spectrophotometric assay for plant pectin methyl esterase[J]. Journal of Agricultural and Food Chemistry, 1986, 34(3): 440-444.
[9]XU Changjie, CHEN Kunsong, ZHANG Shanglong. The interference of sucrase in determination of exo-cellulase and exo-polygalacturonase in abscission zone of citrus young fruit and the methods to exclude it[J]. Plant Physiology Communication, 1997, 33(1): 43-46.
[10]阚娟, 金昌海, 汪志君, 等. β-半乳糖苷酶及多聚半乳糖醛酸酶对桃果实成熟软化的影响[J]. 扬州大学学报, 2006, 27(3): 76-80.
[11]金昌海, 索标, 阚娟, 等. 桃果实成熟软化过程中细胞壁多糖降解特性的研究[J]. 扬州大学学报, 2006, 27(3): 70-75.
[12]PEREZ S, RODRIGUEZ-CARVAJAL M A, DOCO T. A complex plant cell wall polysaccharide: rhamnogalac- turonan Ⅱ. A structure in quest of a function[J]. Biochimie, 2003, 85(2): 109-121.
[13]BRO J, HARHOLT J, SCHELLER H V, et al. Rhamnogalacturonan I in Solanum tuberosum tubers contains complex arabinogalactan structures [J]. Phytochemistry, 2004, 65(10): 1429-1438.
[14]ZYKWINSKA A W, RALET M C J, GARNIER C D, et al. Evidence for in vitro binding of pectin side chains to cellulose[J]. Plant Physiology, 2005, 139(1): 397-407.
[15]REDGWELL R J, FISCHER M, KENDALL M. Galactose loss and fruit ripening: high-molecular-weight arabinogalactans in the pectin polysaccharides of fruit cell walls[J]. Planta, 1997, 203(2): 174-181.
[16]阚娟. 桃果实成熟软化机理的研究[D]. 扬州: 扬州大学, 2005.
[17]HECTOR G, NUNEZ-PALENIUS, DONALD J, et al. Fruit ripening characteristics in a transgenic Galia male parental muskmelon (Cucumis melo L. var. reticulatus Ser.) line[J]. Postharvest Biology and Technology, 2007, 44(2): 95-100.
[18]TRAINOTTI L, ZANIN D, CASADORO G. A cell wall-oriented genomic approach reveals a new and unexpected complexity of the softening in peaches[J]. Journal of Experimental Botany, 2003, 54: 1821-1832.
[19]YASHODA H M, PRABHA T N, THARANATHAN R N. Mango ripening-chemical and structural characterization of pectic and hemicellulosic polysaccharides[J]. Carbohydrate Research, 2005, 340(7): 1335-1342.
[20]ROSE J K C, HADFIELD K A, LABAVITCH J M, et al. Temporal sequence of cell wall disassembly in rapidly ripening melon fruit[J]. Plant Physiology, 1998, 117(2): 345-361.
[21]HEGDE S, MANESS N O. Changes in apparent molecular mass of pectin and hemicellulose extracts during peach softening[J]. Journal American Society for Horticultural Science, 1998, 123(3): 445-456.
[22]OWINO W O, NAKANO R, KUBO Y, et al. Coordinated expression patterns of genes encoding cell wall modifying enzymes during ripening in distinct anatomical tissue regions of the fig (Ficus carica L.) fruit[J]. Postharvest Biology and Technology, 2004, 32(3): 253-261.
[23]GOULAO L F, SANTOS J, SOUSA I, et al. Patterns of enzymatic activity of cell wall-modifying enzymes during growth and ripening of apples[J]. Postharvest Biology and Technology, 2007, 43(3): 307-318.
Degradation of Cell Wall Polysaccharides and Related Enzyme Activities during Non-melting-flesh Peach Fruit Softening
KAN Juan1,LIU Tao1,JIN Chang-hai1,*,XIE Hai-yan2
(1. College of Food Science and Engineering, Yangzhou University, Yangzhou 225127, China;2. College of Bioscience and Biotechnology, Yangzhou University, Yangzhou 225009, China)
As a representative of non-melting-flesh peach, Wanhujing peach cultivar was used to investigate the degradation of cell wall polysaccharides in non-melting-flesh peach during its softening and the activities of related enzymes. During peach fruit ripening, CDTA-1 pectin content increased, and the contents of two kinds of Na2CO3 soluble pectin were decreased by 22.5% and 27.4% until the late stage. KOH soluble pectin content did not change significantly throughout the ripening process. The degradation of pectin main chains in CDTA and Na2CO3and the loss of arabinosyl and galactosyl from pectin side chains in cellulosic polysaccharides mainly happened at the end of the ripening process. β-galactosidase was associated with the startup of peach fruit softening. Polygalacturonase and Cx-Cellulase were important enzymes that contributed to the end of peach fruit softening. Na2CO3-1 pectin was an important factor affecting non-melting-flesh peach fruits softening. The degradation of KOH-1 and KOH-2 fractions may promote peach fruit softening. The fracture of pectin chain rich in galacturonic, as well as the degradation of neutral sugars such as arabinose and galactose in pectin, hemicellulos and cellulose, and a variety of polysaccharides degrading enzyme were likely to be important factors affecting non-melting-flesh peach fruit softening.
peach;ripening and softening;cell wall polysaccharides;monopolysaccharide composition
TS255.3;S662.1
A
1002-6630(2011)04-0268-07
2010-05-25
国家自然科学基金项目(30840016);江苏省自然科学基金项目(BK2010310);
江苏省高校自然科学研究项目(10KJB550004)
阚娟(1980—),女,讲师,博士研究生,研究方向果蔬采后生理与分子生物学。E-mail:kanjuan@yzu.edu.cn
*通信作者:金昌海(1963—),男,教授,博士,研究方向为果蔬采后生理与分子生物学。E-mail:chjin@yzu.edu.cn
——α-葡萄糖醛酸酶的研究进展*

