饮料和糖果中5种非法添加色素的检测
邵仕萍,奚星林,陈洁贞,梁瑞婷
饮料和糖果中5种非法添加色素的检测
邵仕萍1,奚星林1,陈洁贞2,梁瑞婷1
(1.广东检验检疫技术中心,广东 广州 510600;2.广东药学院公共卫生学院,广东 广州 510600)
采用聚酰胺吸附法提取样品溶液的色素,用乙醇-氨水-水混合溶液解吸,用高效液相色谱-二极管阵列检测器测定。采用ODS柱分离,以甲醇和硫酸铵溶液为流动相进行洗脱,在520nm波长处检测。亮黑、荧光素钠、红色2G、荧光桃红和孟加拉玫瑰红的质量浓度在1.0~10.0mg/L范围内与其色谱峰面积的线性关系良好(r=0.999),在1、2、5mg/kg添加水平时的平均回收率在82.95%~95.43%范围内,RSD值在1.99%~5.95%范围内。方法检出限为1.0mg/kg。该方法准确度高,分离效能好,结果稳定可靠,适合于饮料和糖果中亮黑、荧光素钠、红色2G、荧光桃红和孟加拉玫瑰红的测定。
高效液相色谱法;亮黑;荧光素钠;红色2G;荧光桃红;孟加拉玫瑰红
合成色素具有色泽鲜艳、着色力强、色调多、成本低的特点,故应用广泛。合成色素是以苯、甲苯和萘等化工产品为原料,经过一系列有机反应而制成,合成得色素因混有中间产物而具有一定毒性或致癌性。因此,各国对人工合成色素在食品中允许使用的品种、范围和添加量作了严格的规定,GB/T 2760—2007《食品添加剂使用卫生标准》明确规定在我国允许添加的食用色素的范围和用量。在欧盟、日本、南非、澳大利亚、新西兰、加拿大等国和地区允许在食品中使用亮黑、荧光素钠、红色2G、荧光桃红和孟加拉玫瑰红等添加剂。荧光素钠在美国还作为tephritid果蝇的杀虫剂使用[1-8],因而在番石榴和咖啡等农产品中有残留的风险。在我国不允许使用上述5种色素,因此研究这些色素的检测方法对于保障进口食品安全具有重要的现实意义。
目前,国内外已有分别测定食品和土壤中荧光素钠、红色2G和亮黑的文献报道[9-15],食品中亮黑、荧光素钠、红色2G、荧光桃红和孟加拉玫瑰红同时检测未见报道。本实验研究上述5种色素的同时检测,用聚酰胺吸附法提取饮料和糖果中的色素,用反相高效液相色谱检测,旨在为其在食品中的检测提供参考依据。
1 材料与方法
1.1 材料、试剂与仪器
柠檬茶饮料、果酒和硬糖 市购。
荧光桃红(纯度95%)、孟加拉玫瑰红(纯度95%)、红色2G(纯度95%)、亮黑(纯度95%)、荧光素钠(纯度95%) 美国Sigma公司;聚酰胺(80~120目);层析柱 自制。
标准溶液:准确称取各标准品(100±0.1)mg,置于100mL容量瓶中,用少量甲醇-水(体积比1:1)溶液溶解,并用甲醇定容至刻度,混匀,该溶液质量浓度为1mg/mL;标准工作溶液:根据需要移取适量标准储备液,用甲醇稀释配制成1.0、3.0、5.0、7.0、10.0mg/L系列工作溶液。
2695e 高效液相色谱系统(带2998二极管阵列检测器和Empower 色谱信息管理系统) 美国Waters公司;TurboVap LV恒温氮吹装置 美国Zymark公司;MS3振荡机 德国IKA公司。
1.2 样品处理
1.2.1 饮料和酒类
取样10.0~20.0g,加热驱除二氧化碳和乙醇,冷却。用柠檬酸溶液调样品液pH值到6,水浴加热至60℃。1.2.2硬糖、淀粉软糖
称取5.00~10.00g粉碎试样,放入100mL烧杯中,加水30mL,温热溶解。用柠檬酸溶液调样品液pH6,水浴加热至60℃。
1.2.3 净化步骤
将20g聚酰胺粉加入到适量pH4、60℃左右的水中,注入层析柱中,使聚酰胺分布均匀密实。将上述样品溶液注入到层析柱中,用60℃、pH4的水20mL分别淋洗3次,用乙醇-氨水-水(7:2:1)溶液解吸,直至洗脱液无色。收集解吸液,在水浴上蒸发至近干,用甲醇-水(1:1)溶液溶解,定容至5mL,经0.45μm滤膜过滤,取10μL注入高效液相色谱仪分析。
1.3 液相色谱条件
色谱柱:Ultimate C18柱(250mm×4.6mm,5μm);流动相:A为甲醇,B为0.02mol/L乙酸铵溶液,流速:1.0mL/min,梯度洗脱程序见表1;柱温:35℃;检测波长:520nm;进样量:10μL。

表1 梯度洗脱程序Table 1 HPLC gradient elution program
1.4 测定方法
配制标准工作溶液,标准工作溶液和样液中待测物响应值均应在仪器检测线性范围内。再将标准工作溶液和样液等体积参插进样测定。以待测物色谱峰的峰面积为纵坐标,与其对应的质量浓度为横坐标作图,绘制标准工作曲线。同时以二极管阵列检测器记录待测物的光谱图,并与标准品对照进行定性分析。
2 结果与分析
2.1 色谱条件的选择
2.1.1 检测波长的选择
亮黑、荧光素钠、红色2G、荧光桃红和孟加拉玫瑰红色谱峰的最大吸收波长分别为572、491、510、547、557nm。兼顾检测的适用性和检测灵敏度要求,选择520nm为检测波长。
2.1.2 流动相的选择
固定检测波长,分别考察甲醇-水、乙腈-水、甲醇-乙酸铵溶液、乙腈-乙酸铵溶液等流动相系统对于待测物的色谱峰形的影响。
结果表明,采用甲醇-水、乙腈-水为流动相时,待测物几乎不出峰。以乙酸铵为离子对试剂,采用甲醇-0.02mol/L乙酸铵溶液作为流动相,待测物的色谱峰形最好,而且随着甲醇比例的增加,流动相的极性逐渐减小,洗脱能力逐渐增强,兼顾到合适的保留时间和良好的色谱峰形,以及试样中还有众多脂溶性成分需要洗脱,最终选择甲醇初始比例为35%,进行梯度洗脱,不仅把荧光桃红和孟加拉玫瑰红色分离开,而且检测时间也可以接受。
2.1.3 柱温的选择
在检测波长和流动相固定以后,对不同的柱温(15~40℃)进行考察。结果表明,当柱温35℃时,待测物的保留时间和色谱峰形最为理想。
2.1.4 色谱柱的选择
在检测波长、流动相及柱温固定的情况下,分别考察Kromasil C18、Sulpeco C18、Ultimate 等不同固相色谱柱条件下待测物的色谱峰形。结果表明,采用Ultimate C18作为色谱柱,色谱峰形最为尖锐。
2.2 工作曲线及方法的检出限
根据本方法所确定的实验条件,取1.0、2.0、2.5、5.0、7.5、10.0mg/L系列标准溶液注入色谱仪中,混合标准品色谱图见图1。待测物质量浓度在1.0~10.0mg/L范围内,质量浓度与其对应的峰面积值呈良好线性关系,见表2。当样品中的待测物超过此线性范围时,可适当加大样品的稀释倍数。

表2 5种色素的线性方程和相关系数Table 2 Linear equations and correlation coefficients for the determination of 5 kinds of colorants
按RSN=3计算,方法的检出限为1.0mg/kg。
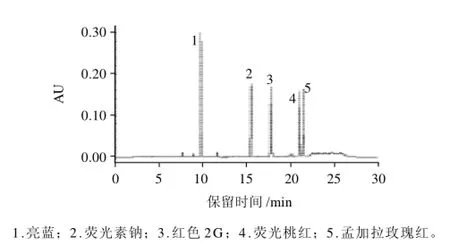
图1 混合标准品的色谱图Fig.1 HPLC chromatogram of mixed standards
2.3 加标回收率实验
在上述优化条件下,以未检出本底的饮料、糖果做基质,测定了1、2、5mg/kg添加水平时各色素的回收率,每个添加水平重复6次测定,结果见表3、4。

表3 饮料中5种色素的加标回收率实验结果(n=6)Table 3 Recovery rates for 5 kinds of colorants in drink spiked at three levels

表4 糖果中5种色素的加标回收率结果(n=6)Table 4 Recovery rates for 5 kinds of colorants in candy spiked at three levels
表3、4表明,亮黑、荧光素钠、红色2G、荧光桃红和孟加拉玫瑰红的加标平均回收率在82.95%~95.43%范围内,RSD在1.99%~5.95%范围内,回收率和精密度满足实验需要。
3 结 论
本研究建立了饮料和糖果中亮黑、荧光素钠、红色2G、荧光桃红和孟加拉玫瑰红的液相色谱检测方法,该方法简便、快速、结果稳定可靠,检测限、回收率和精密度均符合残留分析要求,可应用于实际样品的检测。
[1]LIQUIDO N J, MCQUATE G T, CUNNINGHAM R T. Light activated toxicity of phloxine B and uranine to Mediterranean fruit fly, Ceratitis capitata (Wiedemann) (Diptera: Tephritidate), adults[C]//HEITZ J R, DOWNUM K R. Light-Activated Pest Control: ACS Symposium Series 616. Washington, DC: American Chemical Society, 1995a.
[2]LIQUIDO N J, MCQUATE G T, CUNNINGHAM R T. Light activated toxicity of phloxine B and fluorescein in methyleugenol to Oriental fruit fly, Bactrocera dorsalis (Hendel) (Diptera: Tephritidate) males[C]// HEITZ J R, DOWNUM K R. Light-Activated Pest Control: ACS Symposium Series 616. Washington, DC: American Chemical Society, 1995b.
[3]LIQUIDO N J, CUNNINGHAM R T, MCQUATE G T. Photoactive dyes mixed in baits and lures for fruit fly suppression and eradication[J]. J Photobiochem Photobiol, 1997, 65: 65.
[4]HEITZ J R. Pesticidal applications of photoactivated molecules[C]// HEITZ J R, DOWNUM K R. Light-Activated Pest Control: ACS Symposium Series 616. Washington, DC: American Chemical Society, 1995.
[5]MANGAN R L, MORENO D S. Development of phloxine B and uranine bait for control of Mexican fruit fly[C]//HEITZ J R, DOWNUM K R. Light-Activated Pest Control: ACS Symposium Series 616.Washington, DC: American Chemical Society, 1995.
[6]MCDONALD T, KASTEN K, HERVEY R, et al. Acute and subacute toxicity evaluation of intravenous sodium fluorescein in mice, rats and dogs[J]. Toxicol Appl Pharmacol, 1974, 29: 97-98.
[7]LUTTY G A. The acute intravenous toxicity of biological stains, dyes, and other fluorescent substances[J]. Toxicol Appl Pharmacol, 1978, 44 (2): 225-249.
[8]KLAASSEN C D. Comparison of the toxicity of chemicals in newborne rats to bile duct-ligated and sham-operated rats and mice[J]. Toxicol Appl Pharmacol, 1973, 24(1): 37-44.
[9]ALCANTRA-LICUDINE J P , BUI N L, LI Q X. Method for determination of xanthene dyes in Guava fruits and its application in a field dissipation study[J]. Journal of AOAC International, 2000, 83(3): 563-568.
[10]ALCANTRA-LICUDINE J P, KAWATE M K, LI Q X. Method for the analysis of phloxine B, uranine, and related xanthene dyes in soil using supercritical fluid extraction and high performance liquid chromatography [J]. J Agric Food Chem, 1997, 45(3): 766-773.
[11]ALCANTARA-LICUDINE J P, LAN BUI N, KAWATE M K, et al. Analysis of phloxine B and uranine in coffee by high-performance liquid chromatography and capillary zone electrophoresis after solid phase extraction cleanup[J]. J Agric Food Chem, 1998, 46(3): 1005-1011.
[12]TUZIMSKI T, WOZNIAK A. Application of solid-phase extraction and planar chromatography with diode-array detection to the qualitative and quantitative analysis of dyes in beverages[J]. Journal of Planar Chromatography, 2008, 21(2): 89-96.
[13]GONZAALEZ M, GALLEGO M, VALCAARCEL M. Liquid chromatographic determination of natural and synthetic colorants in lyophilized foods using an automatic solid-phase extraction system[J]. J Agric Food Chem, 2003, 51(8): 2121-2129.
[14]LI Q X, ALCANTARA-LICUDINE J P, LI L P. Determination of phloxine B and uranine in water by capillary zone electrophoresis[J]. J Chromatogr Sci, 1997b, 35(12): 573-577.
[15]王全林, 应路, 张书芬, 等. 二极管阵列高效液相色谱法测定食品中红色2G[J]. 食品科学, 2009, 30(2): 164-167.
Determination of 5 Kinds of Illegally-added Colorants in Drink and Candy
SHAO Shi-ping1,XI Xing-lin1,CHEN Jie-zhen2,LIANG Rui-ting1
(1. Guangdong Inspection and Quarantine Technology Center, Guangzhou 510600, China;2. College of Public Health, Guangdong Pharmaceutical University, Guangzhou 510600, China)
A quantitative determination method for Brilliant Black PN, Fluorescein Sodium, Red 2G, Phloxine B and Rose Bengal in drink and candy was established using high performance liquid chromatography (HPLC). For sample preparation, extraction by polyamide adsorption and desorption with ethanol-ammonia solution-water (7:2:1, V/V) were carried out. An ODS C18column (250 mm × 4.6 mm, 5μm) was used for chromatographic separation, which was eluted with methanol-0.02 mol/L ammonium acetate aqueous solution as mobile phase at 35 ℃. The linear range of the developed method was 1.0-10.0 mg/L with relative standard deviation of 1.99%-5.95% and the detection limit was 1.0 mg/kg. The average recovery rates were 82.95%-95.43%. This method is simple, accurate, and suitable for the determination of these illegally-added colorants in drink and candy.
HPLC;brilliant black PN;fluorescein sodium;red 2G;phloxine B;rose bengal
O657.72
A
1002-6630(2011)04-0189-04
2010-04-06
中国检验检疫科学院基本科研业务费专项(2009JK011)
邵仕萍(1980—),女,工程师,本科,研究方向为食品添加剂、食品污染物检测。E-mail:shaoshiping@sohu.com

