软枣猕猴桃总黄酮含量测定的方法研究
栾云峰,王 菲,刘长江*,宗绪岩
软枣猕猴桃总黄酮含量测定的方法研究
栾云峰,王 菲,刘长江*,宗绪岩
(沈阳农业大学食品学院,辽宁 沈阳 110866)
选用ZrOCl2比色法、NaNO2-Al(NO3)3比色法、AlCl3比色法以及HPLC法测定软枣猕猴桃总黄酮含量,通过对黄酮粗提液和芦丁标准品与不同显色剂反应后进行200~600nm波长扫描,根据扫描结果确定各种反应的适合波长并进行定量分析比较。结果表明,NaNO2-Al(NO3)3比色法与AlCl3比色法不适合软枣猕猴桃总黄酮测定。在284nm波长处,ZrOCl2比色法的线性方程Y=0.0114X-0.0001,R2=0.9991,平均加样回收率为99.4%,RSD=1.61%(n=5)。ZrOCl2比色法是一种快捷、准确的检测方法,适用于软枣猕猴桃总黄酮含量测定。
软枣猕猴桃;总黄酮;比色法
软枣猕猴桃(Actinidia arguta Sieb.et Zucc.),又名软枣子,猕猴梨,藤瓜,属于猕猴桃科(Actinidiaceae)、猕猴桃属(Actinidia)多年生落叶藤本植物[1-2]。果实可食用,多汁,酸甜适口,风味独特。营养价值很高,含大量VC、VB族维生素、氨基酸、类胡萝卜素等多种营养成分。
黄酮类化合物是一类植物中分布很广而且重要的多酚类天然产物,泛指两个具有酚羟基的苯环(A-与B-环)通过中央三碳原子相互连接而成的一系列化合物[3]。的生长、发育、开花、结果以及抵御异物的侵袭起着重要作用。黄酮化合物有具有广泛的药理活性,如抗菌作用、抗氧化作用和抗自由基作用[4]。
目前测定食品及中草药中黄酮类的方法有直接测定法[5]、AlCl3法[6-8]、Al(NO3)3法[9-10]、紫外法[11]、HPLC[12-13]法等。有关食品及中草药中黄酮类的含量测定,当前用得较多的方法之一是以芦丁为标样的NaNO2-Al(NO3)3显色法,但是此反应并不专一,很多非黄酮类物质也可参与反应对测定结果产生影响[14]。本实验以芦丁为标样,通过分析研究,确定适合软枣猕猴桃黄酮类测定的简便方法,为软枣猕猴桃这一野生资源的进一步开发利用提供参考。
1 材料与方法
1.1 材料与试剂
软枣猕猴桃 辽宁省本溪市。
芦丁(rutin)、槲皮素(quercentin) 中国药品生物制品鉴定所;甲醇(色谱纯) Dikma公司;其他试剂均为分析纯。
1.2 仪器与设备
600E-2487高效液相色谱仪 美国Waters公司;Waters Nova-pak C1860A 4μm 3.9mm×150mm色谱柱;TU-180型紫外-可见分光光度计 北京普析通用仪器有限公司;移液器 德国Eppendorf公司;himac CR-21G高速冷冻离心机 日本日立公司;BP120S 电子天平 德国Sartorius公司;JY92-Ⅱ超声波细胞粉碎机 宁波新芝生物科技股份有限公司。
1.3 方法
1.3.1 软枣猕猴桃黄酮提取
取软枣猕猴桃鲜果100g,匀浆,加入匀浆4倍体积70%(V/V)乙醇超声处理,超声功率300W,超声时间25s,间隔10s,作用30次,超声处理后60℃水浴2h,冷却后4℃ 10000r/min离心15min,取上清液备用。1.3.2不同显色反应反应液的紫外-可见光谱扫描
分别将不同显色反应的芦丁及粗提样品反应液进行200~600nm波长扫描,以确定检测波长。
1.3.3 粗提液中总黄酮含量的测定
ZrOCl2比色法[15]:取0.5mL黄酮粗提液置于比色管中,加入甲醇至5mL,再加入质量浓度2g/mL ZrOCl2甲醇溶液1.5mL,以甲醇定容至10mL,静置10min测定A284nm、A430nm。
AlCl3比色法[6-8]:取1mL黄酮粗提液置于比色管中,加入质量浓度1.5g/100mL AlCl3-50%乙醇溶液8mL,以50%乙醇定容至25mL,静置30min后测定A279nm、 A315nm。
NaNO2-Al(NO3)3比色法[9-10]:取1mL黄酮粗提液置于比色管中,加入30%乙醇至10mL,加入1mL质量浓度5g/mL NaNO2溶液,摇匀,静置6min,加入1mL质量浓度10g/mL Al(NO3)3溶液,摇匀,静置6min,加入5g/mL NaOH溶液10mL,以30%乙醇定容至25mL,静置15min后测定A330nm、A510nm。
HPLC法[12-13]:流动相:甲醇-水-1%磷酸梯度洗脱;流速:0.5mL/min;柱温:30℃;检测波长:350nm;进样量:10μL。取黄酮粗提液20mL,加入3mol/L HCl溶液 3mL,80℃冷凝回流2h,冷却,用碱中和,减压蒸干,定容至5mL,取10μmL进行HPLC测定。以槲皮素为外标,计算粗提液中黄酮含量。
每种检测方法均做4组平行。
2 结果与分析
2.1 检测波长的确定
ZrOCl2比色法波长扫描结果见图1。芦丁在219、280、430nm有吸收峰,黄酮粗提液在273、284nm处有吸收峰。284nm处芦丁与粗提物的吸收峰基本吻合,选择为检测波长;在可见区芦丁与黄酮粗提液的吸收峰不吻合,选择芦丁的吸收峰处430nm作为参考。

图1 ZrOCl2显色法在波长200~600nm处的光谱扫描图Fig.1 Ultraviolet scanning of flavonoid extracts and rutin for ZrOCl2colorimetric determination
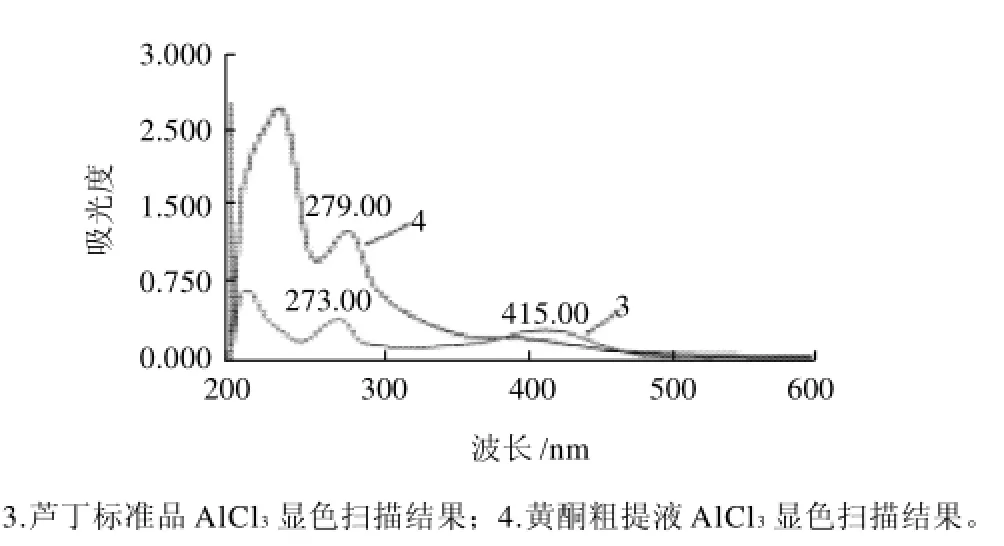
图2 AlCl3显色法在波长200~600nm处的光谱扫描图Fig.2 Ultraviolet scanning of flavonoid extracts and rutin for AlCl3colorimetric determination
AlCl3比色法波长扫描结果见图2。芦丁在210、273、415nm处有吸收峰,黄酮粗提液在233、279nm处有吸收峰。279nm处芦丁与粗提物的吸收峰基本吻合,选择为检测波长;在可见区芦丁与黄酮粗提液的吸收峰不吻合,选择芦丁的吸收峰处415nm作为参考。
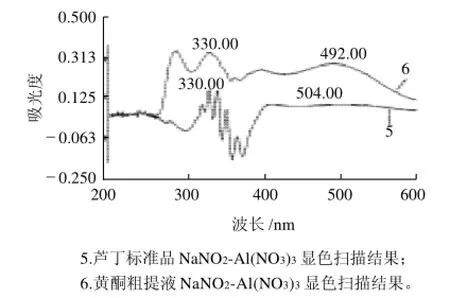
图3 NaNO2-Al(NO3)3显色法在波长200~600nm处的光谱扫描图Fig.3 Ultraviolet scanning of flavonoid extracts and rutin for NaNO2-Al(NO3)3colorimetric determination
由图3可知,400~600nm范围内,芦丁在504nm处有一不明显的吸收峰,黄酮粗提液在492nm处有明显的吸收峰;280~400nm范围内,芦丁在367、352、340、330、320nm处有吸收峰,黄酮粗提液在339、363、330、287nm处有吸收峰;波长小于280nm,芦丁与黄酮粗提液吸收峰非常杂乱,并且吸收较弱。330nm处处芦丁与粗提物的吸收峰基本吻合,选择为检测波长;在可见区芦丁与黄酮粗提液的吸收峰不吻合,选择标准品吸收峰处510nm作为参考。
2.2 标准曲线的绘制
ZrOCl2比色法:分别取0.2mg/mL芦丁标准品溶液0、0.2、0.4、0.6、0.8、1.0mL,按1.3.3节ZrOCl2比色法进行显色反应,测定A284nm、A430nm制作标准曲线。回归方程:Y284=0.0114X-0.0001,R2=0.9991;Y430=0.008X+0.0001,R2=0.9992。
AlCl3比色法:分别取0.2mg/mL芦丁标准品溶液0、0.5、1.0、1.5、2、2.5mL,按1.3.3节AlCl3比色法进行显色反应,测定A279nm、A315nm制作标准曲线。回归方程为:Y279=0.0316X-0.0006,R2=0.9996;Y415=0.0315X-0.0002,R2=0.9999。
NaNO2-Al(NO3)3比色法:分别取0.2mg/mL芦丁标准品溶液0、0.5、1.0、1.5、2、2.5mL,按1.3.3节NaNO2-Al(NO3)3比色法进行显色反应,测定A330nm、A492nm制作标准曲线。回归方程:Y330=0.0196X+0.0019,R2=0.9416;Y510=0.0727X+0.0004,R2=0.9999。NaNO2-Al(NO3)3比色法在330nm处的吸收很不稳定,标准曲线线性差,不适合进行黄酮含量测定。
HPLC法:配制0.2mg/mL槲皮素标准品溶液,以进样量为纵坐标,以峰面积为横坐标绘制标准曲线,回归方程:Y=2×10-7X+0.1292,R2=0.9938。标准品和样品色谱图见图4、5。
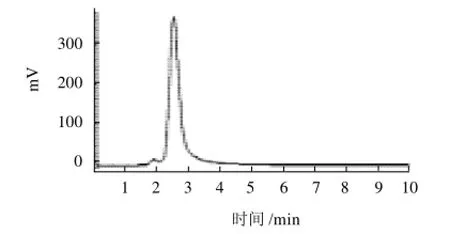
图4 槲皮素标准品HPLC图谱Fig.4 Chromatogram of quercetin standard

图5 样品HPLC图谱Fig.5 Chromatogram of sample
2.3 不同检测方法的比较

表1 不同显色方法测定软枣猕猴桃粗提液中总黄酮含量的比较Table 1 Comparison of total flavonoid contents in Actinidia arguta extract determined by different colorimetric methods
比色法测定的粗提液中总黄酮含量,结果见表1。通过3种比色方法与HPLC法比较可知,ZrOCl2法在430nm处、AlCl3法在415nm处测得量明显低于HPLC法,Al(NO3)3法在492nm处、AlCl3法在279nm处测得量明显高于HPLC法,ZrOCl2法在284nm处测得量与HPLC法基本吻合。
NaNO2-Al(NO3)3法目前是在食品和中草药测定黄酮类时,用的较多的方法之一,NaNO2-Al(NO3)3显色法发生在黄酮分子B环的3',4'-邻二酚羟基部位,很多非黄酮类物质如原儿茶醛、原儿茶酸、咖啡酸、绿原酸、苯甲酸类、肉桂酸类及原花色素等多种物质均具有邻二酚羟基结构并在500nm左右有最大吸收或有较强吸收[12],对测定结果产生严重影响。经此方法测定的软枣猕猴桃总黄酮含量明显偏高,此方法不适用于测定软枣猕猴桃总黄酮。黄酮分子B-环中存在游离的3-OH或5-OH时,均可与ZrOCl2形成黄色螯合物[3-4](图6),AlCl3能使黄酮化合物B-环的3-OH或5-OH与4-羰基形成比较稳定的螯合物,这两种化合物与黄酮的反应均有较好的选择性,但AlCl3法仍然不能很好的排除干扰,显然ZrOCl2法更适合软枣猕猴桃总黄酮的测定。
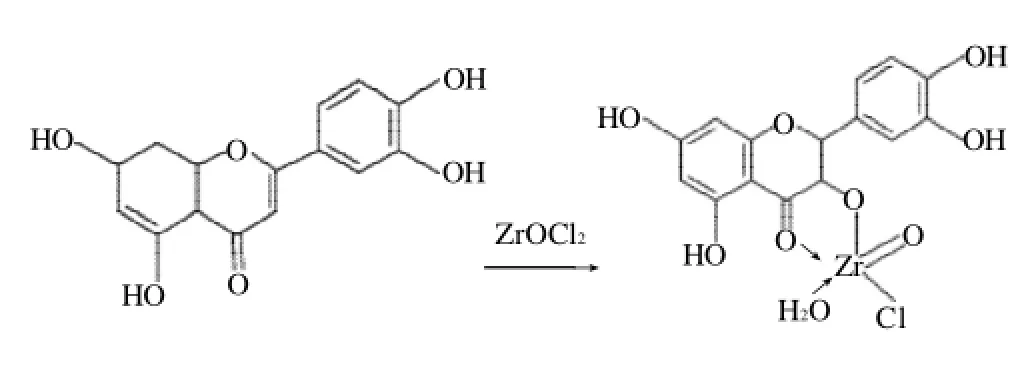
图6 黄酮与ZrOCl2形成配合物的结构Fig.6 Reaction mechanism between flavonoids and ZrOCl2
2.4 ZrOCl2比色法的方法评价
2.4.1 精密度实验
准确吸取标准品溶液1.0mL,样品溶液0.4mL各5份,同1.3.3节中ZrOCl2比色法操作,测定吸光度。结果表明,标准品吸光度的RSD=0.71%(n=5),样品吸光度的RSD=1.07%(n=5),说明精密度良好。精密度实验结果见表2。
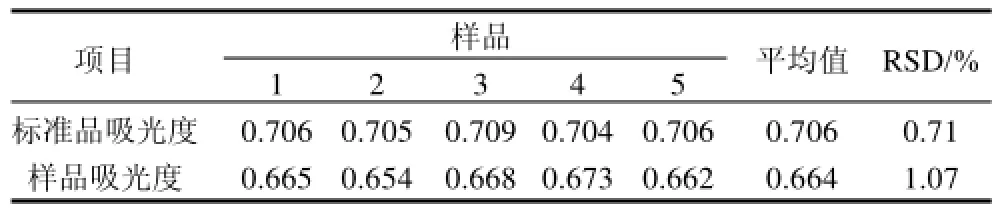
表2 精密度实验结果Table 2 Results of precision experiments
2.4.2 稳定性实验
准确吸取标准品溶液1.0mL,样品溶液0.4mL,同1.3.3节ZrOCl2比色法操作在0、10、20、30、45、60、90、120min测定其吸光度。结果表明,标准品在120min内稳定,样品在60min内基本稳定。稳定性实验结果见表3。

表3 稳定性实验结果Table 3 Results of stability experiments
2.4.3 加标回收率实验
分别取已知浓度的粗提液1mL与5个比色管中,向每个比色管中加入一定量的芦丁标准溶液,按1.3.3节中ZrOCl2比色法测定含量并计算加标回收率。

表4 加标回收率测定结果Table 4 Results of recovery rate experiments
3 结 论
通过对黄酮粗提液和芦丁标准品与不同显反应后进行200~600nm波长扫描结果分析,确定各种显色反应的适合波长,并以芦丁标准品峰值作为参考值。将NaNO2-Al(NO3)3法、ZrOCl2法、AlCl3法定量分析结果与HPLC测定结果比较,其中ZrOCl2法测定结果与HPLC测定结果基本一致。通过比较分析,得到了ZrOCl2比色法(测定波长为284nm)与HPLC法之间的校正系数为0.89。HPLC法虽然可以较准确地测定总黄酮含量,但对设备和操作要求较高,计算繁琐。以芦丁为标准品的ZrOCl2比色法是一种操作简便、结果较准确的方法,可用于软枣猕猴桃总黄酮类含量的快速测定。
[1]赵淑兰. 软枣猕猴桃品种简介[J]. 特种经济动植物, 2002(2): 35.
[2]刘慧涛, 张冰冰, 吕耀双. 东北地区野生猕猴桃资源现状及开发利用[J]. 河北林果研究, 1999(4): 327-330.
[3]吴立军. 天然药物化学[M]. 4版. 北京: 人民卫生出版社, 2003: 173-184.
[4]张培成. 黄酮化学[M]. 北京: 化学工业出版社, 2008: 1-4; 227-243.
[5]梁红, 潘伟明, 张伟锋. 银杏叶黄酮提取方法比较[J]. 植物资源与环境, 1999, 8(3): 12-17.
[6]何书美, 刘敬兰. 茶叶中总黄酮含量测定方法的研究[J]. 分析化学研究简报, 2007, 35(9): 1365-1368.
[7]马陶陶, 张群林, 李俊, 等. 三氯化铝比色法测定中药总黄酮方法的探讨[J]. 时珍国医国药, 2008, 19(1): 54-56.
[8]丁明玉, 赵纪萍, 李擎阳. 贯叶金丝桃提取物中总黄酮的测定方法[J]. 分析实验室, 2001, 20(6): 45-47.
[9]赵二劳, 段晋峰. 分光光度法测定黄花菜中总黄酮[J]. 分析试验室, 2008, 27(9): 94-96.
[10]薛长晖, 端允. 山丹叶中总黄酮含量测定方法的建立[J]. 中国酿造, 2009(8): 152-154.
[11]李凤林, 李青旺, 高大威, 等. 天然黄酮类化合物含量测定方法研究进展[J]. 江苏调味副食品, 2008, 25(4): 8-13.
[12]任顺成, 丁霄霖. 玉米须黄酮类测定方法的研究[J]. 食品科学, 2004, 25(3): 139-142.
[13]OSTICHER A. Identification and determination of the flavonoids from Gingo biloba by high-performance liquid chromatography[J]. Journal of Chromatography, 1992, 605(1): 41-48.
[14]周春华, 孙崇德, 李鲜. 富含绿原酸的植物中类黄酮测定方法探讨[J]. 植物生理学通讯, 2007, 43(5): 902-904.
[15]康旭珍. 差示分光光度法测定桑叶总黄酮含量[J]. 光谱实验室, 2005, 22(3): 506-508.
A Comparative Study of Different Methods for the Determination of Total Flavonids in Actinidia arguta
LUAN Yun-feng,WANG Fei,LIU Chang-jiang*,ZONG Xu-yan
(College of Food Science, Shenyang Agricultural University, Shenyang 110866, China)
Total flavonoids in Actinidia arguta were determined separately by ZrOCl2 colorimetry, NaNO2-Al(NO3)3 colorimetry, AlCl3colorimetry and HPLC. Wavelength scanning of flavonoid extracts and rutin after reaction with different chromogenic reagents was performed in a range of 200-600 nm. Results showed that NaNO2-Al(NO3)3colorimetry and AlCl3colorimetry were fount not suitable for the determination of total flavonoids in Actinidia arguta. An excellent linear equation for ZrOCl2 colorimetric determination at 284 nm wavelength was obtained as follows: Y284 = 0.0114X-0.0001, R2= 0.9991. The average recovery rate was 99.4% with a RSD of 1.61% (n = 5). ZrOCl2colorimetry is a quick accurate method for the determination of total flavonoids in Actinidia arguta.
Actinidia arguta;total flavonoids;colorimetry
S663.4
A
1002-6630(2011)04-0155-04
2010-03-20
农业部公益性行业科研专项(200903013)
栾云峰(1986—),男,硕士研究生,主要从事食品生物技术研究。E-mail:fluyuan@126.com
* 通信作者:刘长江(1955 —),男,教授,博士,主要从事食品生物技术研究。E-mail:liucj597@sohu.cm
——以渤海S油田为例

