响应面法优化生物酶法合成植物甾醇酯
王腾宇,王铭义,宋玉卿,胡立志,于殿宇,*
响应面法优化生物酶法合成植物甾醇酯
王腾宇1,王铭义2,宋玉卿1,胡立志1,于殿宇1,*
(1.东北农业大学食品学院,黑龙江 哈尔滨 150030;2.哈尔滨理工大学测控技术与通信工程学院,黑龙江 哈尔滨 150086)
采用Novozym 435脂肪酶催化大豆油与植物甾醇的酯交换反应,对其技术参数和条件进行探索。通过单因素与响应面分析,确定最佳工艺参数:反应温度101℃、酶用量1%、甾醇添加量5.2%、反应时间3h。在最佳条件下酯交换反应的转换率高达85.67%。
植物甾醇;大豆油;酯交换反应;脂肪酶
甾醇又被称为类固醇,主要包括β-谷甾醇、豆甾醇、菜油甾醇、菜籽甾醇等[1-2]与胆固醇极其相似的化学结构,仅仅侧链结构不同。自从植物油中发现谷甾醇等植物甾醇以来,近百年中,人们对植物甾醇进行了广泛深入的探讨,甾醇也被誉为“生命的钥匙”[3]。近年研究表明,植物甾醇是一类具有生理活性的物质,其生理功能十分重要,如降胆固醇、抗癌作用、类激素功能、抗炎作用、免疫调节、调节生长、抗病毒等[4]。因此,植物甾醇及其制品被广泛地运用于动物生长剂、植物生长激素的合成,乃至医药、食品、化妆品和纺织等各个领域[5]。
植物甾醇可抑制胆固醇的吸收,达到降低胆固醇的效果[6]。相关研究对植物甾醇进行系统毒理性评价表明,植物甾醇在小肠内的吸收性很差(1%~10%)[7-8]。虽然植物甾醇具有降低血清胆甾醇水平的功效,但游离植物甾醇在水和油脂中的低溶解性限制了它在食品中的实际作用[9],导致其在人体内的溶解性和生物利用性较差[10-12]。植物甾醇在C3位上的羟基是一个十分重要的活性基团,易与油脂中的甘三酯发生酯化反应生成植物甾醇酯,植物甾醇酯有着更优的脂亲和性和更佳的降胆固醇效果[13]。例如:植物甾醇酯化后显著改善了溶解度,游离的植物甾醇21℃时在食用油或脂肪中的溶解度仅为2%,而甾醇酯的溶解度高达35%~40%[14]。临床实验表明,成人每天只要摄入1.3g以上植物甾醇酯即可达到降低胆固醇的目的[15]。
目前,甾醇酯的合成方法有化学法和酶法两种[16]。与化学法相比,酶法反应条件温和、副产物少[17]。本研究采用大豆油与植物甾醇为反应原料,选择生物酶法在无溶剂体系中合成植物甾醇的工艺进行探索,旨在为油脂制品的产业化提供一定的借鉴。
1 材料与方法
1.1 材料、试剂与仪器
植物甾醇 西安蓝天生物工程有限责任公司;大豆油 黑龙江九三粮油工业集团;Novozym 435脂肪酶 丹麦Novozymes公司;其他试剂均为化学纯。
HSY-2MB型电热恒温水浴锅 天津市泰斯特仪器有限公司;DF-101S集热式恒温加热磁力搅拌器 巩义市英峪高科仪器厂;LD4-2A低速离心机 北京医用离心机厂;XW-80A旋涡混合器 上海青浦沪西仪器厂;722型可见分光光度计 上海光谱仪器有限公司。
1.2 方法
1.2.1 植物甾醇酯的合成
精确称量一定量的植物甾醇、大豆油和Novozym 435脂肪酶,连同转子一同加入锥形瓶中,置于集热式磁力搅拌器中,调整温度、搅拌速度,反应一定时间。反应完成后,在3000~4000r/min条件下离心20min,取出上层油脂制品(即为含有植物甾醇酯的油脂)。
1.2.2 标准曲线的制作
将甾醇溶解于乙酸酐中,配制成100μg/mL的溶液并吸取0.0、0.5、1.0、1.5、2.0mL分别置于10mL试管内,在各管内加入乙酸酐使总体积均达到4mL。加入2滴浓硫酸,30min后,在660nm波长处比色。以甾醇质量浓度为横坐标,吸光度为纵坐标,得出标准曲线,其方程为y=0.0224x+0.041,R2=0.9956。
1.2.3 转换率的测定
将制取的植物甾醇酯3~4滴,置于25mL试管内,准确记录其质量。加入4mL无水乙醇、0.5mL质量分数50%的氢氧化钾溶液,在65℃恒温水浴中皂化1h。皂化时每隔20~30min振摇一次使其皂化完全。皂化完毕,取出试管,冷却。加入3mL质量分数5%的氯化钠溶液,10mL石油醚,盖紧玻塞,在电动振荡器上振摇2min,静置分层(一般约需1h以上)。
取上层石油醚液2mL,置于10mL试管内,在65℃水浴中用氮气吹干,加入4mL乙酸酐,2滴浓硫酸,混匀,静置20min后在660nm波长处比色,测得吸光度,在标准曲线上查出相应的植物甾醇含量。
1.2.4 转换率计算
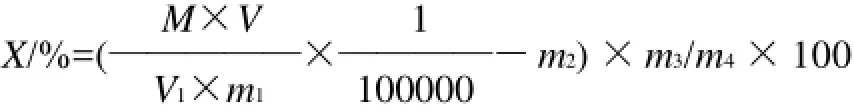
式中:X为转换率/%;M为测得的吸光度在甾醇标准线上查得的甾醇含量/μg;V为石油醚总体积/mL;V1为取出的石油醚体积/mL;m1为称取油样品的质量/g;m2为每克称取油脂样品中植物甾醇量/mg;m3为油脂样品量/g;m4为添加的植物甾醇量/mg;1/100000为折算成每1g油脂制品植物甾醇酯毫克数。
2 结果与分析
2.1 单因素试验
2.1.1 温度对转换率的影响
在植物甾醇添加量5%、酶用量1%、反应时间3h、搅拌速度600r/min条件下,考察不同温度对甾醇转换率的影响。Novozym 435脂肪酶的最佳反应温度在70~80℃之间,高温会使酶变性失活,由于在超临界状态下物质的理化特性发生很大变化,所以在较高温度下酶也可以保证其活性。油脂中含有微量的水分,过低的水分可使酶的耐高温程度增加,甘三酯的酯交换反应是在含水量非常低的条件下反应。因此,Novozym 435脂肪酶可耐受一定程度的高温而不变性。从图1可以看出,在80~100℃范围内,转换率随着反应温度的升高而增加,但是在100~120℃这一区间转换率开始下降。这是因为酶的活性会随着温度的上升而增大,达到最适温度以后,再升高温度反而会使酶变性失活,从而使转换率下降。因此,选择反应温度为100℃。

图1 反应温度对转换率的影响Fig.1 Effect of reaction temperature on transesterification rate
2.1.2 甾醇添加量对转换率的影响
在酶用量1%、反应时间3h、反应温度100℃、搅拌速度600r/min条件下,考察不同甾醇添加量对甾醇酯交换的影响。从图2可以看出,植物甾醇的添加量为5%时转换率最高。随着植物甾醇添加量继续增加,转换率呈下降趋势。后续实验发现,植物甾醇添加量过低时反应并不完全,超过15%以后,植物甾醇不能很好地溶解于大豆油中。因此,5%为最佳甾醇添加量。

图2 植物甾醇添加量对转换率的影响Fig.2 Effect of phytosterol amount on transesterification rate
2.1.3 酶用量对转换率的影响
植物甾醇添加量5%、反应时间3h、反应温度100℃、搅拌速度600r/min条件下,考察不同的反应时间对甾醇转换率的影响。从图3可以看出,酶用量1.0%时转换率最大,随着酶用量继续增加,转换率呈下降趋势。这是因为,酶的用量过小,不能使底物完全与其活性中心结合,造成底物的浪费;酶用量过大,造成酶聚集在一起使其与底物接触面积相对减小,并且产物与酶结合在一起不利于产品的精炼。因此,选择酶用量1.0%为最佳条件。

图3 不同酶用量对转换率的影响Fig.3 Effect of enzyme amount on transesterification rate
2.1.4 反应时间对转换率的影响
在植物甾醇添加量5%、酶用量1%、反应温度100℃、搅拌速度600r/min条件下,考察不同反应时间对甾醇转换率的影响。从图4可以看出,3h以后,随着反应时间的延长,转换率增加并不十分明显,并且反应时间过长,产生的水分会使反应向反方向进行,降低反应效率。从节省资源,减少副产物角度来看,选择反应时间3h。
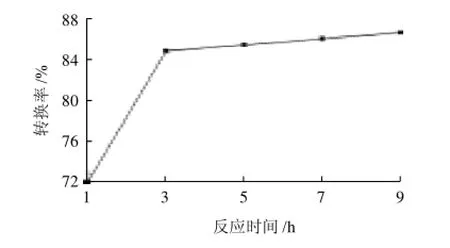
图4 不同反应时间对转换率的影响Fig.4 Effect of reaction time on transesterification rate
2.2 响应面试验结果及分析
2.2.1 统计分析结果
根据预备实验,选取反应温度、酶用量和甾醇添加量3个因素为自变量(xi)以植物甾醇酯的转换率为响应值(Y),进行二次旋转正交试验设计,共23个试验点。各因素的变化区间由预备实验确定,每个试验点做3个平行样试验,取其平均值。因素水平编码表见表1,试验结果见表2。
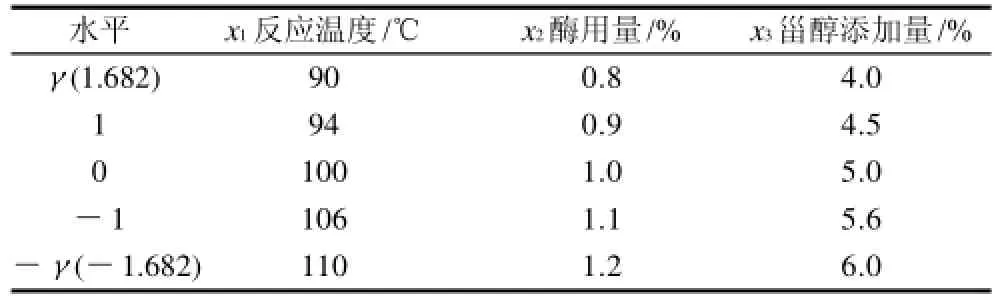
表1 生物酶法合成植物甾醇酯响应面试验因素水平编码表Table 1 Variables and their coded levels in quadratic orthogonal rotary combination design
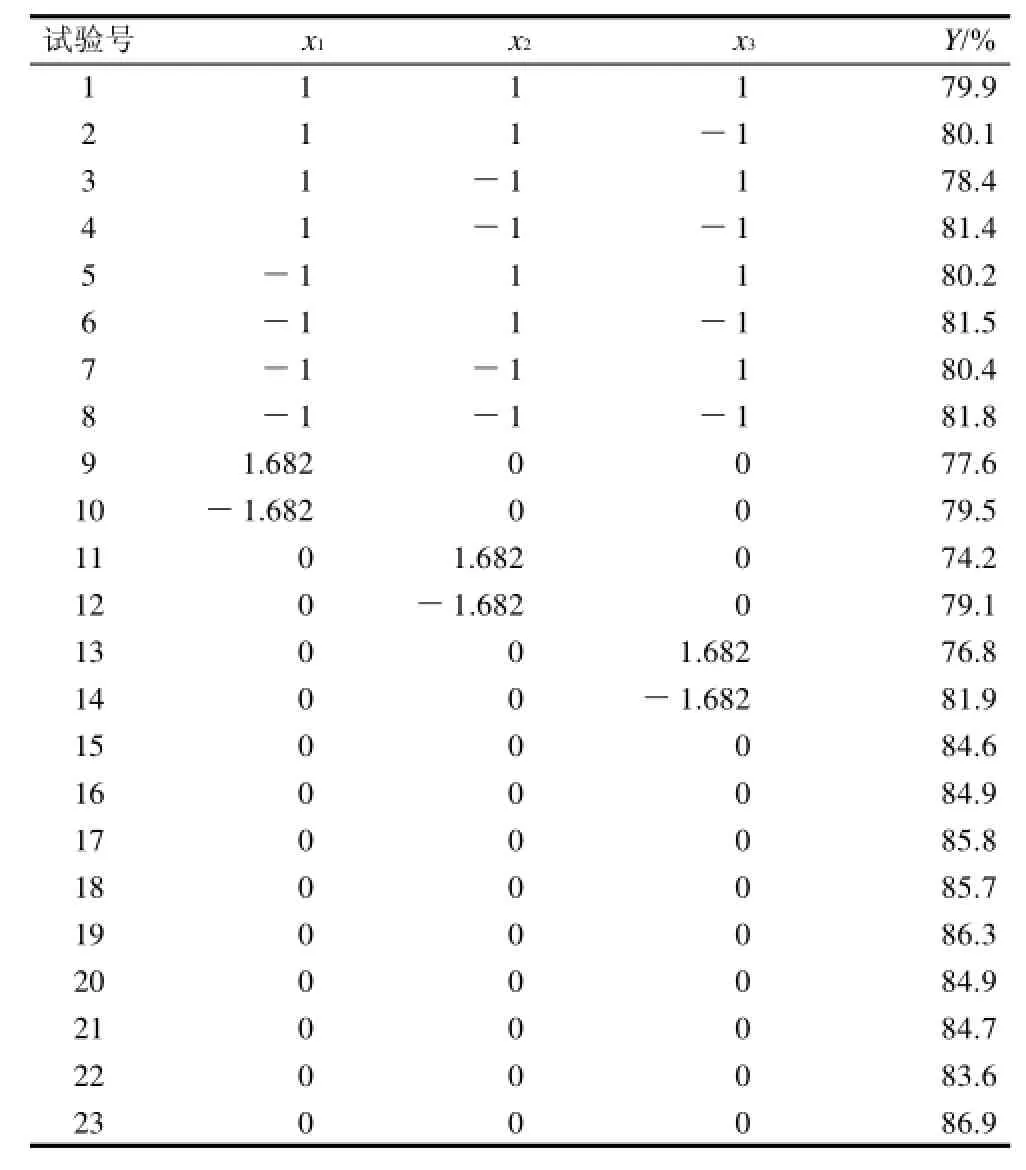
表2 生物酶法合成植物甾醇酯响应面试验设计与结果Table 2 Scheme of experimental results of quadratic orthogonal rotary combination design
经过SAS8.0软件分析后得出合成植物甾醇酯的回归方程为:
Y=90.50327066-1.33390461x1-1.20254077x2-2.54236122x3+0.31250000x1x2+0.31250000x1x3+0.43750000x2x3-3.32006136x12-1.74713631x22-1.53505653x32

表3 回归方程的方差分析Table 3 Analysis of variance of the regression equation for transesterification rate
回归方程的方差分析见表3。表3中P=0.0007<0.05,表明回归方程差异显著,回归方程拟合较好。
2.2.2 酶用量和甾醇添加量对转换率的影响

图5 酶用量(x2)和甾醇添加量(x3)对转换率(Y)的影响Fig.5 Response surface of the effects of enzyme amount and phytosterol amount on transesterification rate
由图5可知,在选取的条件范围内,当反应温度在0水平时,酶用量不变,随着甾醇添加量的逐渐增大,转换率逐渐升高,当达到一定值后升高速度缓慢,最后略有下降;当甾醇添加量不变时,随着酶用量的增加,转换率先增高,当达到一定值后,有所下降。由等高线图可知:转换率的极值出现在试验范围内,在84%~87%之间,在适宜的酶用量和适当的甾醇添加量,得到的转换率较高,综合两个图得出酶用量范围在1.00%~1.03%之间,甾醇添加量在5.12%~5.30%之间时,极值可取到84%~86%。
2.2.3 反应温度和甾醇添加量对转换率的影响
由图6可知,在选取的条件范围内,当酶用量在0水平时,反应温度不变,随着甾醇添加量的增加,转换率逐渐升高,当达到一定值后开始下降;当甾醇添加量不变时,随着酶用量的增加,转换率逐渐升高,当达到一定值后升高速度缓慢,最后略有下降。由等高线图可知:转换率的极值出现在试验范围内,在84%~87%之间,在适宜的反应温度和适当的甾醇添加量得到的转换率较高,综合两个图得出反应温度范围在100.00~101.20℃之间,甾醇添加量在5.18%~5.30%之间时,极值可取到84%~86%。
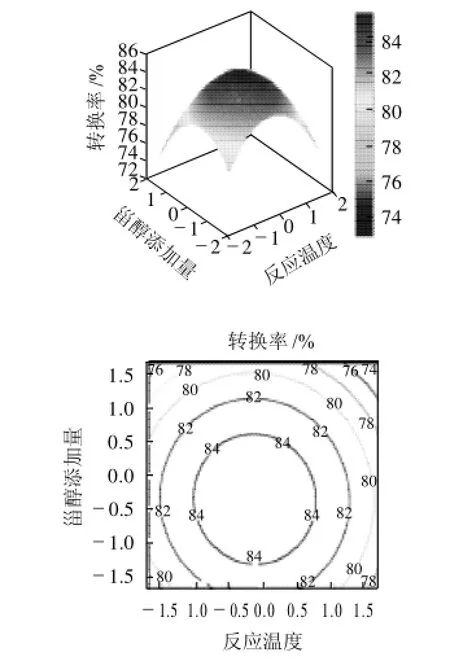
图6 反应温度(x1)和甾醇添加量(x3)对转换率(Y)的影响Fig.6 Response surface of the effects of reaction temperature and phytosterol amount on transesterification rate
2.2.4 反应温度和酶用量对转换率的影响

图7 反应温度(x1)和酶用量(x2)对转换率(Y)的影响Fig.7 Influence of reaction temperature and lipase dosage on conversion rate
由图7可知,在选取的条件范围内,当甾醇添加量在0水平时,反应温度不变,随着酶用量的增加,转换率先升高后下降;当酶用量不变时,随着反应温度的提高,转换率先升高到一定值后略有下降。由等高线图可知:脱色率的极值出现在试验范围内,在84%~87%之间,在适宜的反应温度和适当的酶用量条件下得到的转换率较高,综合两个图得出反应温度范围在100.00~101.20℃之间,酶用量在1.00%~1.02%之间时,极值可取到84%~86%。
通过等高线分析,结合实际条件,得到合成植物甾醇酯的最优反应条件为x1=-0.1392、x2=-0.0992、x3=-0.3318,即反应温度100.83℃、酶用量1.01%、甾醇添加量5.19%。将此最优条件组合代入二次回归方程中,计算出生物酶法合成植物甾醇酯的转换率为85.45%。由于实验设备所限,取反应温度101℃、酶用量1%、甾醇添加量5.2%,按照上述最优组合在反应3h条件下进行实验,得到植物甾醇的转换率为85.67%,预测值与实验值之间的良好拟合性,证实了模型的有效性。表明所得出的回归方程可以很好的体现反应温度、酶用量和甾醇添加量与转换率之间的关系,为植物甾醇合成产业化提供直接的参考依据。
3 结 论
对生物酶法合成植物甾醇酯工艺进行深入研究,通过单因素试验与响应面分析相结合,对反应温度、酶用量,甾醇添加量等植物甾醇酯的主要因素进行考察。得到植物甾醇酯合成的最佳工艺参数:反应温度101℃、酶用量1%、甾醇添加量5.2%,按照此参数反应3h,得到的植物甾醇转换率为85.67%。可为植物甾醇制品的产业化提供一定的参考。
[1]FERNANDES P, CABRAL J M S. Phytosterols: applicationsand recovery methods[J]. Bioresource Technology, 2007, 98(12): 2335-2350.
[2]KRITCHEVSKY D, CHEN S C. Phytosterols: health benefits and potential concerns: a review[J]. Nutr Res, 2005, 25(5): 413-428.
[3]许文林, 沙鸥, 钱俊红, 等. 混合植物甾醇中豆甾醇和β-谷甾醇的高效液相色谱分析[J]. 分析测试学报, 2003, 22(6): 98-100.
[4]曹万新, 孟橘, 陈吉江, 等. 精炼过程中玉米油甾醇含量的变化[J].中国油脂, 2009, 34(8): 16-18.
[5]周宝兰. 植物甾醇的应用[J]. 中国油脂, 1992(4): 33-38.
[6]贾代汉, 周岩民, 王恬. 植物甾醇降胆固醇作用研究进展[J]. 中国油脂, 2005, 30(5): 55-58.
[7]WAALKENS-BERENDSEN D H, WOLTERBEEK A P M, WIJNANDS M V W, et al. Safety evaluation of phytosterol esters. Part 3. Two-generation reproduction study in rats with phytosterol esters: a novel functional food[J]. Food Chem Toxical, 1999, 37(7): 683-696.
[8]陈茂彬, 黄琴, 吴谋成. 植物甾醇油酸酯产品的合成工艺研究[J]. 中国油脂, 2005, 30(6): 63-65.
[9]EEGEL R, SCHUBERT H. Formulation of phytosterols in emulsions for increased dose response in functional foods[J]. Innov Food Sci Emerging Technol, 2005, 6(2): 233-237.
[10]ZAWISTOWSKI J. Method of preparing microparticles of phytosterols or phytostanols: EP, 1148793[P]. 2003-08-13.
[11]HICKS K B, MOREAU R A. Phytosterols and phytostanols: functional food cholesterol busters[J]. Food Technology, 2001, 55(1): 63-67.
[12]陈茂彬, 黄琴. 植物甾醇乙酸酯和植物甾醇油酸酯抗肿瘤作用初探[J]. 中国油脂, 2003, 28(9): 49-51.
[13]JANDACK R J, WEBB M R, MATTSON F H. Effect of an aqueous pheas on the solubility of cholesterol in an oil phase[J]. Journal of Lipid Research, 1997, 18: 203-210.
[14]LEES A M, MOK H Y, LEES R S, et al. Plant sterols as cholesterollowering agents[J]. Atherosclerosis, 1977, 28(2): 325-328.
[15]WESTSTRATE J A, AYESH R, BAUER-PLANK C, et al. Safety evaluation of phytosterol esters. Part 4. Faecal concentrations of bile acids and neutral sterols in healthy normolipidaemic volunteers consuming a controlled diet either with or without a phytosterol ester-enriched margarine[J]. Food Chem Toxical, 1999, 37(11): 1063-1071.
[16]董绪燕, 孔凡丕, 袁钢友, 等. 无溶剂系统微波法合成甾醇油酸酯的研究[J]. 中国油脂, 2009, 34(7): 30-33.
[17]裘爱泳, 刘军海. 酶催化合成植物甾醇酯和植物甾烷醇酯[J]. 中国油脂, 2003, 28(6): 25-27.
Applying Response Surface Methodology to Optimize the Lipase-catalyzed Synthesis of Phytosterol Ester
WANG Teng-yu1,WANG Ming-yi2,SONG Yu-qing1,HU Li-zhi1,YU Dian-yu1,*
(1. School of Food, Northeast Agricultural University, Harbin 150030, China;2. School of Measurement-control Technology and Communication Engineering, Harbin University of Science and Technology, Harbin 150086, China)
Transesterification was conducted in soybean oil with phytosterol under the catalysis of Novozym 435 lipase. The optimum reaction conditions were obtained by single factor experiments and response surface analysis to be reaction between soybean oil and added phytosterol at a concentration of 5.2% for 3 h at 101 ℃ in the presence of 1% lipase. The rate of transesterification was 85.67% under these conditions.
phytosterol;soybean oil;transesterification;lipase
TQ645.98
A
1002-6630(2011)04-0059-05
2010-09-01
国家“863”计划项目(2010AA101503);黑龙江省教育厅科学技术研究项目(11551064)
王腾宇(1985—),男,硕士研究生,研究方向为粮油加工。E-mail:wangtengyu@yahoo.cn
*通信作者:于殿宇(1964—),男,教授,博士研究生,研究方向为大豆油脂加工技术。
E-mail:dyyu2000@yahoo.com.cn

