124例慢性粒细胞白血病染色体核型及临床作用
韩晶
慢性粒细胞白血病(chronic myclogenous leukcmia,CML)是由于造血干细胞的恶性转变而引起的,以粒系细胞慢性增殖为主要特征的恶性克隆性疾病。年发病率为1/10万,占成人白血病的15%~20%[1]。各年龄阶段均可发病,以中年为主,男女比例为1.4∶1。随着慢性粒细胞白血病进展,急变期和加速期患者可能出现染色体核型演变,对慢性粒细胞白血病进行染色体核型分析,可以有效的掌握疾病的诊断、病情监测、治疗、预后判断。对慢性粒细胞白血病染色体核型分析非常重要,现报道如下:
1 资料与方法
1.1 临床资料
选取2009年1月~2011年1月慢性粒细胞白血病124例,其中男性64例,女性60例,年龄12~79岁。CML的诊断依据张之南主编的《白血病诊断及疗效标准》(第2版[2])其中急变期7例,加速期3例,慢性期114例。
1.2 染色体分析方法
全部病例均采用直接法及不加植物血凝素的短期培养法制备染色体标本,然后采用改良的热处理姬姆萨R显带技术分析20~40个分裂中期细胞核型,并参照《人类细胞遗传学国际命名体制[ISCN(1995)]》加以描述。本实验选用BCR-ABL双色双融合DNA探针购于美国Vysis公司,ABL探针长约650 kb,覆盖9号染色体长臂侧端(3′端)的精氨基琥珀酸盐合成酶(ASS)至近着丝粒端(5′端)的第11外显子,用红色(Orange,O)荧光素直接标记。BCR探针长约1.2Mb,用绿色(Green,G)荧光素标记,所针对的基因组靶位从免疫球蛋白λ轻链(IGLV)开始,跨越BCR基因而中止于BCR基因端粒侧900 kb处,中间有300 kb长的低拷贝重复序列已从探针中去除,从而在探针所覆盖的基因中间形成一段“空隙区”覆盖了包括了M-bcr、m-bcr和μ-bcr在内的所有断裂点。
2 结果
对124例慢性粒细胞白血病染色体核型分析,观察本组病例染色体的核型及演变特点,具体见表1。
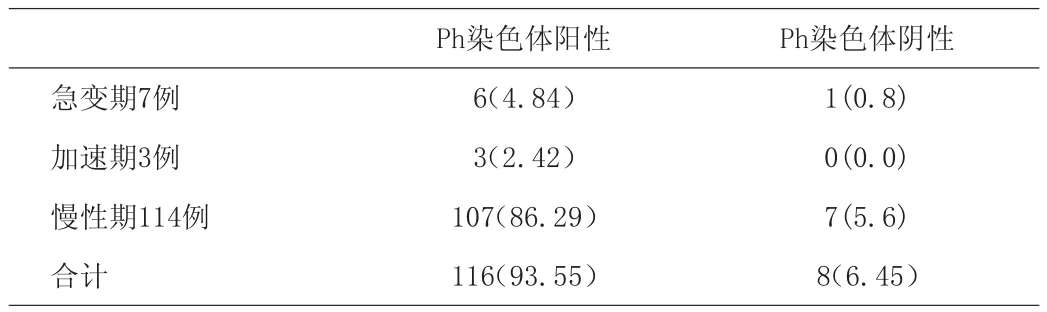
表1 本组124例染色体的核型[n(%)]
Ph染色体阳性116例中,典型Ph染色体易位110例,占94.83%;变异型染色体易位6例,占5.17%。典型 Ph染色体易位表现为t(9;22)(q34;q11);变异型染色体易位表现为t(11;22)(p15;q11)、t(13;22)(q33;q11)、t(1;22;7)(p36;q11;q22)、t(9;22;18)(q34;q11;q21)等;Ph染色体阳性116例患者中出现额外染色体13例,占11.21%;额外染色体以+8、2Ph、-21和i(17q)多见。慢性期8例,达到慢性期患者例数7.48%;加速期1例,达到加速期患者例数33.33%;急变期4例,达到急变期患者例数66.67%;额外染色体检出率,加速期和急变期检出率明显高于慢性期P<0.01有显著差异性。
3 讨论
慢性粒细胞白血病(CML)是起源于多能干细胞的恶性骨髓增殖性疾病[3]。90%以上CML病人白血病细胞中有恒定的、特征性的Ph染色体,Ph染色体是CML恶性克隆特有的标记,是其最特异的染色体异常,由此而产生的bcr/abl基因重排是CML较为特征性的分子标志,已成为CML诊断、治疗效果评价及预后判断的重要参考指标[4]。其中绝大多数为典型易位即t(9;22)(q34;q11),5%~10%病人可有变异易位(包括简单变异易位和复杂易位)[5]。
资料报道慢性粒细胞白血病Ph染色体阳性约占93%。Ph染色体阴性约占7%,与本组病例检测基本相似。对于Ph染色体阴性慢性粒细胞白血病可进一步分为Ph染色体(-)bcr abl(+)和Ph染色体(-)bcr abl(-),前者仍属于Ph染色体阳性的慢性粒细胞白血病,后者可能并非真正的慢性粒细胞白血病,而是不典型的其他骨髓增殖性疾病[6]。对慢性粒细胞白血病进行染色体及融合基因的检测,可以对本病的诊断和鉴别诊断,有着良好的指导意义,而且通过对其进行细胞遗传学分型,对慢性粒细胞白血病的治疗观察有着重要的临床价值。
[1]姜道滋,陈志妹,楼基余,等.1193例慢性粒细胞白血病细胞及分子遗传学分析[J].中华血液学杂志,2007,28(1):15.
[2]张之南.血液病诊断及疗效标准[M].2版.北京:科学技术出版社,1998:219-221.
[3]薛永权,过宇,顾建明,等.Ph染色体阴性和少见Ph易位慢性粒细胞白血病的细胞遗传学及分子生物学研究[J].中华医学杂志,2003,73(4):209.
[4]吴敏华,容伯芬,陈妙婵.骨髓细胞染色体核型分析在恶性血液病中的应用研究[J].当代医学,2010,16(24):98-99.
[5]许文荣,王建中.临床血液学与检验[M].4版.北京:人民卫生出版社,2007:268-272.
[6]王术国,管洪在,扈新花,等.慢性粒细胞白血病smac和survivin基因表达及意义[J].青岛大学医学院学报,2008,44(1):51-53.

