COX-2介导MDR1/P-gp调控人结肠癌细胞多药耐药的研究
隋华 周利红 刘宣 殷佩浩 周宁 王炎 孙珏 范忠泽 李琦
上海中医药大学附属普陀医院肿瘤科,
上海中医药大学中西医结合肿瘤介入研究所,上海 200062
多药耐药(multidrug resistance,MDR)是影响结直肠癌临床化疗疗效的重要原因之一,结直肠癌产生多药耐药的机制较为复杂,其中多药耐药基因MDR1编码的P-糖蛋白(P-glycoprotein,P-gp)在结直肠癌多药耐药中起着重要作用[1]。COX-2是花生四稀酸转化为前列腺素过程中的一个关键限速酶,是肿瘤发生、发展的重要分子靶标之一。有研究表明,COX-2过表达与结直肠癌多药耐药密切相关,是结直肠癌多药耐药重要的促进因素,但其确切的机制尚不清楚[2-3]。本实验采用含COX-2基因的重组慢病毒载体和COX-2特异性抑制剂上调或抑制人结肠癌敏感细胞HCT8和多药耐药HCT8/V细胞COX-2的表达,研究COX-2对人结肠癌细胞的化疗药物敏感性、MDR1 mRNA和P-gp表达的影响,探讨COX-2对人结肠癌细胞多药耐药的影响和调控作用。
1 材料和方法
1.1 材料
1.1.1 细胞与试剂
人结肠癌细胞株HCT8及人结肠癌多药耐药细胞株HCT8/V由上海中医药大学附属普陀医院实验中心保存。载体质粒(pFU-GW)、pGCSIL-GFP质粒和293T细胞株购于上海博古生物公司;大肠埃希菌DH-5α为本实验室保存;限制性内切酶XbaⅠ、XhoⅠ、HpaⅠ、NotⅠ、T4 DNA连接酶、PrimeSTARTM HS DNA多聚酶均购自大连宝生物公司;脂质体LipofectamineTM2000购自美国Invitrogen公司;胶回收试剂盒、质粒抽提试剂盒购自天根生物公司。COX-2特异性的抑制剂NS-398购于美国Serologllcais公司;四甲基偶氮唑盐MTT购自美国Sigma公司;总RNA抽提试剂RNAiso Reagent、荧光定量PCR试剂购于日本TaKaRa公司;GAPDH和MDR1上下游引物和探针由上海闪晶生物公司设计并合成。蛋白质抽提试剂盒(Sangon S-415)、BCA蛋白质定量试剂购于德国Merck公司;SDS-PAGE电泳试剂购自上海博彩生物技术有限公司;兔抗人P-gp单克隆抗体购自德国Merck公司。
1.1.2 仪器
Mastercyclerep银质梯度PCR仪、Biophotometer生物分光光度计、5804R高速冷冻离心机购自德国Eppendorf公司;ABI7300实时定量PCR仪购自美国ABI公司;CKX41/U-RFLT50荧光倒置显微镜购自日本Olympus公司;Chemidox化学发光成像仪购自Bio-Rad公司。
1.2 方法
1.2.1 细胞培养
人结肠癌HCT8细胞在37 ℃,CO2体积分数为5%,饱和湿度,含10%小牛血清的RPMI 1640培养液中常规培养,多药耐药HCT8/V细胞在上述培养体系基础上加入终浓度为2 μg/mL的长春新碱(VCR)以维持耐药性,细胞每1~2天传代1次,取对数生长期的细胞用于实验。
1.2.2 MTT实验
取对数生长期人结肠癌敏感细胞株HCT8和耐长春新碱细胞株HCT8/V,分别调整细胞浓度至1×105mL-1,以每孔100 μL接种于96孔细胞培养板中,在CO2体积分数为5%、饱和湿度、37 ℃孵箱中常规培养。待细胞贴壁3~5 h后,除对照组外各自加入含不同浓度化疗药物的培养基100 μL,每组设4个复孔。培养48 h后每孔加入MTT(5 mg/mL)20 μL,37 ℃温育4 h后弃上清液,加入150 μL DMSO,震荡混匀使MTT还原产物充分溶解后,酶标仪检测570 nm波长处吸光度D值。计算细胞的生长抑制率和耐药指数(resistance factor,RF)。计算公式:生长抑制率=(1-D实验组均值/D对照组均值)×100%;RF=某种药物针对抗药性细胞的IC50/某种药物针对敏感性细胞的IC50。以上实验重复3次。
1.2.3 COX-2-GFP-Lentivirus重组慢病毒载体的构建并感染人结肠癌细胞
⑴慢病毒载体的构建和鉴定 将慢病毒pFU-GW进行AgeⅠ酶切,线性化处理,1%琼脂糖凝胶电泳检测酶切片段,并回收条带。将COX-2基因PCR产物交换进入线性化慢病毒载体,加入的线性化载体DNA和纯化的PCR产物的摩尔数比例为1∶3~1∶9之间,设置阳性对照和自连对照。将构建好的载体转化入大肠埃希菌DH5α,长出克隆后进行PCR鉴定,鉴定阳性结果进行测序。⑵重组慢病毒包装 取对数生长期细胞293T细胞,按照每孔1.2×106个细胞接种。转染前2 h将细胞培养基更换为无血清培养基,待细胞70%融合时分别将慢病毒表达载体与pGCSIL-GFP质粒混匀,加入250 μL OPTI-MEM去血清培养液,并用LipofectamineTM2000共转染于相应的293T细胞组中。转染后48 h后可置于荧光显微镜下观察两组细胞绿色荧光蛋白的表达情况,确定包装成功。72 h后收集上清液,3 000 r/min离心(半径10 cm)20 min,并经0.45 μm滤膜过滤后,将病毒上清液保存于-80 ℃下备用。⑶孔稀释法测定病毒滴度 将病毒储存液按梯度稀释至(10-1~10-3),依次取10 μL加到细胞中,放入37℃,CO2体积分数为5%的培养箱中培养。48 h后更换培养液,3~4 d后观察荧光表达。正常情况下,荧光细胞数随稀释倍数增加而相应减少,计数最大稀释倍数孔中的带有荧光的细胞个数,病毒滴度(TU/mL)=(荧光细胞个数×转染时细胞数/100×每孔加入病毒稀释液体积)×100%/稀释浓度。⑷COX-2-GFP-Lentivirus重组慢病毒载体感染人结肠癌细胞 将人结肠癌HCT8和多药耐药HCT8/V细胞分为3组:⑴空白对照组:HCT8和HCT8/V结肠癌细胞株;⑵阴性重组慢病毒组:分别进行阴性慢病毒GFPLentivirus感染;⑶COX-2重组慢病毒组:分别进行过表达COX-2重组慢病毒COX-2-GFPLentivirus感染。感染前2 d以胰酶消化HCT8和HCT8/V细胞,接种于24孔板,每孔计数(1~3)×105个细胞,当细胞长至50%的培养基面积时用于感染。将病毒原液稀释1×106溶于5 mL培养基,100 μL LipofectamineTM2000溶于5 mL培养基。混合后20 min,缓慢加入HCT8和HCT8/V细胞中。24 h后将培养液换为含血清的RPMI 1640培养基培养。感染48 h后,将培养板中的细胞按1∶10比例接种,感染72 h后开始加130 μg/mL的Zeocin进行筛选,出现阳性克隆后,以100 μg/mL维持筛选15 d。
1.2.4 Real-time PCR实验
按照表1中的序列设计内参基因GAPDH和目的基因MDR1的引物和探针,用RNAiso试剂分别提取细胞总RNA,并逆转成cDNA,按Real-time PCR试剂盒方法以进行荧光定量PCR反应,体系(20 μL)如下:Premix EX TaqTM 10 μL,Rox Reference Dye 0.4 μL,上下游引物各0.4 μL,荧光探针0.8 μL,dH2O 6 μL,cDNA 2 μL,反应条件: 95 ℃预变性10 s,95 ℃变性5 s,60 ℃退火延伸31 s,40个循环,数据采用ABI 7300 SDS Software分析。相对mRNA表达水平按以下公式计算:相对mRNA表达量=2-△Ct,△Ct=Ct靶基因- CtGAPDH。
1.2.5 Western blot实验
收集对数生长期各组细胞约2×106/组,用预冷PBS洗涤2次,吸弃PBS,加入预冷的蛋白裂解液在冰上裂解0.5 h,14 000×g离心15 min,吸弃上清液;BCA分析试剂测定蛋白质浓度。50 μg总蛋白质在SDS聚丙烯酰胺凝胶电泳中电泳,PVDF膜转膜,5%脱脂奶粉封闭非特异性抗体,然后分别加入1∶1 000鼠抗人COX-2抗体,4 ℃过夜。次日用TBS/T洗膜3次,再加入HRP标记的二级抗体,室温温育1 h,ECL显色。β-actin作内参对照,分析灰度值进行计算灰度系数比。
1.3 统计学处理
采用SPSS 13.0统计软件包处理数据。各组数据采用表示,两独立样本均数比较,采用Independent-samplestTest,多样本均数比较采用单因素方差分析,均数间两两比较采用SNK-q检验(Student-Newman-Keuls法),计算组间差异。P<0.05为差异有统计学意义。
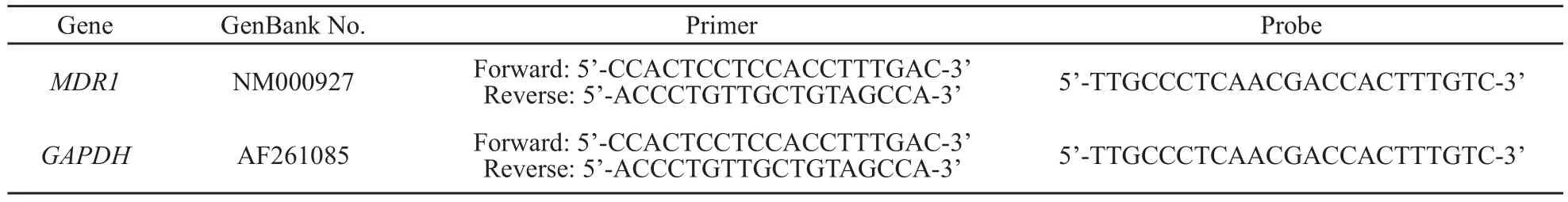
表 1 实时荧光定量PCR检测所需MDR1和GAPDH引物序列Tab.1 RFQ-PCR primers and Taqman probes sequences of MDR1 and GAPDH
2 结 果
2.1 人结肠癌细胞对多种化疗药物的敏感性
不同浓度的化疗药VCR、DDP、5-FU、THP对人结肠癌HCT8细胞48 h的IC50值分别为(18.2±7.1) μg/mL、(10.2±0.8) μg/mL、(7.5±0.8) μg/mL和(7.6±0.9) μg/mL;而对多药耐药HCT8/V细胞48 h的IC50值分别为(191.1±18.2) μg/mL、(290.8±28.4) μg/mL、(23.1±2.0) μg/mL和(26.4±2.9) μg/mL,HCT8/V细胞的耐药指数分别为10.49、28.37、3.09和3.47,与HCT8细胞相比,HCT8/V细胞细胞具有明显的多药耐药性(P<0.01,表2)。
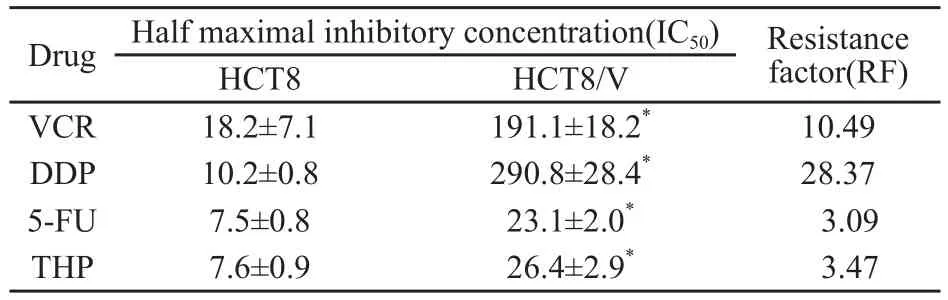
表 2 4种化疗药物对HCT8和HCT8/V敏感性的影响Tab.2 Effect on cytotoxicity of 4 chemotherapeutic drugs in HCT8 and HCT8/V cells
2.2 稳定高表达COX-2的细胞株克隆
携带有COX-2基因的重组慢病毒载体COX-2-GFP-Lentivirus感染人结肠癌HCT8和HCT8/V细胞后发出亮绿色的GFP荧光,荧光显微镜观察48 h的感染率>80%(图1)。

2.3 COX-2-GFP-Lentivirus对人结肠癌细胞COX-2表达的影响
含COX-2基因的重组慢病毒表达载体(COX-2-GFP-Lentivirus)感染人结肠癌HCT8和HCT8/V细胞后,提取细胞总蛋白进行Western blot检测COX-2蛋白表达。结果显示,感染含COX-2基因的重组慢病毒后,HCT8细胞内COX-2表达显著上升,与对照组相比,差异具有统计学意义(P<0.05),而HCT8/V细胞由于基础表达量较高,与对照组相比COX-2表达增加不明显(图2)。

2.4 COX-2对人结肠癌细胞化疗药物敏感性的影响
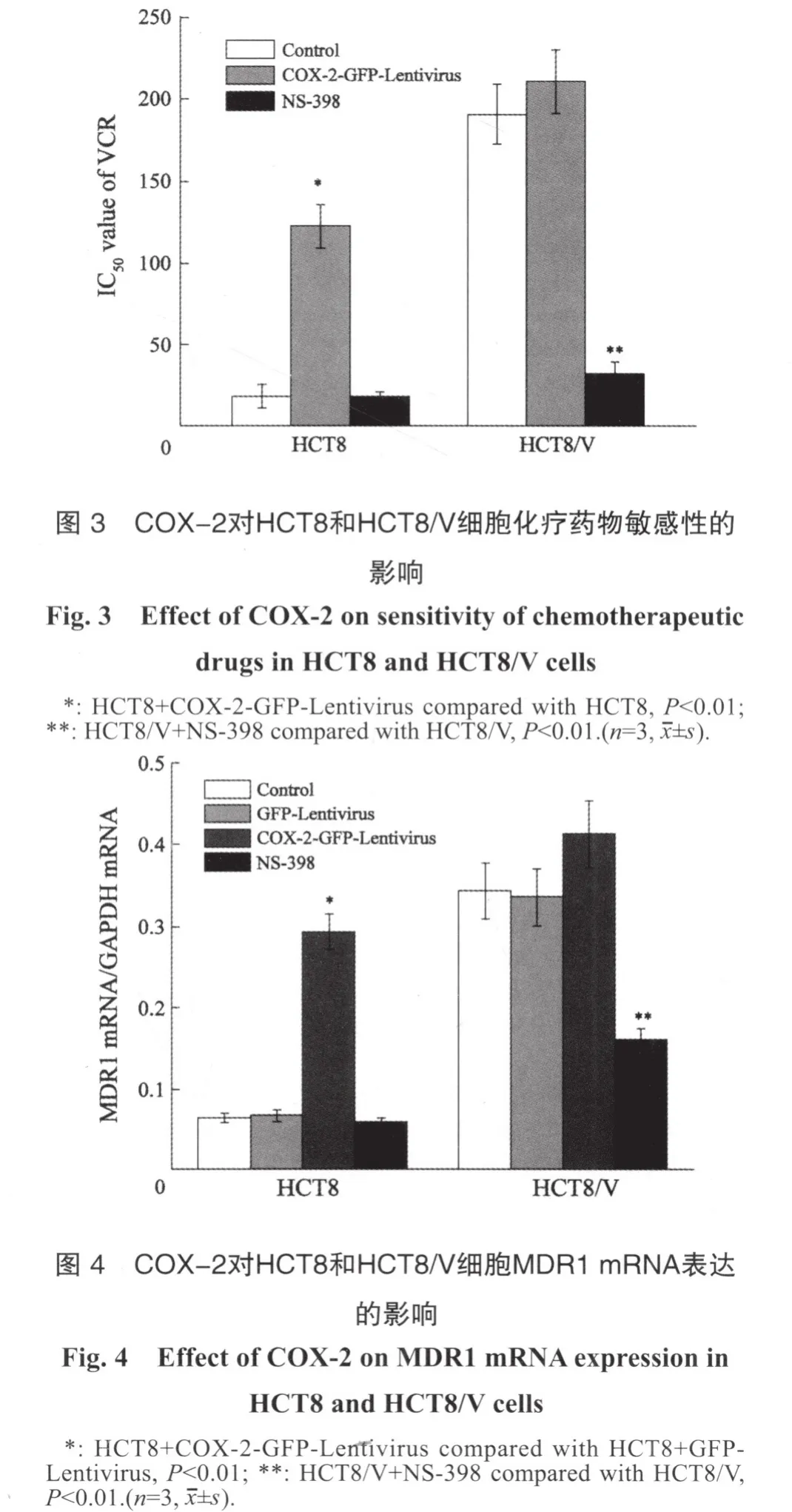
感染COX-2-GFP-Lentivirus后,人肠癌HCT8细胞对VCR对的IC50值从(18.2±7.1)μg/mL上升为(122.5±13.4)μg/mL,差异具有统计学意义(t=11.9,P<0.01);而抑制HCT8细胞COX-2后,细胞对VCR的敏感性无明显变化。感染COX-2-GFP-Lentivirus后HCT8/V细胞对VCR的敏感性无明显变化(P>0.05);而用NS-398(20 μmol/L,2 h)抑制HCT8/V细胞COX-2表达后,VCR对HCT8/V细胞的IC50值从(191.1±18.2) μg/mL下降到(32.2±7.5)μg/mL(t=14.0,P<0.01,图3),提示调控COX-2的表达可以调节结肠癌细胞对化疗药物的敏感性。
2.5 COX-2对人结肠癌细胞MDR1 mRNA表达的影响
RFQ-PCR检测结果显示,HCT8/V细胞的MDR1 mRNA表达明显高于HCT8细胞,两者相比,差异有统计学意义(P<0.01)。感染COX-2-GFP-Lentivirus后,与对照组相比,HCT8细胞MDR1 mRNA表达明显增加(P<0.01);而抑制COX-2表达后(NS-398,20 μmol/L,2 h),HCT8/V细胞MDR1 mRNA表达下降了53.3%,与对照组相比,差异有统计学意义(P<0.01,图4)。
2.6 COX-2对人结肠癌细胞P-gp表达的影响
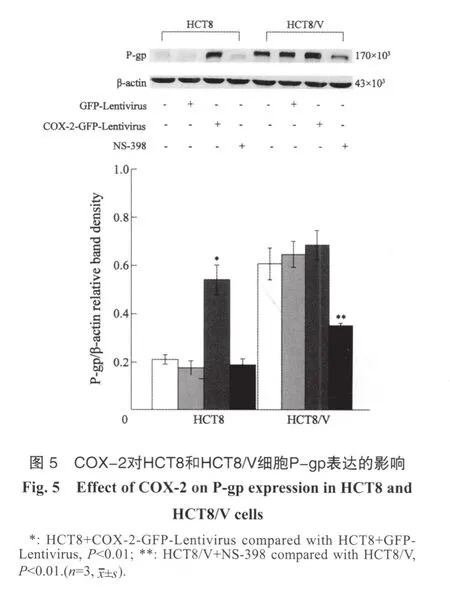
Western blot结果显示,人结肠癌多药耐药HCT8/V细胞P-gp表达明显高于HCT8细胞。感染COX-2-GFP-Lentivirus后,HCT8细胞P-gp表达明显增加,与对照组相比,差异具有统计学意义(P<0.01)。而抑制COX-2(NS-398,20 μmol/L作用2 h)后,HCT8/V细胞P-gp表达下降了42.5%,差异具有统计学意义(P<0.01)。提示COX-2可以上调结肠癌HCT8细胞的P-gp表达,而抑制COX-2表达则可降低HCT8/V细胞的P-gp表达,说明COX-2能够调控结肠癌细胞P-gp的表达(图5)。
3 讨 论
多药耐药是指肿瘤细胞长期接触某一化疗药物,不仅对此种化疗药物产生耐药性,而且对其他结构和功能不同的抗肿瘤药物也产生交叉耐药性的现象,是造成化疗失败的主要原因[4]。有研究表明,结直肠癌是MDR1/P-gp表达水平及频率最高肿瘤之一[5]。当药物进入细胞后,P-gp结合药物分子,同时其ATP位点结合ATP后释放能量,使药物转运到细胞外,同时也可直接从细胞膜排除药物,使细胞内药物浓度始终维持在低水平,细胞由此产生耐药。因此,针对P-gp调节的研究,是目前逆转结直肠癌细胞多药耐药、提高化疗敏感性、减少结直肠癌化疗失败的重要途径[6]。
研究发现,COX-2与MDR1/P-gp等耐药相关基因关系密切,可调节肿瘤细胞MDR基因的表达[7]。COX-2为诱导型合酶,静息时不表达,当细胞受到各种诱导因子刺激时可迅速合成,是炎症过程中一个重要的诱导酶,并参与肿瘤的发生及发展,可作为炎症及肿瘤的一个重要的治疗靶分子[8-10]。临床研究显示,结肠癌组织中COX-2蛋白呈高表达,其表达量较其周围的正常黏膜有显著增强,是结肠癌发生、发展、侵袭的重要致癌因子[11]。
有研究发现,在消化道肿瘤中,COX-2的表达与MDR1/P-gp具有明显正相关性,并且抑制COX-2的活性可以降低MDR1/P-gp介导的多药耐药[12]。Zatelli等[13]研究证实,NS-398可抑制乳腺癌rMCF7细胞内P-gp的表达,提高其对化疗药物的敏感性。本实验发现抑制COX-2表达能使HCT8/V细胞对化疗药物更加敏感,降低细胞的耐药性而增加化疗药物对细胞的杀伤作用;进一步研究证实COX-2的下调会直接降低HCT8/V细胞的MDR1 mRNA和P-gp的水平。说明COX-2可能通过降低MDR1的表达,影响P-gp的药泵功能从而引发多药耐药的。此结果与Zrieki等[14]在人结肠腺癌Caco-2细胞中的发现相一致。
与传统过表达质粒载体系统相比,慢病毒载体系统具有感染效率高、基因表达稳定、不易引起免疫反应等优点[15-17]。本研究结果发现上调COX-2的表达可以增强HCT8细胞对化疗药物的耐药性,与Miller等[18]的研究结果相一致。说明COX-2基因可以诱发敏感细胞向耐药细胞的转变,降低正常肿瘤细胞对化疗药物的敏感性。为了更进一步证实这种想法,我们采用RFQ-PCR、Western blot检测细胞被COX-2-GFP-Lentivirus干预后MDR1 mRNA、P-gp的表达,结果发现:上调COX-2表达后,HCT8细胞的MDR1/P-gp表达明显升高,提示COX-2可以引起肿瘤的多药耐药现象的发生,其机制可能是通过介导MDR1/P-gp的表达实现的。
综上所述,本研究结果显示,上调COX-2的表达具有明显增加HCT8细胞耐药性的作用,抑制COX-2可降低HCT8/V耐药细胞MDR1 mRNA、P-gp的表达,从而逆转多药耐药。这为以后深入探讨COX-2对人结直肠癌多药耐药现象的发生、发展提供实验依据。
[1]Pajak B, Orzechowski A.Overview how adenocarcinoma cancer cells avoid immune- and chemotherapy-induced apoptosis [J].Adv Med Sci, 2006, 51: 39-45.
[2]Menter DG, Schilsky RL, DuBois RN.Cyclooxygenase-2 and cancer treatment: understanding the risk should be worth the reward [J].Clin Cancer Res, 2010, 16(5): 1384-1390.
[3]张梦曦, 顾康生.化疗药物与肿瘤细胞环氧化酶-2表达及多药耐药之间相互关系的研究进展[J].临床肿瘤学杂志, 2009, 14(4): 377-380.
[4]Kuo MT.Roles of multidrug resistance genes in breast cancer chemoresistance [J].Adv Exp Med Biol, 2007, 608: 23-33.
[5]李艳红, 王永华, 李燕, 等.MDR1基因多态性及其临床相关性研究进展 [J].遗传学报, 2006, 33(2): 93-104.
[6]隋华, 李琦.JNK/SAPK信号转导通路与多药耐药机制的研究[J].肿瘤防治研究, 2010, 37: 844-847.
[7]Bassiouny AR, Zaky A, Neenaa HM.Synergistic effect of celecoxib on 5-fluorouracil-induced apoptosis in hepatocellular carcinoma patients [J].Ann Hepatol, 2010,9(4): 410-418.
[8]Gasparini G, Longo R, Sarmiento R, et al.Inhibitors of cyclooxygenase 2: a new class of anticancer agents? [J].Lancet Oncol, 2003, 4(10): 605-615.
[9]Zidar N, Odar K, Glavac D, et al.Cyclooxygenase in normal human tissues--is COX-1 really a constitutive isoform, and COX-2 an inducible isoform? [J].J Cell Mol Med, 2009,13(9B): 3753-3763.
[10]Subbaramaiah K, Dannenberg AJ.Cyclooxygenase2: a molecular target for cancer prevention and treatment [J].Trends Pharmacol Sci, 2003, 24(2): 96-102.
[11]Haile RW, Yochim JM, Cortessis VK, et al.A molecular/epidemiologic analysis of expression of cyclooxygenases 1 and 2, use of nonsteroidal antiinflammatory drugs, and risk of colorectal adenoma [J].Clin Colorectal Cancer, 2005, 4(6):390-395.
[12]Patel VA, Dunn M, Sorokln A.Regulation of MDR1(p-glycoprotein) by cyelooxygenase-2[J].J Biol Chem,2002, 277(41): 38915-38920.
[13]Zatelli MC, Luchin A, Tagliati F, et al.Cyclooxygenase-2 inhibitors prevent the development of chemoresistance phenotype in a breast cancer cell line by inhibiting glycoprotein p-170 expression [J].Endocr Relat Cancer,2007, 14(4): 1029-1038.
[14]Zrieki A, Farinotti R, Buyse M.Cyclooxygenase inhibitors down regulate P-glycoprotein in human colorectal Caco-2 cell line [J].Pharm Res, 2008, 25(9): 1991-2001.
[15]孟坡, 任兆瑞.慢病毒载体介导的转基因整合位点研究方法[J].医学分子生物学杂志, 2008, 5(5): 436-439.
[16]王雪峰, 何援利.携带人bcl-2基因的慢病毒表达载体的构建及其在人原代卵巢颗粒细胞中的表达[J].南方医科大学学报, 2008, 28(10): 1856-1859.
[17]宋丽萍, 李跃萍, 邱曙东, 等.NT4-p53(N15)-Ant重组慢病毒的构建及其对肝癌细胞的杀伤效应[J].中华肿瘤杂志, 2010, 32(1): 10-16.
[18]Miller B, Patel VA, Sorokin A.Cyclooxygenase-2 rescues rat mesangial cells from apoptosis induced by adriamycin via upregulation of multidrug resistance protein 1 (P-glycoprotein)[J].J Am Soc Nephrol, 2006 , 17(4): 977-985.

