卵巢浆液性囊腺癌及囊腺瘤的差异蛋白质组学分析
刘彦红,刘红燕,张立会*,田雪红,聂建国
(1.吉林大学白求恩第一医院,吉林长春130021;2.吉林大学第二医院;3.内蒙古根河市满归中心卫生院)
1 材料及方法
1.1 标本采集
均取自吉林大学第二医院妇科,卵巢浆液性囊腺癌(CA组)(IIIc期)与卵巢浆液性囊腺瘤(BE组)的组织标本各6例。已告知患者取组织学标本用途,并同意取材。标本病理资料由吉林大学第二医院病理科证实。手术标本均在30分钟内置于-80℃低温冰箱内保存。
1.2 蛋白样品制备
将融化的标本置于无菌培养皿中,用磷酸盐缓冲液进行冲洗,去除黏附的血红蛋白和其他蛋白。然后把标本切成1 mm3大小,置入液氮中,研磨粉碎。然后用裂解液进行溶解,裂解液成分包括7M尿素,2 M硫脲,2%CHAPS,50 mM Tris,和50 mM DTT,1 mM PMSF and 1 μ g/ml蛋白酶抑制剂。同时加入DNA酶与R NA酶去除DNA和RNA。然后在100 000 g条件下离心1小时去除不溶解成分。所有样品用Bradford方法测定蛋白浓度后置-80℃保存。
1.3 蛋白质酶切
酶切前所有样品用25 mM NH4HCO3稀释使尿素浓度低于2 M。酶切时首先用20 mM DTT在56℃条件下还原1小时,再在常温下避光用50 mM碘乙酰胺烷基化30分钟,然后按1∶50比例加入测序级胰酶37℃酶切过夜。酶切后样品真空抽干后-80℃保存备用。
1.4 二维液质联用分析
所有样品用缓冲液A(0.1%甲酸)溶解后,应用二维液质联用进行分析,每次实验上样量为50μ g。强阳离子柱为150 mm×0.32 mm,反相柱为150 mm×0.17 mm,强阳离子柱的乙酸氨洗脱方法为12.5 mM,25mM,50 mM,75 mM,250 mM和5 M。反相柱洗脱方法为5%-30%缓冲液B(0.1%甲酸,99.9%乙腈,流速为2 μ l/min),洗脱时间为 3小时。每个样品做两次实验。经反相色谱洗脱的多肽应用LTQ XL质谱仪进行检测,m/z检测范围为400~2 000 amu,应用数据依赖方式进行次二级质谱扫描(每次全扫描后做10次二级扫描,母离子m/z宽度为3 amu,35%标准碰撞能量,动态排除时间为1.5 min)。
1.5 数据处理
强度在10个单位以上、有10个以上离子信号的谱图用SEQUEST算法和相关Bioworks 3.3.1 SP1软件包进行数据库检索,鉴定出相关多肽和蛋白。蛋白数据库为从欧洲生物信息学院网站(http://www.ebi.ac.uk/IPI/)下载的人蛋白质数据库(3.58版)。相关检索参数如下:多肽质量误差范围为3 Da,半胱氨酸修饰为+57,完全酶切肽段,可以有两个误切位点。SEQUEST检索后筛选参数如下:(1)Rsp=1;(2)在假阳性率为1%时,DeltaCn>=0.2,Xcorr值在单电荷时为1.7,双电荷时为3.2,三电荷时为3.3。
1.6 结果判定
本研究应用两次实验中每个蛋白的谱图数来评价其丰度。对于在不同样品中丰度发生变化的蛋白,其谱图数变化必须满足以下原则:(1)两个样品中谱图数的比值大于等于2。(2)两个样品中谱图数的差值大于等于24(平均每次实验差值为12)。为评价上述方法用于鉴别蛋白丰度变化的假阳性率,每个样品的两次实验之间进行了相互比较分析,相应假阳性率为1.4%。
2 实验结果
2.1 1D-PAGE
将卵巢浆液性囊腺癌组(CA组)与卵巢浆液性囊腺瘤组(BE组)混合样品进行1D-PAGE,获得差异表达条带,如图1所示,然后对酶切后的样品的蛋白质组进行分析。
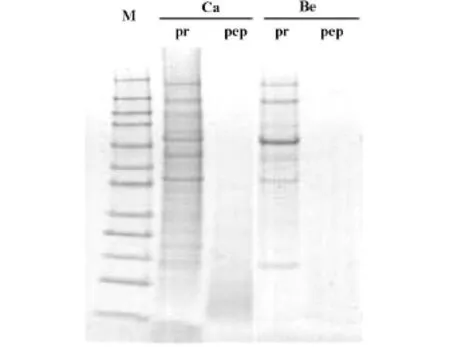
图1 the image of 1D-PAGE
2.2 质谱分析结果
从卵巢浆液性囊腺癌组(CA组)与卵巢浆液性囊腺瘤组(BE组)的组织标本获得的两个混合样品,采用液质联用技术都进两次实验,综合两次实验结果,从卵巢浆液性囊腺癌组中鉴定出共计1 085个蛋白,从卵巢浆液性囊腺瘤组中鉴定出共计381个蛋白。然后根据差异蛋白的判定原则最终鉴定出卵巢浆液性囊腺癌和卵巢浆液性囊腺瘤两组间差异蛋白数共计128个。
2.3 卵巢浆液性囊腺癌组与囊腺瘤组的差异蛋白结果
本实验从卵巢浆液性囊腺癌组与卵巢浆液性囊腺瘤组间共鉴定出128个差异蛋白。其中116个蛋白表达上调,12个蛋白表达下调。其中下调的蛋白有:基膜聚糖,胶原a-3(VI)2、3、4前体,胶原 XIV-A1,结蛋白,组蛋白 H1 1-D 链,POTEE,核心蛋白多糖,纤维调节素,PRELP,骨诱导因子。
两组间鉴定出的差异蛋白中主要包括细胞外基质成分、细胞骨架成分、与肿瘤核酸代谢异常相关蛋白、DNA修复基因、与肿瘤物质及能量代谢异常的相关蛋白、与肿瘤细胞凋亡异常相关蛋白、分子伴侣蛋白、肿瘤免疫相关蛋白及少数其他与卵巢癌发生、发展、浸润及转移有关的蛋白。
其中16个蛋白为细胞外基质的组成成分:胶原蛋白XIIA1与XIV-A1,胶原a-3(VI)2、3、4前体,纤维连接蛋白,纤维蛋白原A、B、G,骨膜蛋白,PRELP,POTEE,纤维调节素,基膜聚糖,核心蛋白多糖,骨诱导因子。
其中24个蛋白为细胞骨架成分:微管蛋白A1A、A1B、A4A、B、B2A、B2C 与 B3,肌动蛋白 B,Alpha-辅肌动蛋白-4,细胞质内动力蛋白1重链1,肌动蛋白素1,肌球蛋白6B、9、14,角蛋白8,结蛋白,玻连蛋白,网蛋白 1,膜联蛋白 A1、A2与A5,网格蛋白,踝蛋白1,衣被蛋白(COPA)。
其中14个与肿瘤核酸的代谢异常有关:DEAD盒蛋白17,延伸因子TUFM,延伸因子1A1、1-B、2,真核细胞起始因子4A-I,YWHAZ,信号传导子及转录激活子1,转醛醇酶1,转酮醇酶,胸苷磷酸化酶,葡萄球菌核酸酶1,细胞质内的色氨酰-转移核糖核酸合成酶,DNA依赖蛋白激酶催化亚单位。
2个DNA修复基因:X线交错互补修复基因5、6。
其中31个蛋白与肿瘤物质、能量代谢异常相关:胞液氨基肽酶3,肽酰-脯氨酰-顺反式异构酶A、B,羟类固醇脱氢酶17B10,烯醇化酶1,磷酸甘油酸脱氢酶,过氧化氢酶1,组织蛋白酶D,果糖二磷酸醛缩酶A,谷酰氨脱氢酶1,线粒体异柠檬酸脱氢酶2,磷酸丙糖异构酶 1,谷胱甘肽S转移酶 P1,甘油醛3磷酸脱氢酶,磷酸甘油酸激酶1,苹果酸脱氢酶2,线粒体腺苷酸激酶2,丙酮酸激酶M2,丙酮酸脱氢酶复合物,糖基磷脂酰肌醇,线粒体三功能酶亚单位A、B,过渡时期内质网ATP酶,线粒体细胞色素b-c1复杂亚单位2,线粒体内细胞色素C氧化酶5A,三磷酸腺苷合酶 1A1、5A1、5B、50,干扰素诱导GTP结合蛋白1,GDP解离抑制因子2。
其中15个蛋白与细胞凋亡有关:簇集蛋白,核糖体蛋白SA、S7,不均一核蛋白U和M 和C,核仁蛋白,组蛋白2AFJ,组蛋白 2A 的同工型,H2A-2A(3 、4)、H2A-1-B/E、H2B1-L、H2B1-N、H2B3-B、H1 1-D。
其中 16个蛋白为分子伴侣蛋白:T-复合蛋白2、3、5,热休克蛋白A1(A、B)、A1L、A5、A8、A9、90AB1、90B1、 B1、D1,抑制素,泛素样活化酶1,组织缺氧正调蛋白1,核磷蛋白1。其中3个蛋白与肿瘤免疫有关:抗原提呈蛋白1,补体4A,丝氨酸蛋白酶抑制剂1。
其他7蛋白:细胞内通道蛋白氯化物1,SAMHD1,GANAB,TMED10,RPN1,PDIA3,血红素亚单位G1。
3 讨论
本实验鉴定出的卵巢浆液性囊腺癌与卵巢浆液性囊腺瘤两组间差异蛋白中包括了16个细胞外基质蛋白。其中胶原蛋白 IV、纤维连接蛋白1、骨膜蛋白、PRELP与肿瘤的浸润生长及转移密切相关。胶原VI的表达与肿瘤分级有关,与卵巢癌预后有关[1]。骨膜蛋白与肿瘤血管形成有关[2],其表达与卵巢癌的生长、侵袭、血管生成、转移及较差的预后密切相关[3]。基膜聚糖的表达与各种恶性肿瘤的增长和转移相关,但其具体机制仍不明确[4]。大量研究显示其在多种恶性肿瘤中呈低表达。核心蛋白多糖是一种胶原纤维相关的蛋白多糖,目前研究显示核心蛋白多糖通过细胞因子介导的免疫抑制和细胞周期蛋白的丢失对肿瘤的生长起负性调节作用。Grant等[5]认为核心蛋白多糖可以干扰肿瘤血管的形成。国外研究资料显示核心蛋白多糖在不同肿瘤组织中的表达是复杂的、多样化的[6]。OGN可能作为转录因子的下游靶基因介导肿瘤的发生和发展[7]。
细胞骨架有微管、微丝和中间纤维三种类型,它们的破坏可能与肿瘤的恶性增殖及侵袭有关。本实验鉴定出了24个细胞骨架蛋白。微管蛋白A、B蛋白聚合及解聚及表达异常与肿瘤的恶性生物学行为密切相关[8]。已经有报道[9]微管蛋白在许多恶性肿瘤中均存在局部分布和异常表达。肌动蛋白B异常表达可能与肿瘤细胞的恶性增殖和侵袭有关[10]。有研究发现Alpha-辅肌动蛋白-4与细胞运动能力及癌细胞转移相关,在卵巢浆液性囊腺癌中表达升高[11],并与其分期有关。肌动蛋白素1在食管鳞状细胞癌中的表达与浸润深度,淋巴结转移和病理分期性呈正相关[12]。角蛋白参与中间丝形成过程,是上皮细胞与间皮细胞的肿瘤标记物。Wikman等[13]运用cDNA芯片技术发现在肺腺癌组织中表达上调,并认为有可能作为诊断肺腺癌的新标记。结蛋白是一种特异性很高的肌源性肿瘤标志物。玻连蛋白可以增加角蛋白合成与迁移[14],参与卵巢癌转移的初始阶段[15]。踝蛋白是一种粘着斑复合蛋白,通过粘着斑信号途径和抵制细胞脱落促进肿瘤的侵润及转移的蛋白。
其中14个与肿瘤核酸及蛋白质的代谢异常有关。转醛醇酶1与转酮醇酶是磷酸戊糖代谢非氧化途径的关键酶,其活性改变与肿瘤密切相关。胸苷磷酸化酶又被称为肿瘤相关血管生成因子,在体内多种肿瘤中,其表达明显增高,与肿瘤的血管生成关系密切,并可能通过血管生成作用促进癌细胞的生长和转移,从而促进肿瘤的进展[16],而肿瘤的微血管密度是反映癌组织血管生成的重要指标。Hata等[17]发现它在卵巢癌中的表达与病程分期正相关。
其中31个蛋白与肿瘤物质、能量代谢异常相关,其中肿瘤M2型丙酮酸激酶是近年来研究发现的一种新的肿瘤标志物,在宫颈癌、乳腺癌等肿瘤的早期诊断非常有价值。谷胱甘肽转移酶(GSTpi)是一种能降解许多潜在致癌物质的酶[18]。GSTpi表达缺失本身是一个易发生恶性变的基因表现型[19]。它的表达的增加与卵巢癌[20]预后差有关。组织蛋白酶D,可催化降解基质膜,促进肿瘤的侵袭、转移[21]。Chinni等[22]用卵巢癌患者血清中检测到的肿瘤反应性免疫球蛋白,后证实为组织蛋白酶D和葡萄糖调节蛋白78(热休克蛋白家族成员)鉴别卵巢癌细胞系和正常卵巢。
其中15个蛋白与细胞凋亡有关。其中簇集蛋白是一种新近被发现的凋亡抑制因子,与肿瘤的发生、发展相关[23]。Hough等[24]用cDNA芯片技术检测卵巢癌发现其在卵巢癌中表达上调。杨国奋等[25]发现其过表达与卵巢癌临床分期正相关,与肿瘤细胞凋亡显著负相关。有研究发现,核仁蛋白在许多种癌细胞的表面表达的特性使它可能被用于癌症的诊断及抗癌药物的研究[26]。Lee等[27]发现,hnRNPC的上升,可能诱导p27翻译而产生抑制细胞生长的作用。
本实验鉴定出了16个分子伴侣蛋白。研究表明多种肿瘤组织细胞表达一种或多种HSP。目前认为HSP家族可能通过抑制细胞凋亡来导致肿瘤形成。Yamada等[28]认为Hsp90B能够抑制细胞的调亡和分化,核磷蛋白1是一种多功能蛋白质,参与多种肿瘤的发生[29]。在肿瘤细胞和生长期细胞中NPM的含量明显高于静止期细胞。而在分化和凋亡细胞中,NPM的表达水平下调。在多种肿瘤中,NPM的表达水平与肿瘤发展阶段呈正相关,表明核磷蛋白具有癌基因的功能[30]。
本实验鉴定出了3个与肿瘤免疫相关蛋白,其中抗原提呈蛋白的低表达常预示着肿瘤的临床进程加快和预后不良[31]。hC4·4A可能与肿瘤的侵袭转移相关[32],补体4A mRNA在乳腺癌等多种肿瘤组织中表达上调,在转移组织中表达强度更高。丝氨酸蛋白酶抑制剂1其同家族成员maspin、Kunitz、Headpin型基因已经被认为与抑制肿瘤浸润转移有关[33]。
过去血红素亚单位G1可能会被认为是污染蛋白,但是现在有人认为[34]血红素其它亚型A、B可以用于联合诊断卵巢癌并监测疾病进展,但是尚需扩大样本量以获得准确的特异度和敏感度。
本实验鉴定出的卵巢浆液性囊腺癌与卵巢浆液性囊腺瘤的差异蛋白中,胶原蛋白,纤维结合蛋白1,骨膜蛋白,POTEE,基膜聚糖,核心蛋白多糖,骨诱导因子,微管蛋白A、B,肌动蛋白,Alpha-辅肌动蛋白-4,肌动蛋白素,角蛋白8,结蛋白,玻连蛋白,膜联蛋白A1、A2,延伸因子2,YWHAZ,踝蛋白1,转酮醇酶1,丙酮酸激酶,组织蛋白酶D,胸苷磷酸化酶,X线交错互补修复基因6,谷胱甘肽转移酶,簇集蛋白,核仁蛋白,核磷蛋白1,抑制素,热休克蛋白90,抗原提呈蛋白1,补体4A等33个蛋白已经有研究显示出其异常表达与恶性肿瘤的相关性,并认为有可能成为诊断恶性肿瘤的标志物。这些蛋白中除胶原蛋白,骨膜蛋白,POTEE,Alpha-辅肌动蛋白-4,玻连蛋白,胸苷磷酸化酶,丙酮酸激酶,簇集蛋白及核磷蛋白1,延伸因子2,热休克蛋白90等11种蛋白已有报道在卵巢癌中异常表达之外,均未见与卵巢癌相关性报道。这些蛋白在卵巢浆液性囊腺癌及卵巢浆液性囊腺瘤的鉴别诊断中的具体价值,尚需大量临床实验验证,并与其他五组实验结果比较分析后鉴定出有价值的用于早期卵巢癌诊断的肿瘤标志物。
众所周知,恶性肿瘤在蛋白质、脂类的合成代谢增强,氨基酸分解代谢显著降低,糖酵解异常,目前随着代谢组学技术的发展,这些与代谢相关蛋白有利于用于卵巢癌诊断的代谢组学识别模式的建立。
1D-PAGE的图表示的是酶切前后两个样品的结果,一方面说明这两个样品是有差异的,另一方面说明本酶切效率比较好,酶切后的肽段都在分子量10 KD以下。
本实验结果显示,二维液质联用技术是鉴定差异表达蛋白质图谱的有用工具,在本实验中为了降低实验结果的假阳性率,对两组标本进行了两次实验,两次实验结果相近,这一点说明此实验方法具有较好的重复性。但是由于本实验的样本量尚少,尚需要加大样本量进行验证。
卵巢浆液性囊腺癌与卵巢浆液性囊腺瘤两个样品所鉴定出的总蛋白数差别较大,可能的原因包括:组织构成的差别,蛋白提取效率的差别。所以鉴定出的差异蛋白反映的可能是两种疾病的部分差别,还需更进一步的研究。
总之,本实验从卵巢浆液性囊腺癌及卵巢浆液性囊腺瘤中鉴定出的差异蛋白中,其中许多蛋白在卵巢浆液性囊腺癌中的表达异常为首次报道。这些蛋白将有利于卵巢浆液性囊腺癌及卵巢浆液性囊腺瘤的鉴别诊断。将与其他五组实验结果进行对比分析,最终鉴定出有价值的用于卵巢癌早期诊断的肿瘤标志物。其中与肿瘤物质和能量代谢异常相关的蛋白质可以用于卵巢癌诊断的代谢组学识别模式的建立。此实验筛选出的差异蛋白质有助于完善现有的卵巢癌的蛋白质组数据库。
[1]Sherman Baust CA,Weeraratna AT,Rangel LB,Pizer ES,et al.Remodeling of the extracellular matrix through overexpression of collagen VI contributesto cisplatin resistance in ovarian cancer cells[J].Cancer Cell,2003,3(4):377.
[2]Kudo Y,Siriwardena BS,Hatano H,et al.Periostin:novel diagnostic and therapeutic target for cancer[J].Histol Histopathol,2007,22(10):1167.
[3]Gillan L,Matei D,FishmanDA,et al.Periostin secreted by epithelial ovarian carcinoma is a ligand for aVb3 and aVb5 integrins and promotes cell motility[J].Cancer Res,2002,62:5358.
[4]Nikitovic D,Katonis P,Tsatsakis A,et al.Lumican,a small leucine-rich proteoglycan[J].IUBMB Life,2008,60(12):818.
[5]Grant D S,Yenisey C,Rose R W,et al.Decorin suppresses tumor cell-mediated angiogenesis[J].Oncogene,2002,21(31):4765.
[6]Berto AG,Sampaio LO,Franco CR,et al.A comparative analysis of structure and spatial distribution of decorin in human leiomyoma and nor mal myometrium[J].Biochim Biophys Acta,2003,1619(1):98.
[7]Tasheva ES.Analysis of the promoter region of humanmimecan gene[J].BiochimBiophys Acta,2002,1575(1/3):123.
[8]Fujisaw a H,Reis RM,N akamura M,et al.Loss of heterozygo sity on chromo some 10 ismore extensive in primary than in secondary glioblastomas[J].Lab Invest,2000,80(1):65.
[9]Giarnieri E,De Francesco G P,Carico E,et al.Alpha-and beta-tubulin expression in rectal cancer development[J].Anticancer Res,2005,25(5):3237.
[10]Jordan MA,Wilson L.Microtubules and actin filaments:dynamic targets for cancer chemotherapy.Curr Opin Cell Biol,1998 Feb;10(1):123.
[11]Yamamoto S,Tsuda H,Honda K,et al.Actinin-4 expression in ovarian cancer:a novel prognostic indicator independent of clinical stage and histological type[J].Mod Pathol,2007,20(12):1278.
[12]Wang WS,Zhong HJ,Xiao DW,et al.The expression of CFL1 and NWASP in esophageal squamous cell carcinoma and its correlation with clinicopathological features[J].Dis Esophagus,2010.
[13]Wikman H,Kettunen E,Seppanen JK,et al.Identification of differ-entially expressed genes in pulmonary adenocarcinoma by using cDNA array[J].Oncogene,2002,21(37):5804.
[14]Hyde Carolyn,Hollier Brett,Anderson Alex,et al.Insulin-like growth factors(IGF)and IGF-binding proteins bound to vitron-ectin enhance keratinocyte protein synthesis and migration[J].J Invest Dermatol,2004,122(5):1198.
[15]Kenny Hilary A,Kaur Swayamjot,Coussens Lisa M,et al.The initial steps of ovarian cancer cell metastasis are mediated by MMP-2 cleavage of vitronectin and fibronectin.J Clin Invest.,2008,118(4):1367.
[16]Karelia T,Goldberg G,Eisen A.Matrix metallo-proteinases in blood vessal development in human fetal skin and cutaneous tumors[J].Invest Dermatol,1995,105(2):411.
[17]Hata K,Fujiwaki R,Maede Y,et al.Expression of thymidine phosphorylase in epithelial ovarian cancer:correlation with an-giogenesis,apoptosis,and ultrasound-derived peak systolic velocity·Gynecol Oncol,2000,77(1):26.
[18]Den Boer ML,Pieters R,Kazemier KM,etal.Different expression of glutathione S-transferase alpha,mu and pi in childhood acute lymphoblastic and myeloid leukaemia[J].Br J Haemato,l 1999,104(2):321.
[19]Moskaluk CA,Duray PH.Immunohistochemical expression of pi-class glutathione S-transferase is down-regulated in adenocarcino-ma of the prostate[J].Cancer,1997,79(8):1595.
[20]Mayr D,Pannekamp U.Immunohistochemical analysis of drug resistanceassociated proteins in ovarian carcinomas[J].Pathol Res、Prac,2000,196(7):469.
[21]PlebaniM,Herszenyi L,Cardin R,et al.Cysteine and serine proteases in gastric cancer[J].Cancer,1995,76(3):367.
[22]Chinni SR,Falchetto R,GercelTC,et al.Humoral immune responsesto cathepsin D and glucose-regulated protein 78 in ovarian cancer patients[J].Clin Cancer Res,1997,3(9):1557.
[23]Bi J,Guo AL,Lai YR,et al.Overexpression of clusterin correlates with tumor progression,metastasis ingastric cancer:a study on tissue microarrays.Neoplasma,2010,57(3):191.
[24]Hough CD,Sherman-Baust CA,Pizer ES,et al.Large-scale se-rial analysis of gene expression reveals genes differentially ex-pressed in ovarian cancer[J].Cancer Res,2000,60(22):6281.
[25]杨国奋,李晓明,谢 丹.卵巢癌组织中clusterin蛋白表达和细胞凋亡检测[J].中国肿瘤临床,2007,34(12).
[26]Storck Sebastien,Shukla Manu,Dimitrov Stefan,etal.Functions of the histone chaperone nucleolin in diseases[J].Subcell Biochem,2007,41:125.
[27]Lee EJ,Kim SH,Kwark YE,et al.Heterogeneous nuclear ribonu-clear protein C is increased in the celecoxib-induced growth inhi-bition of human oral squamous cell carcinoma[J].Exp Mol Med,2006,38(3):203.
[28]Yamada T,Nakamura R,Kido K,et al.Function of hsp90 in differentiation and apoptosis of human EC cells[J].Trans Soc Pathol Jpn,1995,84:217.
[29]Grisendi S,Mecucci C,Falini B,et al.Nucleophosmin and cancer[J].NatRev Cancer,2006,6(7):493.
[30]TsuiKH,Cheng AJ,Chang PL,et al.Association of nucleo-phosmin/B23 mRNA expressionwith clinicaloutcome in patients with bladder carcinoma[J].Urology,2004,64(4):839.
[31]谢 维.HLA表达与肿瘤的生物治疗[J].中国肿瘤生物治疗杂志,2002,9(1):1.
[32]Fletcher GC,Patel S,Tyson K,et al.hAG-2 and hAG-3,human homologues of genes involved in differentiation,are associated with oestrogen receptor-positive breast tumours and interactwithmetastasi gene C4.4a and dystroglycan[J].Br J Cancer,2003,88:579.
[33]CherML,BiliranHR Jr,Bhagat S,et al.Maspin expression inhibits-osteolysis,tumor growth,and angiogenesis in a model of prostate can-cer bone metastasis[J].Proc Natl Acad Sci USA,2003,100(5):7847.
[34]Woong-Shuck A,Sung-Pil P,Su-Mi B,et al.Identification of hemoglobin alpha and beta subunit,as potential serum biomarkers for the diagnosis and prognosis of ovarian cancer[J].CancerSci,2005,96(3):197.

