豚鼠早期动脉粥样硬化模型的建立、机制研究及与大鼠模型的比较
杨润梅,李金莲,高南南,陈慧敏,蔡大勇,屠宴会
(中国医学科学院药用植物研究所药理毒理研究中心,北京 100193)
通过动物和人类临床研究,动脉粥样硬化被分为早期和晚期阶段。1993年Ross首先提出动脉内皮结构损害和功能紊乱是动脉粥样硬化最早期的特征性病变[1],随后经大量研究得到证实。并发现动脉粥样硬化上述早期病变是可以逆转的,而进展后形成的纤维斑块和粥样斑块病变则很难逆转[2],因此动脉粥样硬化早期病变的诊断以及药物的干预治疗显得尤为关键。
集中在动脉粥样硬化早期阶段的药物的发现和评价需要一种适合的动物模型,10余年来,许多动物模型被用于动脉粥样硬化研究,包括兔、猴、小型猪、转基因动物等,它们共同存在造模周期长、灌胃不方便、来源困难、成本高等问题。
一个理想的研究早期动脉粥样硬化的动物模型应包括建模周期相对较短、性质稳定、重复性好,操作方便,同时应具有与人近似的早期动脉粥样硬化典型的病理改变,豚鼠显示出了许多这些特性。豚鼠是为数不多的,像人类一样以LDL为载体携带血液中大部分胆固醇的模型动物,此外,豚鼠还具有肝脏游离胆固醇较酯化胆固醇浓度高,合成和分解胆固醇比率适当,及许多其它的与人的情况相似的特征[3]。目前国内外对豚鼠早期动脉粥样硬化模型及其形成机制的研究未见报道,因此本研究主要应用高胆固醇饲料诱导方法,建立豚鼠早期动脉粥样硬化模型,并对模型形成机制及其生物学特征进行深入研究和探讨,同时与大鼠模型进行比较,为豚鼠模型在抗动脉硬化药物研究中的应用及其优势提供科学依据。
1 材料与方法
1.1动物Hartley豚鼠,♂,体质量200~250 g,7~8周龄,来源于北京科宇动物养殖中心,生产许可证:SCXK(京)2008-0003。Wistar大鼠,♂,体质量 200~220 g,7~8周龄,来源于北京维通利华实验动物技术有限公司,生产许可证:SCXK(京)2007-0001。
1.2试剂血清TC(批号080411)、LDL-C(批号080151)测定试剂盒为中生北控生物科技股份有限公司产品。豚鼠CETP(批号301330221202)、大鼠 CETP(批号301330221111)、豚鼠 LP(a)(批号 301330012331)、大鼠 LP(a)(批号301330012001)、豚鼠 ox-LDL(批号 3013221031111)、大鼠ox-LDL(批号3013031031233)酶联免疫试剂盒均为美国ADL公司进口产品。兔抗大鼠PCNA抗体(批号091028)、CD36抗体(批号091010)、VCAM-1抗体(批号091022)、二抗试剂盒(批号SP-0023)、DAB显色液(批号C-0010),均购自北京博奥森生物技术有限公司。兔抗豚鼠PCNA抗体为Minipoer产品;兔抗豚鼠CD36、VCAM-1抗体均为UCL公司进口分装产品。
1.3仪器日立7060型全自动生化分析仪;Fluko F6/10型组织匀浆机;DM-V型自动组织包埋机;Leica RM2016型石蜡切片机;Leica DM4000B生物显微镜;Bio-RAD MQX200微孔板扫描酶标仪。
1.4实验方法将豚鼠和大鼠随机分成对照和模型组,分别定量饲喂常规颗粒饲料和高脂饲料(质量构成比为胆固醇0.01、猪油0.10,常规饲料0.89)。于实验第6周处理动物,乌拉坦麻醉后股动脉取血,离心分离血清酶法检测TC、LDL-C水平,ELISA测定CETP、LP(a)和ox-LDL含量。剖取肝左大叶,酶分析法测定肝脏ACAT活性(以油酰辅酶A和胆固醇为底物进行酶促反应,产物用DTNB显色定量用于计算ACAT活性)。分离主动脉,固定于体积分数为0.10的甲醛溶液中,乙醇梯度脱水,取主动脉弓部,石蜡包埋,4 μm切片,H&E染色。低倍镜下(×200),取完整主动脉弓部的横断面。LAS采图,用Image pro plus 6.0分别测量外弹力板以内面积(S1)及管腔面积(S2),按R=(S1-S2)/S1计算内膜-中膜面积构成比,以此换算出内膜-中膜厚度变化。高倍镜下(×400)每个切片随机选取5个视野,计数内皮细胞及内弹力板以外范围的炎性细胞核总数,主要是浸润与局部增生的单核细胞和巨噬细胞,并观察脂斑形成情况(表现为内含大量脂质的泡沫细胞聚集和堆积)。
应用免疫组织化学方法测定主动脉壁PCNA、CD36及VCAM-1蛋白表达。高倍镜(×400)下每个标本随机选取9~10个视野,使用专业采图软件LAS采集图片,分析软件Image pro plus 6.0分别测定动脉壁PCNA、CD36和VCAM-1阳性表达的平均光密度值(OD)、阳性染色面积(AP)以及观察视野区面积(AT),以单位体积内膜细胞阳性表达平均光密度值变化表示动脉壁PCNA、CD36和VCAM-1蛋白表达的变化(通过公式MOD=[OD×(AP/AT)3/2]计算)。
1.5统计学分析实验数据均以±s表示,采用SPSS 10.0软件进行非独立样本t检验。
2 实验结果
2.1血清TC、LDL-C、CETP、LP(a)、ox-LDL浓度及肝脏ACAT活性变化高脂饲料诱导6周后,豚鼠血清TC、LDLC水平明显升高,比对照组分别升高11.13倍和7.82倍;大鼠模型组血清TC和LDL-C较对照组分别升高2.00倍和3.16倍,明显低于同期豚鼠模型组。此外,豚鼠血清CETP、LP(a)水平,ox-LDL表达,肝脏ACAT活性均较对照组明显增强(P<0.05,P<0.01),而相同高脂饲料诱导下大鼠上述指标均未出现明显变化,见Tab 1、2。2.2主动脉形态学变化豚鼠与大鼠正常对照组动脉内膜完整光滑无损伤,中膜平滑肌细胞排列整齐,厚薄均匀,少见单核细胞、巨噬细胞黏附和浸润。高脂饲料诱导6周后豚鼠模型组动脉内皮细胞水肿、脱落,中膜平滑肌细胞排列紊乱,部分平滑肌细胞水肿和增殖,内膜-中膜厚度与对照组比较明显增加。沿内皮细胞表面黏附较多单核细胞;内膜出现大量单核细胞、巨噬细胞和泡沫细胞聚集。此外有比例为0.40的动物动脉内膜出现脂纹脂斑,表现为大量泡沫细胞聚集成堆,周边可找到单核巨噬细胞,但病灶内未出现变性的胶原纤维帽,该病变属于动脉粥样硬化的脂纹脂斑期。而大鼠模型组动脉内膜较完整平坦,内皮黏附及浸润于内膜的单核细胞和巨噬细胞少于豚鼠模型组,且无一例出现脂质斑块,见 Fig 1、2。
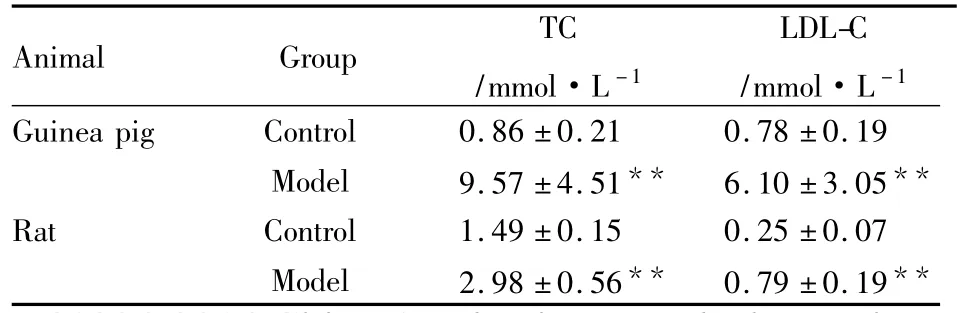
Tab 1 Changes of serum TC,LDL-C concentration in guinea pigs and rats fed with high lipid diets for 6 weeks(¯x ± s,n=10)
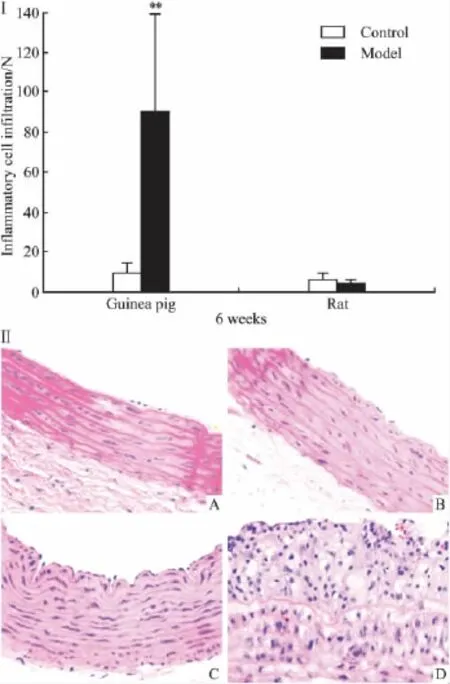
Fig 1 ⅠInflammatory cell infiltration in animals fed with control and high lipid diets for 6 weeks(±s,n=10)**P<0.01 vs control.ⅡRepresentative photomicrograph of HE staining in different groups(HC×400)A:Rat control group;B:Rat model group;C:Guinea pigs control group;D:Guinea pigs model group(As shown,aortic intima-media area significantly thickened,inflamatory cells aggregated and fatty streak developed)
2.3主动脉PCNA、CD36及VCAM-1蛋白表达变化高胆固醇饲料诱导6周后,豚鼠模型组主动脉内膜PCNA(阳性细胞的细胞核染成黄褐色)、CD36和VCAM-1(阳性细胞的细胞膜和细胞质染成黄褐色)表达较正常对照组明显增多(P<0.05);而相同诱导周期的大鼠模型组动脉内膜PCNA、CD36及VCAM-1表达均未发生明显改变,见Fig 3。
Tab 2 Changes of serum CETP,LP(a),ox-LDL concentration and hepatic ACAT activities in guinea pigs and rats fed high lipid diets for 6 weeks(±s,n=10)
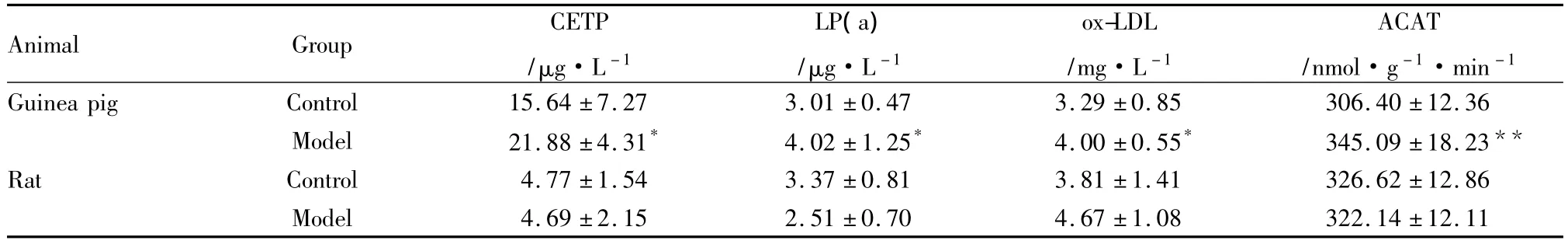
Tab 2 Changes of serum CETP,LP(a),ox-LDL concentration and hepatic ACAT activities in guinea pigs and rats fed high lipid diets for 6 weeks(±s,n=10)
*P <0.05,**P <0.01 vs control
Animal Group CETP/μg·L-1 LP(a)/μg·L-1 ox-LDL/mg·L-1 ACAT/nmol·g-1·min -1 Guinea pig Control 15.64±7.27 3.01±0.47 3.29±0.85 306.40±12.36 Model 21.88±4.31* 4.02±1.25* 4.00±0.55* 345.09±18.23**Rat Control 4.77±1.54 3.37±0.81 3.81±1.41 326.62±12.86 Model 4.69±2.15 2.51±0.70 4.67±1.08 322.14±12.11
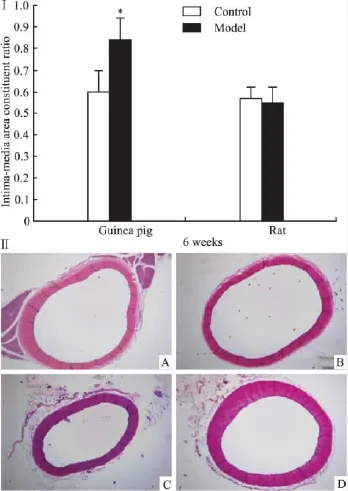
Fig 2ⅠChanges of aortic intima-media area constituent ratio in animals fed on high lipid diets for six weeks(±s,n=10)*P<0.05 vs control group.ⅡRepresentative photomicrograph of aorta from guinea pigs and rats in different groups (H﹠ E×50),the scale bar represents 25 μm. A:Rats control group;B:Rats model group;C:Guinea pigs control group;D:Guinea pigs model group(As shown,aortic intima-media area significantly thickened)
3 讨论
本实验发现豚鼠经高脂饲料诱导6周后主动脉壁已具有早期动脉粥样硬化典型病理特征,而相同高脂饲料及相同诱导周期的大鼠,动脉未出现类似病理改变。说明豚鼠在高脂饲料诱导下比大鼠易于形成动脉粥样硬化病变。
动脉粥样硬化发病机制十分复杂,其中胆固醇酯化过程是动脉粥样硬化产生的初始环节。ACAT是细胞内唯一的催化游离胆固醇形成胆固醇酯(Cholesterolester,CE)的酶。在肝脏和小肠细胞中,ACAT还参与脂蛋白装配[4],对VLDL及apoB100分泌起促进作用,可直接影响血液中胆固醇水平。在单核细胞分化成巨噬细胞后,ACAT1大量表达,导致细胞内胆固醇酯的过量堆积被巨噬细胞吞噬形成泡沫细胞。因此ACAT是近年来研究降胆固醇和抗动脉粥样硬化药物的一个新的靶酶[5]。研究结果显示,豚鼠模型组肝脏ACAT活性较正常组明显升高,其胆固醇酯化能力及脂蛋白生成能力增强,因此表现出血清TC和LDL-C水平明显上升,且升高幅度远高于大鼠,在短期内形成了早期动脉粥样硬化病变,而大鼠模型组肝脏ACAT活性未见明显变化,因此其高脂血症及动脉粥样硬化症状不如豚鼠模型明显。

Fig 3 Changes of PCNA,VCAM-1 and CD36 expression in guinea pigs and rats for 6 weeks
CETP是一种疏水性糖蛋白[6],可介导脂蛋白之间脂质的交换,使 CE从 HDL向 VLDL、LDL转运。CETP活性增加,CE转运速率加快,更多富含CE的LDL和VLDL残粒积聚于血浆,当透过动脉壁时,过多的LDL积聚于动脉壁细胞内,导致CE沉积,促进动脉粥样硬化形成[7]。本实验结果表明,豚鼠正常组血清CETP表达水平明显高于大鼠,与文献报道一致[8],即与人的CETP表达活性相近。经高胆固醇饲料诱导后,其血清CETP表达明显高于对照组,而大鼠无明显变化。此结果表明高脂饲料诱导活跃了豚鼠体内脂质交换,导致豚鼠血清出现大量富含CE的LDL和VLDL,这类脂蛋白极易被氧化修饰,并被巨噬细胞吞噬形成泡沫细胞,进而在动脉内膜聚集形成脂纹脂斑,这是豚鼠脂代谢紊乱及动脉粥样硬化病变的主要机制及生物学特征。
LP(a)是一种存在于血清中的特殊脂蛋白,其中Apo(a)是LP(a)的特征性糖蛋白成分,并通过二硫键与中心脂质上ApoB100相连接。研究发现,LP(a)水平升高可促进其所携带CE被血管壁细胞摄取利用,进而被单核细胞和巨噬细胞摄取,最终促进泡沫细胞形成,因此被认为是动脉粥样硬化的一个独立危险因子[9]。实验结果提示,豚鼠脂纹脂斑的形成可能与高胆固醇饲料引起的血清LP(a)升高存在极其密切的关系。因此,两种动物之间血清LP(a)变化出现的差异性,可能是豚鼠较大鼠更易于形成早期动脉粥样硬化病变的另一个重要机制。
高脂血症时血浆中急剧升高的LDL易被氧化修饰形成ox-LDL,后者不能被肝脏LDL受体摄取进行代谢。ox-LDL可直接作用于内皮细胞引起动脉内皮结构损伤和功能紊乱,另一方面通过内皮细胞膜受体介导而被巨噬细胞吞噬发展形成泡沫细胞,从而引发动脉内膜脂纹脂斑形成[10]。
CD36是B类清道夫受体家族的成员,是巨噬细胞表面识别、吞噬ox-LDL的主要受体,CD36还可介导单核细胞与内皮细胞的黏附,促进单核细胞向内皮细胞迁移和聚集,在那里分化形成巨噬细胞,不断吞噬ox-LDL的巨噬细胞形成泡沫细胞,造成脂质在血管壁堆积,因此,CD36受体是巨噬细胞摄取ox-LDL形成泡沫细胞的关键[11]。
本研究结果发现,高胆固醇饲料诱导豚鼠6周时即可显著升高血清ox-LDL水平,同时主动脉内皮CD36蛋白表达较正常对照组明显增强,导致巨噬细胞大量吞噬ox-LDL,进而形成泡沫细胞堆积在动脉内皮表面。而大鼠模型组ox-LDL升高不如豚鼠模型明显,动脉壁CD36蛋白表达未见明显变化,因此未观察到动脉内皮泡沫细胞聚集形成的脂纹脂斑。
近期已有相关研究证实[12],发生动脉粥样硬化病变时不仅存在脂代谢紊乱,同时也存在慢性炎症反应过程[13],VCAM-1主要在内皮细胞上表达,可选择性促进单核细胞、淋巴细胞与内皮黏附[14],是单核细胞向动脉壁迁移过程中起关键作用的黏附分子。
本次实验发现,高脂饲料诱导后的豚鼠模型组动脉壁内皮细胞脱落,平滑肌细胞排列紊乱,内皮细胞黏附较多的单核细胞,内膜也有大量单核细胞、巨噬细胞浸润与聚集,与正常对照组相比,差异存在显著性。同时免疫组化研究结果还发现,VCAM-1在动脉壁病灶中大量表达,以上结果提示豚鼠早期动脉粥样硬化病变存在炎症反应过程,相比之下,大鼠模型组动脉内皮少见单核细胞黏附,内膜单核细胞、巨噬细胞浸润较少,同时主动脉壁VCAM-1蛋白表达增强不明显,表明其炎症反应不如豚鼠强烈,因此内皮细胞损伤后过度释放VCAM-1可能是动脉粥样硬化发生机制之一,也是大鼠不如豚鼠易于形成早期动脉粥样硬化的重要原因之一。
PCNA是一种细胞核内酸性蛋白质,在细胞分裂时协调DNA引导链和后随链的合成,对细胞分裂及增殖起重要作用。检测血管壁PCNA的表达,能较好地反应血管细胞的增殖活性[15]。
本次实验发现,豚鼠模型组动脉壁PCNA阳性表达较正常组明显升高,表明经高脂饲料诱导后,豚鼠血管细胞的增殖活性明显增强,中膜平滑肌细胞增生明显,并发生向内膜的迁移,最终导致内膜-中膜增厚。大鼠模型组动脉PCNA表达及内膜-中膜厚度未发生明显的改变。因此,PCNA表达的增强可能与豚鼠模型组内膜-中膜增厚的病理机制有密切关系。
以上研究表明,豚鼠摄入高胆固醇饲料6周后可形成早期动脉粥样硬化损伤,其病理机制主要反应在促发动脉粥样硬化形成过程中发挥重要作用的酶、蛋白、受体、黏附分子等发生了明显改变,是豚鼠易形成早期动脉粥样硬化的主要机制,也是相同诱导条件下大鼠不易形成动脉粥样硬化的主要原因。因此,豚鼠作为早期动脉粥样硬化动物模型的使用可能具有若干优势,尤其是对发现和评价作用于ACAT、CETP、LP(a)、CD36、VCAM-1等靶点的新类型药物,豚鼠可能是一种较为理想的动物模型。
[1]Ross R.The pathogenesis of atherosclerosis:A perspective for the 1990s[J].Nature,1993,362(6423):801-9.
[2]Lusis A J.Atherosclerosis[J].Nature,2000,407(6801):233-41.
[3]Fernandez M L,Volek J S.Guinea pigs:a suitable animal model to study lipoprotein metabolism,atherosclerosis and inflammation[J].Nutr Metab(Lond),2006,3:17-22.
[4]Chang T Y,Chang C C,Lu X,Lin S.Catalysis of ACAT may be completed within the plane of the membrane:a working hypothesis[J].J Lipid Res,2002,42(12):1933-8.
[5]Bruckert E.New advancecs in lipid-modifying therapies for reducing cardiovascular risk[J].Cardiology,2002,97(2):59-66.
[6]骆庆峰,孙 兰,杜冠华.胆固醇逆向转运过程中新靶点及其药物的研究进展[J].中国药理学通报,2006,22(8):904-7.
[6]Luo Q F,Sun L,Du G H.Progress in new drugs targeting reverse cholesterol transport[J].Chin Pharmacol Bull,2006,22(8):904-7.
[7]van der Hoogt C C,de Haan W,Westerterp M,et al.Fenofibrate increases HDL-cholesterol by reducing cholesteryl ester transfer protein expression[J].J Lipid Res,2007,48(8):1763-71.
[8]Ha Y C,Barter P J.Differences in plasma cholesteryl ester transfer protein activity in sixteen vertebrate species[J].Comp Biochem Physiol B,1982,71(2):265-9.
[9]He J,Gu D,Reynolds K,et al.Serum total and lipoprotein cholesterol levels and awareness,treatment,and control of hypercholesterolemia in China[J].Circulation,2004,110(4):405-11.
[10]Verhoye E,Langlois M R;Asklepios Investigators.Circulating oxidized low-density lipoprotein:a biomarker of atherosclerosis and cardiovascular risk?[J].Clin Chem Lab Med,2009,47(2):128-37.
[11]Rahaman S O,Lennon D J,Febbraio M,et al.A CD36-dependent signaling cascade is necessary for macrophage foam cell formation[J].Cell Metab,2006,4(3):211-21.
[12]Shen C X,Chen H Z,Ge J B.The role of inflammatory stress in acute coronary syndrome[J].Chin Med J(Engl),2004,117(1):133-9.
[13]李 磊,戴 敏.动脉粥样硬化血管内皮分泌功能失调与平滑肌细胞增殖[J].中国药理学通报,2010,26(2):155-8.
[13]Li L,Dai M.The cause of atherosclerosis:secretory dysfunction in vascular endothelial cells and proliferation of smooth muscle cells[J].Chin Pharmacol Bull,2010,26(2):155-8.
[14]Cybulsky M I,Iiyama K,Li H,et al.A major role for VCAM-1,but not ICAM-1,in early atherosclerosis[J].J Clin Invest,2001,107(10):1255-62.
[15]黄志东,周 勇,顾承志,等.氟伐他汀对兔颈动脉粥样斑块CD68和 PCNA的影响[J].中国微循环,2008,12(1):23-5.
[15]Huang Z D,Zhou Y,Gu C Z,et al.The effects of fluvastatin on CD68 and PCNA of carotid atherosclerotic plaques in rabbits[J].J Chin Microcircul,2008,12(1):23-5.

