细菌一种“新的分泌机制”初探
李泽鸿,彭其胜
(1.吉林农业大学生命科学学院,长春 130118;2.吉林大学畜牧兽医学院,长春 130062)
革兰氏阴性细菌中已发现四种蛋白质分泌途径,称为 I、II、III、IV 型分泌机制[1]。II和 IV 型是Sec系统依赖途径(Sec基因编码一些分泌途径必需的Sec蛋白质,这些分泌途径被称为Sec依赖的分泌途径)。蛋白质被这两种分泌途径运输经过细胞膜前,有一个独立的跨过内膜的步骤。II型和IV型分泌蛋白质的共同之处在于外排到周质时蛋白的氨基端上存在一个疏水信号序列。信号序列帮助蛋白质分泌,当分泌蛋白到达周质时会被信号肽酶剪切掉[2]。I型是 Sec非依赖途径。与II型和IV型分泌途径相比较,I型和III型分泌不依赖于Sec系统,所以不需要分泌蛋白的氨基端加工。I型和III型途径的蛋白质分泌是一个连续的过程,不存在明显的周质中间体[3-4]。
重组蛋白在大肠杆菌胞周质中分泌表达应属于II型分泌机制[2],在重组蛋白的氨基端通常融合一段信号肽基因,当翻译完成后,这条信号肽就会被大肠杆菌胞质中的信号肽酶切除,这是一条传统的分子生物学基本原理。但是,本文在构建一种重组毒素DAB389(Gly4Ser)2-αMSH时,发现另一种原核胞周质分泌表达机制:在该重组蛋白的前面没有信号肽基因,却能在胞周质中分泌表达。为此将这种现象提出并做初步探讨。
1 材料与方法
1.1 材料
1.1.1 菌株、质粒和细胞 质粒 pET28a(+)、pET20b(+)、Rosettablue(DE3)、BL21(DE3)pLysS购置于Novagen公司;pMD18T载体试剂盒购于大连宝生物公司;pET28a/DAB389(Gly4Ser)2-EGF质粒由军事医学科学院军事兽医研究所张国利博士惠赠;大肠杆菌JM105由吉林农业大学生命科学学院实验室保存。
1.1.2 工具酶及试剂 限制性内切酶、T4 DNA连接酶、Taq DNA聚合酶、PCR产物回收试剂盒均购自大连TaKaRa公司。诱导剂IPTG购自Merck公司,蛋白质相对分子量标准购自上海生物化学研究所。Cu Chelating Sepharose Fast Flow亲和层析设备及介质购自瑞典Pharmacia Biotech公司。抗白喉毒素阳性血清为本实验室保存,辣根过氧化物酶(HRP)标记鼠抗马IgG为Sigma产品;PCR引物、寡核苷核片段的合成及DNA测序由大连TaKaRa公司承担。
1.1.3 PCR引物及寡核苷酸片段的设计 DAB389(Gly4Ser)2-αMSH上、下游引物分别为:

1.2 方法
1.2.1 DAB389(Gly4Ser)2- αMSH 基因片段的PCR扩增 94℃预变性4 min,扩增参数:94℃ 40 s,50℃ 50 s,72℃ 60 s,7 个循环,94℃ 40 s,60℃ 50 s,72℃ 60 s,30 个循环;72℃延伸 10 min。
1.2.2 表达载体的构建与鉴定 PCR产物纯化后,置于 pMD18T载体,构建 pMD18T-DAB389(Gly4Ser)2-αMSH质粒,对质粒进行 Nco I和EcoR I双酶切,得目的基因 DAB389(Gly4Ser)2-αMSH,与经同样双酶切的pET28a(+)载体连接,得到融合蛋白表达载体 pET28a-DAB389(Gly4Ser)2-αMSH,筛选阳性克隆后测序鉴定,对pET28a-DAB389(Gly4Ser)2-αMSH 进行 Nco I和EcoR I双酶切,与经同样双酶切的载体 pET20b(+)连接,得融合蛋白表达载体pET20b-DAB389(Gly4Ser)2-αMSH,筛选阳性克隆后测序鉴定。
1.2.3 表达蛋白及 SDS-PAGE分析 分别将pET28a-DAB389(Gly4Ser)2-αMSH、pET20b-DAB389(Gly4Ser)2-αMSH转化Rosettablue(DE3),用终浓度为1 mmol/L IPTG,37℃,3 h诱导表达。收集表达宿主菌,用10倍体积的蔗糖溶液(20%蔗糖,20 mmol/L Tris- Cl,2 mmol/L EDTA)悬浮菌体,4℃放置10 min,离心收集菌体,用4℃ 重蒸水悬浮菌体,4℃放置10 min,离心,取上清液SDSPAGE分析蛋白表达形式,然后收集表达宿主菌的原生质体,超声波裂解后SDS-PAGE分析蛋白表达形式。
1.2.5 Cu Chelating Sepharose Fast Flow 亲和层析纯化目的蛋白 色谱柱填装完成后,用起始缓冲液A平衡层析柱10~15个柱床,上样,用起始缓冲液A洗脱流穿峰至基线平稳,以A(20 mmol/L Tris-Cl,0.5 mol/L NaCl,pH 7.5)→B(20 mmol/L Tris -Cl,0.5 mol/L NaCl,50 mmol/L 咪唑液,pH 7.5)进行梯度洗脱,洗脱流速为3 mL/min,时间90 min。收集各组分峰成分进行SDS-PAGE分析。
1.2.6 DAB389(Gly4Ser)2- αMSH 中的信号肽分析 将DAB389(Gly4Ser)2-αMSH一级结构输入Technical University of Denmark 的 SignalP 3.0 Server,进行信号肽序列分析。
2 结果
2.1 目的基因DAB389(Gly4Ser)2-αMSH片段的PCR扩增 PCR扩增结果显示:DAB389(Gly4Ser)2-αMSH基因片段为1278 bp,与预期的大小相符(图1)。
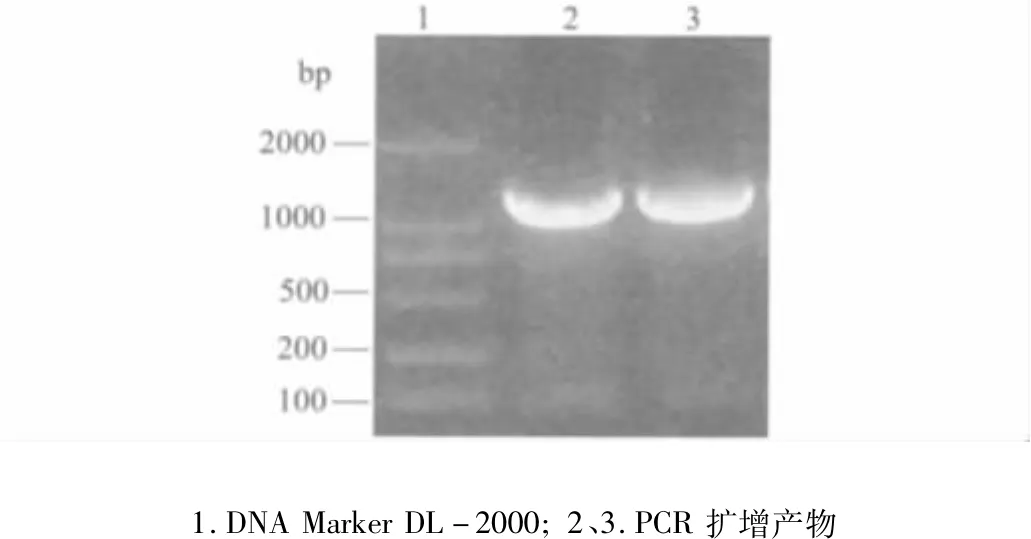
图1 DAB389(Gly4Ser)2-αMSH基因的扩增结果
2.2 免疫毒素 DAB389(Gly4Ser)2-αMSH的两种表达载体构建及鉴定 pET28a(+)和pET20b(+)同为Novagen的pET表达载体系列,后者带有pelB leader信号肽,将PCR扩增产物插入载体pET28a(+)后,得 pET28a-DAB389(Gly4Ser)2-αMSH,经Nco I和EcoR I双酶切后,插入相同酶切的pET20b(+)即可得到 pET20b-DAB389(Gly4Ser)2-αMSH表达载体。DNA测序证实两种表达载体插入的目的基因无碱基突变和读码框转移。
2.3 免疫毒素 DAB389(Gly4Ser)2-αMSH的表达与分析 两种表达载体pET28a-DAB389(Gly4Ser)2-αMSH和pET20b-DAB389(Gly4Ser)2-αMSH分别转化Rosetta(DE3)后,经诱导表达后,其中pET28a-DAB389(Gly4Ser)2-αMSH表达产物进行SDS-PAGE分析(图2),在Mr 46 000有一条明显的条带,与预期值相符;表达宿主菌经过糖-水渗透溶胀后,取其上清进行SDS-PAGE。结果表明,免疫毒素DAB389(Gly4Ser)2-αMSH以分泌细菌周质形式表达;pET20b-DT389-MSH表达产物进行SDS-PAGE分析,结果表明,DAB389(Gly4Ser)2-αMSH不能表达。
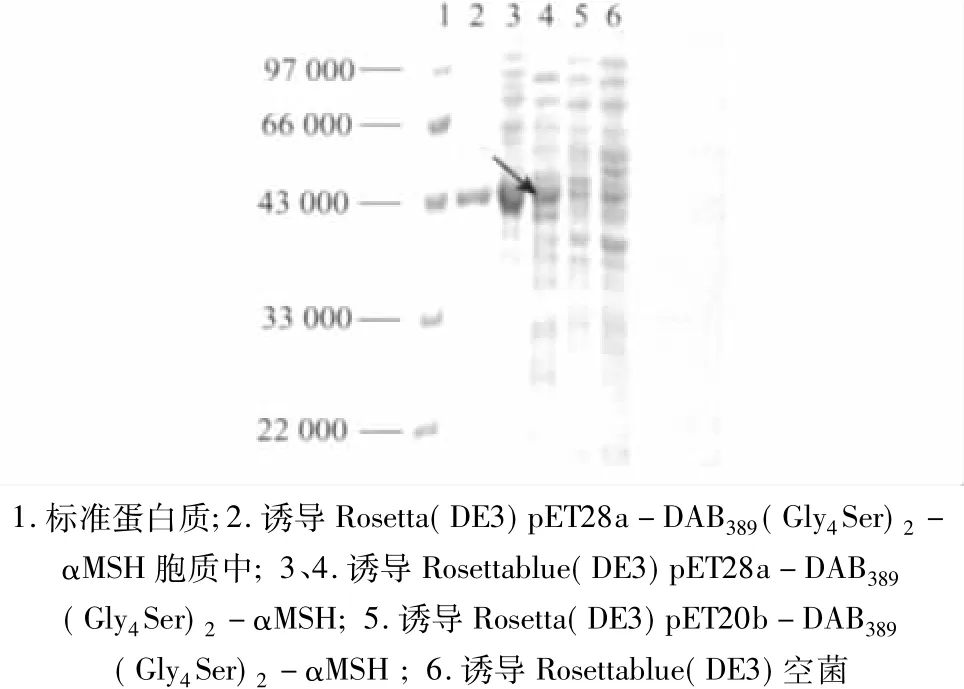
图2 表达产物的SDS-PAGE分析结果
2.4 Western印迹分析 pET28a-DAB389(Gly4Ser)2-αMSH在Rosetta(DE3)中的表达产物经Western印迹分析检测,在对应于DAB389(Gly4Ser)2-αMSH处有明显的蛋白杂交带(图3),说明产物为特异性蛋白。

图3 Western-Blot鉴定结果
2.5 Cu Chelating Sepharose Fast Flow纯化DAB389(Gly4Ser)2-αMSH 表达蛋白经55%硫酸铵盐析后,脱盐,然后经Cu Chelating Sepharose Fast Flow层析纯化,分离的目的蛋白纯度达到90.53%(图4)。
心理学家在研究创新思维的培养问题时指出∶“学生的学习动机和求知欲,不会自然涌现,它取决于教师所创设的教学情况。”所以,教师必须经常地、有意识地为学生精心创设各种情景。
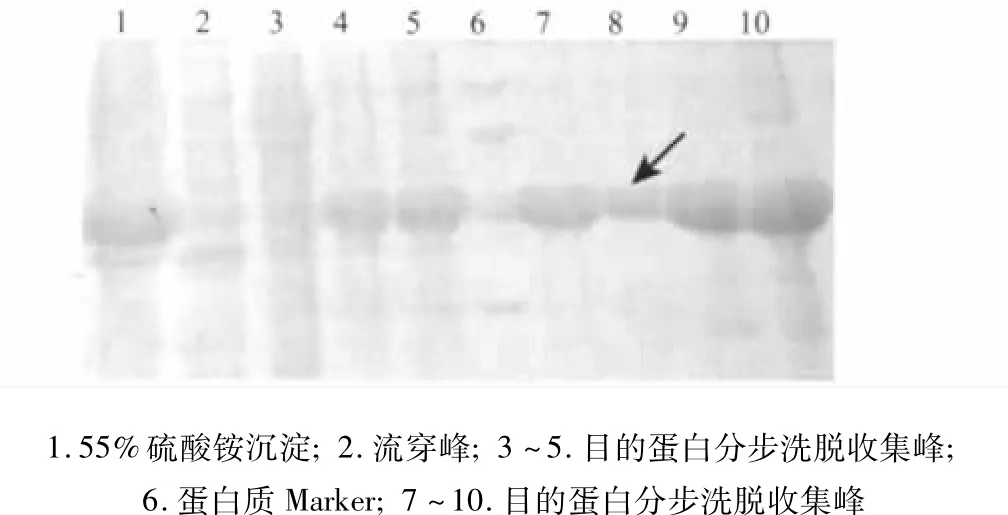
图4 DAB389(Gly4Ser)2-αMSH蛋白经Cu Chelating Sepharose Fast Flow纯化的结果
2.6 DAB389(Gly4Ser)2- αMSH 性质分析 通过SignalP 3.0 Server(Technical University of Denmark)分析DAB389(Gly4Ser)2-αMSH中的信号肽存在情况(图5、表1),重组蛋白氨基端前70个氨基酸中不存在信号肽。
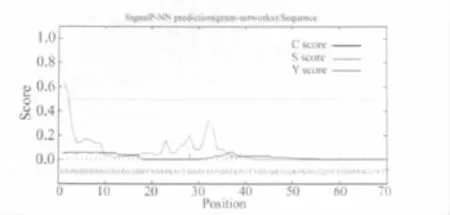
图5 DAB389(Gly4Ser)2-αMSH中信号肽的预测分析结果
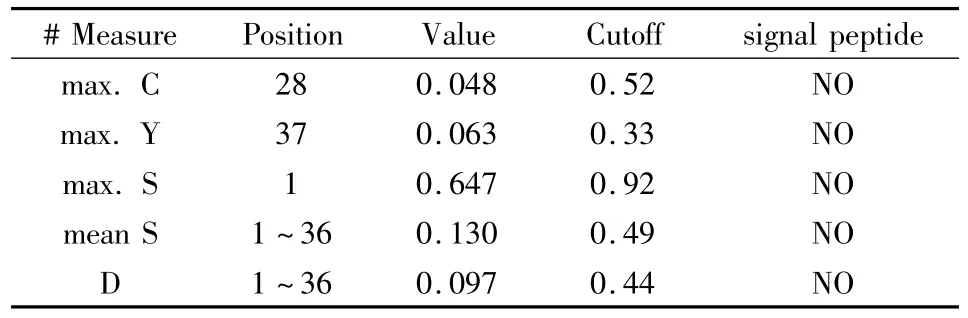
表1 DAB389(Gly4Ser)2-αMSH中信号肽的预测结果Sequence length=70
通过另一种信号肽软件SignalP-HMM分析,结果也同样显示在DAB389(Gly4Ser)2-αMSH的氨基端不存在信号肽。
3 讨论
在本实验中,Rosetta(DE3)表达宿主菌经过糖-水渗透溶胀后,得原生质体[5]。SDS-PAGE分析其周质成分时,发现 DAB389(Gly4Ser)2-αMSH分泌在细菌的周质腔内,Western分析其表达蛋白也具有特异性,确系本文构建的重组蛋白。由于用于表达的质粒是pET28a,该质粒是一种胞内表达质粒,表达基因插入在质粒的Nco I和EcoR I之间,在起始密码子(ATG)处根本不存在信号肽序列,而且通过Signal neural networks软件(NN)分析重组蛋白的特性,发现 DAB389(Gly4Ser)2-αMSH的氨基端也不存在信号肽序列。将这种现象与革兰氏阴性细菌中已发现的四种蛋白质分泌表达机制相比较,发现DAB389(Gly4Ser)2-αMSH分泌表达虽然与II、IV型分泌机制类似[4],都是将蛋白分泌到细菌的周质腔中,但是由于 DAB389(Gly4Ser)2-αMSH的氨基端不含有信号肽,因此这种分泌机制不应属于II、IV型;I型和III型途径的蛋白质分泌是一个连续的过程,不存在明显的周质中间体,不依赖于Sec系统,因此这种分泌机制也不应属于 I、III型[2-3],因此本文推测在革兰氏阴性细菌中可能还存在另一种蛋白质分泌机制。
白喉棒状杆菌毒素(Diphtheria toxin,DT)系白喉杆菌分泌胞外的蛋白质,由β-棒状杆菌噬菌体所携带的tox基因整合于染色体而编码的。基因全长为2 200 bp,其中301~375 bp为信号肽基因,376~1980 bp编码白喉毒素,从其基因特点和编码蛋白质性质来看,它属于I型分泌系统,蛋白完成转膜后,信号肽酶会将其自动切除[6]。本文构建的免疫毒素DAB389(Gly4Ser)2-αMSH中的毒素部分DAB389为DT中除去受体结合区后所剩的成熟肽部分,不含信号肽。本实验表明,在免疫毒素前面置入功能较强的信号肽pelB后,在大肠杆菌中反而不表达 DAB389(Gly4Ser)2-αMSH,对这种现象学者们早有解释:并不是在重组蛋白前加入信号肽就能导致其分泌表达,它只是一个必要条件,要分泌表达还与其他因素有关。例如,氨基端前20~30个氨基酸的疏水性、正电荷的分布及宿主菌的性质等影响蛋白的分泌表达[7-8]。但对于 DAB389(Gly4Ser)2-αMSH在胞内表达质粒中分泌表达这种现象至今尚无人涉及,作者认为:可能在DAB389(Gly4Ser)2-αMSH的氨基端含有类似信号肽功能的序列,在蛋白表达中起信号肽的作用,引导蛋白进入细菌周质腔内;而且,这条类似信号肽的序列在转膜完成后不被切除,因为从目前铜离子亲和层析纯化结果来看,DAB389(Gly4Ser)2-αMSH前引入的His·Tag序列并未被切除,如果被切除,纯化的效果不会如此明显。
总之,无论上述解释和推测正确与否,但是本实验发现的这种现象很有意义,以期引起学者们的思考。
参教文献:
[1]王 健,赵立平.细菌Ⅲ型分泌系统[J].生命的化学,2001,21(2):147-149.
[2]Kakizawa S,Oshima K,Nishigawa H,et al.Secretion of Immunodominant Membrane Protein from Onion Yellows Phytoplasma through the Sec Protein-translocation System in Escherichia coli[J].Microbiology,2004,150:135 -142.
[3]Holland I B,Schmitt L,Young J.Type 1 Protein Secretion in Bacteria,the ABC -transporter Dependent Pathway(Review)[J].Mol Membr Biol,2005,22(1/2):29 -39.
[4]Stuber K,Frey J,Burnens A P,et al.Detection of Type III Secretion Genes as a General Indicator of Bacterial Virulence[J].Mol Cell Probes,2003,17(1):25 -32.
[5]Lavely W C,Scarfone C,Cevikalp H,et al.Phantom Validation of Coregistration of pET and CT for Image-guided Radiotherapy[J].Med Phys,2004,31(5):1083 -1092.
[6]Kaczorek M,Delpeyroux F,Chenciner N,et al.Nucleotide Sequence and Expression of the Diphtheria Toxin 228 Gene in Escherichia coli[J].Science,1983,221(4613):855 -858.
[7]Engelman D M,Steitz T A.The Spontaneous Insertion of Protein into and across Membranes:the Helical Hairpin Hydrothesis[J].Cell,1981,23(2):411 -422.
[8]Davis N G,Model P.An Artificial Anchor Domain:Hydrophobicity Suffices to Stop Transfer[J].Cell,1985,41:607 -614.

