Caspase-3在骨髓间充质干细胞回输脑缺血再灌注模型大鼠脑组织中的表达
李梅笑 李 卓 邹立华 吴 军 (深圳市龙岗区人民医院,广东 深圳 58000)
脑出血可造成中枢神经系统损伤,损伤后的神经再生及功能恢复备受关注。骨髓间充质干细胞(marrow mesenchymal stem cells,MSCs)以多向分化、分泌营养因子、免疫原性弱并可透过血脑屏障在病灶定居等优点,成为治疗脑血管疾病的有效方法〔1~3〕。
1 材料与方法
1.1 动物 Wistar大鼠60只,清洁级,体重(270±20)g;Wistar大鼠乳鼠5只,清洁级,体重(10±2)g,由吉林大学实验动物中心提供。将大鼠随机分为正常对照组、模型组及MSCs治疗组,每组20只。
1.2 试剂与仪器 DMEM培养基(GIBCO公司),胎牛血清(Hyclone公司),RNA提取试剂盒、RT-PCR试剂盒(TAKARA公司)、倒置显微镜(Olympus公司)、PCR仪(eppendorf公司)、凝胶成像系统(伯乐公司)
1.3 MSCs的分离、培养 无菌分离Wistar大鼠乳鼠股骨,取出骨髓,制备成单细胞悬液,以1×105/ml接种于培养瓶中,当细胞长至80%进行传代,传至3~6代备用。
1.4 MSCs诱导神经样细胞 选用第3代的MSCs,调细胞浓度为5×105/ml,接种到铺有盖片的6孔板中,12 h后更换培养基 DMEM/F12(含 2%B27,EGF 40 ng/ml,bFGF 20 ng/ml),倒置显微镜观察细胞形态变化和生长状况,每隔2 d半量换液1次,7 d后固定细胞。免疫组织化学染色检测NSE表达。
1.5 大脑中动脉MCAO/再灌注模型的制备 根据Longa等报道方法〔4〕,结合朱继等改良的线栓法建立大鼠右侧MCAO/再灌注模型〔5〕。采用3.5%水合氯醛进行腹腔注射麻醉,固定动物,呈仰卧位,颈部皮肤消毒,经颈部正中切口,分离肌肉和筋膜,暴露右侧的颈总动脉 (CCA)、颈外动脉 (ECA)和颈内动脉 (ICA),动脉夹夹闭ICA和ECA,小剪刀在颈外动脉残端做一切口,将预先准备好的栓线 (表面涂有肝素)从ECA缓慢插入ICA,去除ICA处的动脉夹,用直镊子将栓线缓慢沿ICA的入颅方向推进,在渔线进入约18~20 mm处微感到阻力时,栓线已经通过大脑中动脉的起始部,完成一侧大脑中动脉的阻塞。移除动脉夹,清理术野,全层缝合伤口。栓塞大脑中动脉2 h后打开手术切口,轻轻拔出线栓,待栓头到达分叉处停止,实施再灌注,清理术野,关闭手术切口。
1.6 RT-PCR方法检测caspase-3 mRNA的表达 模型大鼠制备成功后2 h,MSCs治疗组经大鼠尾静脉回输于模型组大鼠,细胞浓度为1×106/ml,回输1 ml,24 h后再回输一次,回输第7天,断头取脑,使用RNA提取试剂盒提取总RNA,根据GenBank上登陆的caspase-3基因序列,以β-actin为内参照,设计、合成引物。β-actin上游引物:5'GTCAGGTCATCACTATCGGCAAT 3',下游引物:5'AGAGGTCTTTACGGATGTCAACGT 3',片段大小为147 bp;caspase-3上游序列:5'CTGGACTGCGGTATTGAG 3',下游序列:5'AATCAAATCCGATGTTCC 3',片段大小为489 bp。进行RT-PCR反应,1%琼脂糖凝胶电泳。
2 结果
2.1 免疫组化检测MSCs诱导神经样细胞NSE表达 MSCs加入诱导液后,倒置显微镜观察6 h后细胞形态无明显变化,24 h后可见部分细胞突起,7 d后细胞变成多角形、锥形,类似神经样细胞形态(见图1),神经细胞球免疫细胞化学染色呈NSE阳性表达;而MSCs未诱导的神经样细胞呈NSE阴性表达。见图2。
2.2 RT-PCR方法检测caspase-3 mRNA的表达 治疗组caspase-3表达明显低于模型组(P<0.05)。治疗组caspase-3表达接近于对照组(P>0.05)。见图3、图4。

图1 显微镜观察MSCs诱导神经样细胞(×100)

图2 MSCs诱导神经样细胞NSE表达(×200)
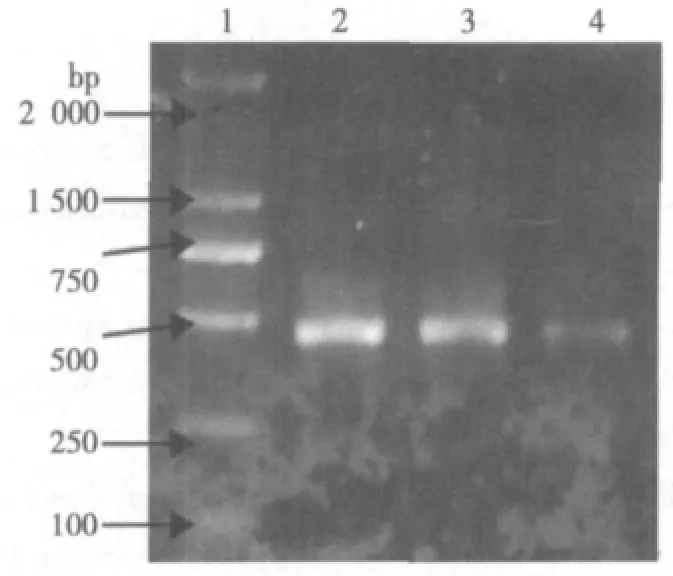
图3 RT-PCR检测caspase-3 mRNA在MSCs回输脑缺血再灌注大鼠中表达

图4 RT-PCR检测β-actin在MSCs回输脑缺血再灌注大鼠中mRNA表达
3 讨论
在缺血脑组织的不同部位可见神经细胞凋亡〔6,7〕。caspase家族在凋亡过程中起重要作用,凋亡的最后过程是通过caspase的激活而实现的。活化的caspase通过酶解不同的底物蛋白产生不同的生物效应:(1)对凋亡抑制因子进行灭活;(2)破坏细胞结构;(3)通过分离蛋白的催化及调控功能区使其获得或失去一定的功能,从而进一步调控相关的下游事件,如细胞皱缩、膜发疱、染色质聚集、DNA片断化等,导致凋亡的典型形态学改变。各种引起凋亡的因素,如Fas死亡因子、肿瘤坏死因子、P53等均需要激活caspase-3才能导致细胞凋亡。MSCs可随血液循环到达全身其他器官组织,参与生理更新和病理损伤修复。MSC可分化为神经样细胞〔8〕,可以取代已经死亡的神经细胞。脑梗死后神经再生及神经功能恢复与病灶区及病灶周围的血管发生、重塑密切相关〔9〕。MSCs能分泌脑源性神经营养因子、神经生长因子、血管内皮生长因子、肝细胞生长因子等,对神经功能的恢复发挥重要作用。MSCs与神经干细胞共培养,MSCs能诱导神经干细胞分化为神经元。本实验成功地将MSCs诱导为神经样细胞。MSCs回输脑缺血再灌注模型大鼠后caspase-3基因下调,抑制神经细胞凋亡。治疗组caspase-3表达明显低于模型组,具有统计学意义。治疗组caspase-3表达接近于对照组。由于MSCs具有体外培养扩增比较容易且免疫原性小的优点,异体移植可修复损伤的组织或治疗相应组织病变,为脑缺血治疗理想的种子细胞。
1 Chivu M,Dima SO,Stancu CI,et al.In vito hepatic differentiation of human bonemarrow mesenchymal stem cells under differential exposure to liver-specific factors〔J〕.Transl Res,2009;154:122-32.
2 Violini S,Ramelli P,Pisani LF,et al.Horse bone marrow mesenchymal stem cells express embryo stem cell markers and show the ability for tenogenic differentiation by in vitro exposure to BMP-12〔J〕.BMC Cell Biol,2009;10:29-34.
3 Jin JD,Wang HX,Xiao FJ,et al.A novel rich source of human mesenchymal stem cells from the debris of bone marrow samples〔J〕.Biochem Biophys Res Commun,2008;376(1):191-5.
4 Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats〔J〕.Stroke,1989;20:84-91.
5 朱 继,万 东,唐文渊.改良线栓法制备大鼠局灶脑缺血模型〔J〕.第四军医大学学报,2008;29(8):685-7.
6 Niwa M,Hara A,Iwai T,et al.Caspase activation as an apoptotic evidence in the gerbil hippocampal CA1 pyramidal cells following transient forebrain ischemia〔J〕.Neurosci Lett,2001;300(2):103-4.
7 Namura S,Zhu J,Fink K,et al.Activation and cleavage of caspase-3 in apoptosis induced by experimental cerebral ischemia〔J〕.J Neurosci,1998;18(10):3659-60.
8 Chao YX,He BP,Cao Q,et al.Protein aggregate containing neuron like cells are differentiated from bone marrow mesenchymal stem cells from mice with neurofilament light subunit gene deficiency〔J〕.Neurosci Lett,2007;417:240-5.
9 Toyama K,Honmou O,Harada K,et al.Therapeutic benefits of angiogenetic gene-modified human mesenchymal stem cells after cerebral ischemia〔J〕.Exp Neurol,2009;216:47-55.

