伏立康唑治疗隐球菌病的研究进展
廖勇 杨蓉娅
(北京军区总医院全军皮肤病诊疗中心,北京100700)
伏立康唑(voriconazole)是辉瑞公司在氟康唑结构基础上研发的新型广谱抗真菌药,2007年6月在美国批准上市,是第二代合成三唑类抗真菌药,通过抑制细胞色素P450酶依赖的14-α固醇去甲基酶的功能,干扰细胞膜的形成和真菌的生长。目前,有关伏立康唑对于新生隐球菌作用的基础研究、药敏试验、动物实验以及隐球菌病的临床应用报道,都提示伏立康唑对于隐球菌病的治疗可能是一个有价值的选择。
1 伏立康唑对新生隐球菌的基础研究
1.1 伏立康唑对新生隐球菌及格特隐球菌的体外药敏试验
对印度西北地区及巴西分离的新生隐球菌环境分离株进行体外药敏试验[1-2],结果显示伏立康唑的抗菌活性最强(见表1)。对科威特分离环境株(32株新生隐球菌和18株格特隐球菌菌株)的研究亦得到同样的结果,且不同菌种对于伊曲康唑和伏立康唑的敏感性不同,格特隐球菌菌株的敏感性低于新生菌株[3]。Okabayashi K 等[4]发现,伏立康唑对动物隐球菌病分离的菌株同样具有良好的抗菌活性,MICs值为 0.062 5 ~0.5mg/L,其抗菌活力是伊曲康唑的2倍。
近10a来,已有大量关于新生隐球菌临床株
的体外药敏试验,结果见表2。Pfaller MA等[5]对美国及非洲临床株的研究发现:对氟康唑MIC90>16 mg/L的临床株,几乎全部 (99%)对伏立康唑敏感,且MIC90均≤1 mg/L。台湾地区多中心研究显示,70株中3株对氟康唑MICs>16 mg/L,2株对两性霉素 B>2 mg/L,但对伏立康唑均≤0.5 mg/L;提示我们应该更加关注逐渐出现的新生隐球菌对氟康唑及两性霉素B敏感性下降的现象,并进行监测以指导治疗[6]。Aller AI等[7]比较了西班牙两个时间阶段 (1994~1996年和1997~2005年)的临床株(艾滋病患者)对不同抗真菌药敏感性的变化,发现伏立康唑和伊曲康唑的敏感性没有显著的变化;氟康唑仍然对大多数菌株有效,但其耐药性在过去的11 a间增加了2倍。全球抗真菌监测研究项目获得2 824株新生隐球菌 (1997~2007年),其对氟康唑总的敏感率为77.1%、耐药率为11.2%;对伏立康唑总的敏感率为97.0%、耐药率为1.7%;分析3个时间阶段 (1997~2000年、2001~2004年和2005~2007年)对抗菌药的耐药率变化:氟康唑 (7.3%、10.9%和11.7%),呈逐渐升高趋势;伏立康唑 (0%、1.7%和1.8%),有所升高,但仍较低[8]。类似的体外药敏试验结果在非洲[9]、柬埔寨[9]、西班牙[10]及美国[11]临床株的研究中也有报道。以上大多数研究显示,与氟康唑、伊曲康唑及两性霉素B相比,伏立康唑的MICs值最低,抗菌活性优于其他抗真菌药;氟康唑及两性霉素B逐渐出现耐药现象,且以氟康唑最为显著,而伏立康唑的耐药现象较少见。然而也有不同的研究结果,Yildiran ST等[12]对10 a间(1990 ~1999年)共213株临床分离进行体外药敏试验,不同年份比较,两药的MIC值在这10 a间未见显著的升高。同时,有研究发现:氟胞嘧啶分别和氟康唑、伊曲康唑、两性霉素B及伏立康唑联合,与30株新生隐球菌临床株共孵育,发现其协同作用分别是:77%、60%、77%及80%,未见拮抗作用,且氟胞嘧啶和伏立康唑的协同作用最大[14]。
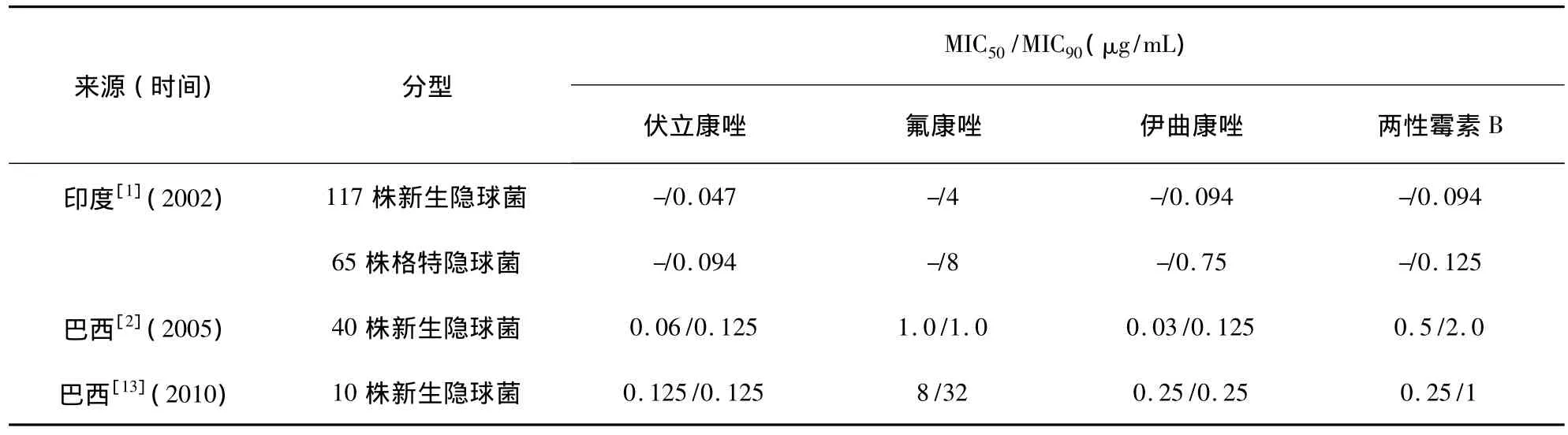
表1 新生隐球菌及格特隐球菌环境株体外药敏试验结果Tab.1 In vitro susceptibilities of environmental Cryptococcus neoformans and Cryptococcus gattii isolates

表2 新生隐球菌及格特隐球菌临床株体外药敏试验结果Tab.2 In vitro susceptibilities of clinical Cryptococcus neoformans and Cryptococcus gattii isolates
1.2 伏立康唑抗新生隐球菌的基础研究
黑素是隐球菌的重要毒力因子,通过清除机体产生的自由基从而保护隐球菌免受氧化损伤;同时,它可能是隐球菌对中枢神经系统有高度亲和力的原因之一。研究显示在最低抑菌浓度下,与氟康唑、伊曲康唑及两性霉素B相比,只有伏立康唑能够抑制黑素的合成,它是通过抑制laccase漆酶的活力,继而显著下调黑素合成相关基因LAC1的表达,最终抑制黑素的合成[18]。van Duin D等发现伏立康唑可以显著改变隐球菌细胞及荚膜的大小,电镜扫描显示,隐球菌荚膜的形态也发生了显著的变化,同样的现象在氟康唑以及两性霉素B中也得到过报道。荚膜多糖是新生隐球菌另一个重要的毒力因子,研究发现,在最低抑菌浓度的伏立康唑作用下,隐球菌所释放的荚膜多糖的未见明显增加[19];而既往的研究报道,在氟康唑及两性霉素B作用下,其释放量会明显增加。另外还有研究显示,中性粒细胞、单核细胞、巨噬细胞分别单独与新生隐球菌共孵育24 h,抑菌率分别是61%、34%及23%,未见明显杀菌现象;单独给予伏立康唑 (0.01/0.05 mg/mL)孵育24 h,其抑菌率为48%,杀菌率为19%。在同时给予伏立康唑 (0.01/0.05 mg/mL)后,中性粒细胞、单核细胞及巨噬细胞的杀菌率分别增加至:51%/71%、41%/58%及14%/34%,作用大于两者单纯的加成,证明伏立康唑能够增加免疫效应细胞对新生隐球菌的抑制及清除作用[20]。伏立康唑较两性霉素B更易通过血脑屏障而到达脑组织及脊髓腔,在体外抑菌作用上又明显优于氟康唑,而且能够减少隐球菌黑素的合成,但不会引起荚膜多糖释放增加;因此伏立康唑可能在治疗隐球菌病中具有一定优势。
1.3 伏立康唑对隐球菌病动物实验研究
Kirkpatrick WR等[21]建立了新生隐球菌性脑膜炎猪模型,并检测两性霉素B及伏立康唑对其的作用。对提前给予免疫抑制剂的动物颅内注射新生隐球菌建模,之后按各组要求给予药物干预,给药后在不同时间点取脑脊液行培养,并计数菌落数,结果发现在第7天时,不论是伏立康唑干预组还是两性霉素B干预组计数均较前增加近1倍,但在第15天时,计数均开始下降,伏立康唑5 mg·kg-1·d-1组、10 mg·kg-1·d-1组及 20 mg·kg-1·d-1组分别为35%、80%及50%,两性霉素B 1 mg·kg-1·d-1组也显著下降50%;15 h后处死动物取脑及肾组织,与对照组相比各干预组均能有效降低脑组织隐球菌负荷量,只有伏立康唑10 mg·kg-1·d-1组能有效降低肾组织隐球菌负荷量。在新生隐球菌中枢神经系统感染的小鼠模型中,研究伏立康唑与两性霉素B的疗效并进行比较。在感染症状出现1 d后,小鼠分别用伏立康唑在 10、40、60 mg·kg-1·d-1口服或给予两性霉素 B 1.5 mg·kg-1·d-1腹腔注射,治疗持续给药10 h。在治疗第7天及治疗结束后1 d进行组织负荷研究,结果发现,两种药物能够使感染组的生存时间较对照组显著延长,而伏立康唑60 mg·kg-1·d-1试验组组织的隐球菌菌体负荷量减少最多[22]。另一个研究同样显示,伏立康唑能够显著降低新生隐球菌感染小鼠的血清乳胶凝集水平,并且显著延长感染小鼠的生存期[23]。另一项研究发现:对氟康唑耐药菌株感染的免疫缺陷小鼠(BALB/c-SCID),在单独给予两性霉素 B(1.5 mg·kg-1·d-1)及伏立康唑(40 mg·kg-1·d-1)时,虽然小鼠的生存期得到有效延长,但靶器官(脑及肺组织)的菌体负荷仍然很高,可能是由于唑类药物之间存在的交叉耐药现象,导致伏立康唑对于氟康唑耐药菌株的体内反应性低;但两者联用时,在小鼠的生存期有效延长的同时,靶器官(脑及肺组织)的菌体负荷显著降低[24]。但也有实验发现:两性霉素B是清除组织菌体负荷和延长生存期最有效的药物,伏立康唑虽然具有较高的脑组织浓度,但降低脑组织菌体负荷的作用不强,认为伏立康唑只是一个潜在治疗肺隐球菌病的药物[25];本实验是构建了格特隐球菌感染,而其他实验则是以新生隐球菌建模,不同菌种在体内对于药物反应性的差别可能导致实验的结果之间的差别。
2 伏立康唑治疗隐球菌病的临床研究
2.1 国外多中心研究
Perfect等[26]进行了一项开放、多中心临床研究,以评估伏立康唑治疗难治和罕见的侵袭性真菌感染方面的疗效和安全性。伏立康唑治疗方案如下:若静脉注射,则在开始24 h内注入6 mg/kg的负荷剂量,1次/12 h,而后3 d内或3 d以后注射入4 mg/kg的负荷剂量,1次/12 h。在静脉注射治疗后结束,患者可转入伏立康唑口服治疗,200 mg/次,2次/d。单纯口服伏立康唑治疗可在第1天400 mg/次,2 次/d,之后为 200 mg/次 (体重少于40 kg的患者减半服用),2次/d。在治疗终点(EOT)或在第16周进行疗效评估。此研究中共18例隐球菌病患者,其中7例对疗效满意,治愈率为39%;在11例治疗效果不佳的隐球菌病患者中,有10个病情稳定 (指在治疗终点有极小的临床改善或没有临床改善,但没有出现恶化状况,或血清学反应不变)。对本研究中18例隐球菌患者的临床分离株进行体外药敏试验发现,伏立康唑对菌株的 MIC 范围是0.005 ~0.03 mg/L,其 MIC90平均值低于伊曲康唑 (0.125 mg/L)及氟康唑 (8 mg/L)。该研究显示,尽管用伏立康唑对于标准方案治疗失败的难治性隐球菌病的治愈率仍相对较低(39%),但大多数隐球菌性脑膜炎患者 (56%)在使用伏立康唑治疗后,虽未痊愈但病情得到有效控制,处于稳定状态。
2.2 国外个案报道
Sabbatani S等[27]报道1例46岁非艾滋病男患者,发生脑隐球菌性肉芽肿。在进行神经外科手术后,初期治疗给予600 mg/d的氟康唑,11 d后脑磁共振成像(MRI)扫描发现仍有大面积残余灶及周围水肿。随即改为伏立康唑 (400 mg/d)静滴。1个月后,正电子发射断层扫描 (PET)检查显示,原有残余灶放射性核素的浓度降至很低;MRI扫描显示出水肿有一定的减少。治疗2个月后,临床症状改善,血清隐球菌抗原检查呈阴性,改伏立康唑口服。患者最终死于心脏病和恶化的终末期肾功能不全,对患者进行尸检和大脑研究,未找到隐球菌残余。Izumikawa K等[28]报道1例免疫功能正常的肺隐球菌病患者,在给予氟康唑治疗期间发生胸膜炎,胸水镜检发现隐球菌,通过PCR和DNA测序证明是新生隐球菌,给予伏立康唑加氟胞嘧啶治疗,并同时进行胸腔灌洗,患者最终治愈。Tschudin等[29]报道了1例42岁的女性肾移植患者,初始给予两性霉素B及5-氟胞嘧啶治疗。由于出现药疹,5-氟胞嘧啶在治疗2 d后停药。而后改用口服伏立康唑5周,患者的临床症状得以改善,由于脑脊液培养仍然呈阳性,将治疗改为两性霉素B脂质体治疗2周,但脑脊液培养仍然阳性,血清乳胶凝集试验结果从1∶128上升到至1∶1 024,治疗改回伏立康唑。最终,在给予10周的治疗后,培养转阴。伏立康唑治疗18个月后,CSF和血清乳胶凝集试验阴性。另有研究报道1例40岁男性艾滋病患者继发隐球菌性脑膜炎,通过标准治疗方案治疗无效,给予伏立康唑加依非韦伦联合治疗,在连续血药浓度监测的基础上,取得了能达到合适的血浆及脑脊液伏立康唑浓度和依法韦伦达到目标血药浓度的治疗剂量 (伏立康唑200 mg/次 ,2次/d;依法韦伦300 mg/次,1次/d,均为口服给药)。在长期的后续治疗过程中 (66周),本治疗方案表现出迅速而稳定的抑制隐球菌的作用,并未见显著不良反应[30]。Bandettini R 等[31]也报道 1 例白血病患儿接受骨髓移植后继发隐球菌性脑膜炎,使用伏立康唑治疗,最终治愈。JoséIV等[32]也报道1例伏立康唑成功治愈隐球菌性内眼炎的病例。
2.3 国内个案报道
卢洪洲等[33]报道1例13 d婴儿罹患隐球菌性脑膜炎,患者在给予两性霉素B加氟胞嘧啶抗真菌治疗的情况下,症状有所改善,但病情出现2次反复。后改伏立康唑静脉7 mg·kg-1·d-1,2次/d,单一治疗20 d;患儿临床症状和体征基本消失,脑脊液涂片及培养阴性;治疗期间未见明显的副作用;出院后继续口服伏立康唑7 mg·kg-1·d-1,2次/d,治疗1个月后,血及脑脊液乳胶凝集试验阴性,随访半年未见复发。朱一飞等[34]报道3例伏立康唑成功治愈隐球菌性脑膜炎的病例。例1为25岁男性,确诊为新生隐球菌性脑膜炎,给予氟康唑200 mg/次,2次/d,治疗3 d症状逐渐加重,改用静滴伏立康唑。首日6 mg/kg,分2次/d,次日改维持量4 mg/kg,分2次/d,同时鞘内注射两性霉素B 0.25 mg,治疗11 d后,症状缓解,颅压下降,脑脊液隐球菌涂片转阴。随访3个月无复发。例2为58岁女性。诊断隐球菌性脑膜炎4个月,口服氟康唑200 mg,1次/d维持治疗,症状加重2周入院。给予伏立康唑静滴,首日400 mg/次,1次/d,次日改为200 mg/次,2次/d。治疗12 d后症状缓解,脑脊液隐球菌涂片转阴。随访3个月无复发。例3为88岁男性,诊断隐球菌性脑膜炎。伏立康唑治疗方案同前,治疗1个月后症状缓解,脑脊液隐球菌涂片转阴。随访3个月无复发。
3 评 述
目前,国内外对伏立康唑的推荐适应症为:侵袭性曲霉病,对氟康唑耐药的念珠菌引起的严重侵袭性感染以及足放线菌属和镰刀菌属引起的严重感染,但是其治疗新生隐球菌感染的适应症尚未获得批准。目前治疗隐球菌脑膜炎的标准方案[35]是:初始阶段给予两性霉素B联合氟胞嘧啶2周,随后改为口服氟康唑治疗,但越来越多的报道发现标准方案在部分患者中效果不佳[26,27,29,33]。而有关伏立康唑对于新生隐球菌作用的体外研究却发现,其能有效抑制隐球菌荚膜及黑素的合成,并有较高的杀菌率;环境株和临床株的体外药敏试验显示,其对两性霉素B及氟康唑都出现不同程度的耐药,特别是氟康唑有逐渐增加趋势,而对伏立康唑的耐药较少见,且其对两性霉素B及氟康唑的耐药株仍然有效;动物实验及隐球菌病的临床应用报道也提示伏立康唑对于隐球菌病具有潜在的疗效及独特的优势。但迄今为止,伏立康唑对隐球菌病病疗效研究的相关报道还不多,且均为隐球菌性脑膜炎的患者,还未见到肺隐球菌病临床治疗的相关报道;须经过更多、更大规模的、更具可比性的临床及基础实验研究来探讨、验证及推动伏立康唑在隐球菌病的临床应用研究。
[1] Khan ZU,Randhawa HS,Kowshik T,et al.Antifungal susceptibility of Cryptococcus neoformans and Cryptococcus gattii isolates from decayed wood of trunk hollows of Ficus religiosa and Syzygium cumini trees in north-western India[J].J Antimicrob Chemother,2007,60(2):312-316.
[2] Souza LK,Fernandes Ode F,Kobayashi CC,et al.Antifungal susceptibilities of clinical and environmental isolates of Cryptococcus neoformans in Goi nia city,Goiás,Brazil[J].Rev Inst Med Trop Sao Paulo,2005,47(5):253-256.
[3] Khan ZU,Randhawa HS,Chehadeh W,et al.Cryptococcus neoformans serotype A and Cryptococcus gattii serotype B isolates differ in their susceptibilities to fluconazole and voriconazole[J].Int J Antimicrob Agents,2009,33(6):559-563.
[4] Okabayashi K,Imaji M,Osumi T,et al.Antifungal activity of itraconazole and voriconazole against clinical isolates obtained from animals with mycoses[J].Nippon Ishinkin Gakkai Zasshi,2009,50(2):91-94.
[5] Pfaller MA,Zhang J,Messer SA,et al.In vitro activities of voriconazole,fluconazole,and itraconazole against 566 clinical isolates of Cryptococcus neoformans from the United States and Africa[J].Antimicrob Agents Chemother,1999,43(1):169-171.
[6] Hoban DJ,Zhanel GG,Karlowsky JA.In vitro susceptibilities of Candida and Cryptococcus neoformans isolates from blood cultures of neutropenic patients[J].Antimicrob Agents Chemother,1999,43(6):1463-1464.
[7] Mitsuyama J,Nomura N,Hashimoto K,et al.In vitro and in vivo antifungal activities of T-2307,a novel arylamidine[J].Antimicrob Agents Chemother,2008,52(4):1318-1324.
[8] Pfaller MA,Diekema DJ,Gibbs DL,et al.Results from the ARTEMISDISK Global Antifungal Surveillance Study,1997 to 2007:10.5-year analysis of susceptibilities of noncandidal yeast species to fluconazole and voriconazole determined by CLSI standardized disk diffusion testing[J].J Clin Microbiol,2009,47(1):117-123.
[9] Chandenier J,Adou-Bryn KD,Douchet C,et al.In vitro activity of amphotericin B,fluconazole and voriconazole against 162 Cryptococcusneoformans isolates from Africa and Cambodia[J].Eur JClin Microbiol Infect Dis,2004,(6):506-508.
[10] Perkins A,Gomez-Lopez A,Mellado E,et al.Rates of antifungal resistance among Spanish clinical isolates of Cryptococcus neoformans var.neoformans[J].J Antimicrob Chemother,2005,56(6):1144-1147.
[11] Thompson GR,Wiederhold NP,Fothergill AW,et al.Antifungal susceptibilities among different serotypes of Cryptococcus gattii and Cryptococcus neoformans[J].Antimicrob Agents Chemother,2009,53(1):309-311.
[12] Yildiran ST,Fothergill AW,Sutton DA,et al.In vitro susceptibilities of cerebrospinal fluid isolates of Cryptococcus neoformans collected during a ten-year period against fluconazole,voriconazole and posaconazole(SCH56592)[J].Mycoses,2002,45(9-10):378-383.
[13] Ana KF,Costa JJC,Sidrim RA.Urban Pigeons(Columba livia)as a Potential Source of Pathogenic Yeasts:A Focus on Antifungal Susceptibility of Cryptococcus Strains in Northeast Brazil[J].Mycopathologia,2010,169(3):207-213.
[14] Patrick Schwarz.In vitro interaction of flucytosine with conventional and new antifungals against Cryptococcusneoformans clinical isolates[J].Antimicrob Agents Chemother,2003,3:3361-3364.
[15] Chang WN,Huang CR,Lei CB,et al.Serotypes of clinical cerebrospinal fluid Cryptococcus neoformans isolates from southern Taiwan and their in vitro susceptibilities to amphotericin B,fluconazole,and voriconazole[J].Jpn J Infect Dis,2004,57(3):113-115.
[16] Souza LK,Fernandes Ode F,Kobayashi CC,et al.Antifungal susceptibilities of clinical and environmental isolates of Cryptococcus neoformans in Goi nia city,Goiás,Brazil[J].Rev Inst Med Trop Sao Paulo,2005,47(5):253-256.
[17] Hagen F,Illnait-Zaragozi MT,Bartlett KH,et al.In vitro antifungal susceptibilities and AFLP genotyping of a worldwide collection of 350 clinical,veterinary and environmental Cryptococcus gattii isolates.Antimicrob Agents Chemother,2010 Sep 20[Epub ahead of print].
[18] Martinez LR,Ntiamoah P,Gácser A,et al.Voriconazole inhibits melanization in Cryptococcus neoformans[J].Antimi-crob Agents Chemother,2007,51(12):4396-4400.
[19] van Duin D,Cleare W,Zaragoza O,et al.Effects of voriconazole on Cryptococcus neoformans[J].Antimicrob Agents Chemother,2004,48(6):2014-2020.
[20] Chiller T,Farrokhshad K,Brummer E,et al.Effect of granulocyte colony-stimulating factor and granulocyte-macrophage colony-stimulating factor on polymorphonuclear neutrophils,monocytes or monocyte-derived macrophages combined with voriconazole against Cryptococcus neoformans[J].Med Mycol,2002,40(1):21-26.
[21] Kirkpatrick WR,Najvar LK,Bocanegra R,et al.New guinea pig model of cryptococcal meningitis[J].Antimicrob Agents Chemother,2007,51(8):3011-3013.
[22] Serena C,Pastor FJ,MarinéM,et al.Efficacy of voriconazole in a murine model of cryptococcal central nervous system infection[J].JAntimicrob Chemother,2007,60(1):162-165.
[23] Mavrogiorgos N,Zaragoza O,Casadevall A,et al.Efficacy of voriconazole in experimental Cryptococcus neoformans infection[J].Mycopathologia,2006,162(2):111-114.
[24] Silva EG,Paula CR,Dias AL,et al.Combination efficacy of voriconazole and amphotericin B in the experimental disease in immunodeficient mice caused by fluconazole-resistant Cryptococcus neoformans[J].Mycopathologia,2010 Oct 24[Epub ahead of print].
[25] Calvo E,Pastor FJ,Rodríguez MM,et al.Antifungal therapy in a murine model of disseminated infection by Cryptococcus gattii[J].Antimicrob Agents Chemother,2010,54(10):4074-4077.
[26] Perfect JR,Marr KA,Walsh TJ,et al.Voriconazole treatment for less common,emerging,or refractory fungal infections[J].Clin Infect Dis,2003,36:1122-1131.
[27] Sabbatani S,Manfredi R,Pavoni M,et al.Voriconazole proves effective in long-term treatment of a cerebral cryptococcoma in a chronic nephropathic HIV-negative patient,after fluconazole failure[J].Mycopathologia,2004,158(2):165-171.
[28] Izumikawa K,Zhao Y,Motoshima K,et al.A case of pulmonary cryptococcosis followed by pleuritis in an apparently immunocompetent patient during fluconazole treatment[J].Med Mycol,2008,46(6):595-599.
[29] Tschudin S,Elzi L,Mayr M,et al.Successful treatment of cryptococcal meningitis with voriconazole in a kidney transplant recipient[J].Int JInfect Dis,2006,10(3):17.
[30] Carbonara S,Regazzi M,CiracìE,et al.Long-term efficacy and safety of TDM-assisted combination of voriconazole plus efavirenz in an AIDSpatient with cryptococcosis and liver cirrhosis[J].Ann Pharmacother,2009,43(5):978-984.
[31] Bandettini R,Castagnola E,Calvillo M,et al.Voriconazole for cryptococcal meningitis in children with leukemia or receiving allogeneic hemopoietic stem cell transplant[J].J Chemother,2009,21(1):108-109.
[32] JoséIV,Jesús DC,Ferran S,et al.Management of endogenous cryptococcal endophthalmitis with voriconazole[J].Can J Ophthalmol,2009,44(6):e61-62.
[33] Lu HZ.Voriconazole in an infant with cryptococcal meningitis[J].Chin Med J,2008,121(3):286-288.
[34] 朱一飞,邹月丽,王敏,等,伏立康唑治疗隐球菌性脑膜炎三例报告[J].脑与神经疾病杂志,2008,16(6):669-670.
[35] Saag MS,Graybill RJ,Larsen RA,et al.Practice Guidelines for the Management of Cryptococcal Disease[J].Clin Infect Dis,2000,30(4):710-718.

