川芎嗪、阿魏酸微透析体外回收率及体内稳定性的研究
王利胜, 石宗丰, 郭 琦, 刘宏伟, 赖宝林
(广州中医药大学中药学院,广东广州 510006)
微透析技术(microdialysis)是一种直接进行组织采样分析的方法,可通过探针的回收率(recovery)计算组织中药物的浓度[1]。在国际上已被广泛应用于动物和人体的研究,其在药动学研究中特别是局部药动学中具有其他药动学方法难以取代的地位,在中药及其复方研究中则少见相关报道。
阿魏酸(ferulic acid,FA)、川芎嗪(tetramethylpyrazine,TMP)分别是当归、川芎中的主要有效成分,在传统复方四物汤、佛手散、补阳还五汤等含量较高。TMP是当归、川芎中的主要活性生物碱,现代研究表明[2]TMP具有扩张血管、抑制血小板聚集、防止血栓形成、改善脑缺血等多种作用。FA是川芎中的主要有效成分之一,现代药理研究证实其在抗氧化、清除自由基、有效抑制血小板聚集和血栓形成等方面具有确切的药理活性,对大鼠脑缺血再灌注损伤具保护作用[3-4]。本课题组在前期的研究中建立了TMP在小鼠血浆、脑、肝中含量的HPLC法[5],发现采用微乳这种纳米微粒载药体系可以提高TMP在脑内的分布[6]。在此基础上开发了复方芎冰微乳,主要含有TMP和FA成分,经过药理实验证实,具有良好的保护大鼠脑缺血方面的作用[7]。实验过程发现传统的药动学研究方法往往每一只动物只能获得一个数据,需要用大批量的实验动物才能获得完整的药时数据,个体差异大。近年来,由于微透析技术可以使用更少的动物数而获得更加准确的数据信息[8],其在药动学领域的研究已成为国内研究的热点。为了利用微透析取样技术同时进行中药及复方中FA、TMP的在体药动学研究,本实验初步确定了探针回收率的校正方法及其稳定性,现报道如下:

图1 阿魏酸、川芎嗪HPLC色谱图Fig.1 The HPLC chromatograms of FA/TMP by microdialysis sampling
1 仪器与试药
1.1 仪器 waters高效液相色谱仪(Waters 515泵,Waters2487检测器);瑞典CMA402灌注器推进泵、灌注器;MAB7.40.10同心圆型血液探针(截留分子量15 000D);AUW120D十万分之一分析天平(日本岛津)。
1.2 药物与试剂 阿魏酸、盐酸川芎嗪对照品(购自中国药品生物制品检定所,供含量测定用,批号:110773-200611、110817-200305);川芎嗪 (泽朗植提,含量≥98.5%)。乙腈、水均为色谱级,其他试剂为分析级。
1.3 其他 SD大鼠,SPF级,体重280~320 g(许可证号:SCXK(粤)2008-0020),由广州中医药大学实验动物中心提供。
2 方法与结果
2.1 微透析液中FA、TMP含量测定方法的建立
2.1.1 色谱条件 迪马 platisil ODS柱(5 μm,250 mm×4.6 mm);Phenomenex保护柱;流动相:乙腈-0.5%冰乙酸(36:64);流速1 mL/min,检测波长为307 nm;外标法定量。
2.1.2 专属性考察 大鼠麻醉后并植入血液探针,收集空白透析液为空白样品。平衡1 h后灌流液改为FA/TMP浓度分别为0.54/0.92 μg/mL的含药林格氏液,并收集血液透析样品,进样分析,结果表明透析液中FA、TMP峰形良好,分别在约4.7、6.2 min出峰,分离度及对称因子均符合要求,可知在本实验条件下的分析方法具有良好的专属性。见图1。
2.1.3 线性关系考察 取五氧化二磷中干燥至恒重的FA、盐酸川芎嗪对照品,分别精密称取2.60 mg和3.04 mg(相当于TMP 1.98 mg),加适量甲醇溶解并用林格氏试液定容至20 mL,再用林格氏试液将其稀释1 000倍后作为对照品溶液,分别进样1、4、8、10、15、20 μL 后记录峰面积积分值,以峰面积积分值为纵坐标Y,进样量为横坐标X,绘制标准曲线。得FA回归方程:Y=4.635 8X+143.98,R=1.000 0;TMP回归方程为:Y=2.335 5X+31.967,R=0.999 9;结果表明,FA进样量在1.3 ng~26.00 ng范围内、TMP在0.99~19.8 ng范围内线性关系良好。
2.1.4 精密度与稳定性试验 将上述对照品溶液于冷藏(0~4 ℃)、避光条件下储存,吸取10 μL,连续进样5次,测得 FA、TMP峰面积 RSD分别为1.17%、1.04%,说明仪器精密度良好;每隔2 h进样3次并记录峰面积,结果样品在8 h内稳定性良好(RSD<2.5%)。
2.2 微透析试验
2.2.1 林格氏液及含药林格氏液的配制 分别称取 8.599 gNaCl、0.144 gCaCl2、0.298 gKCl溶解于超纯水中,并定容至1 000 mL,过0.45 μm微孔滤膜,即得林格氏液。另精密称取FA、TMP适量,用林格氏液超声溶解,即得含药林格氏液。
2.2.2 流速对相对回收率(Relative Recovery,RR)及相对损失率(Relative Loss,RL)的影响 用空白林格氏液在不同流速(0.5、1.0、1.5、2.0、2.5、3.0 μL/min)灌流置于FA/TMP浓度分别为0.84/0.97 μg/mL的含药林格氏液的血液探针。每种流速在平衡0.5 h后收集5份样品(每份样品30 μL,下同),HPLC测定接收品浓度Cdialysis和原药液中药物浓度Cperfusate,按公式 RR=Cdialysis/Cperfusate×100%(公式1)计算RR;
用FA/TMP浓度分别为0.93/0.95 μg/mL的含药林格氏液分别在以上流速下灌流置于空白林格氏液中的血液探针,平衡0.5 h后收集5份样品,接样的同时取相应一份原药液,HPLC测定接收品Cdialysis和原药液中药物浓度Cperfusate,按公式 RL=(Cperfusate-Cdialysis)/Cperfusate×100%(公式 2)计算RL。
不同流速下FA、TMP的RR及RL结果取平均值,结果见图2。
结果表明,随着流速的增加,FA、TMP的回收率呈降低趋势,RR与RL在各种流速下均基本一致,这为反透析法进行探针回收率校正提供了实验依据。
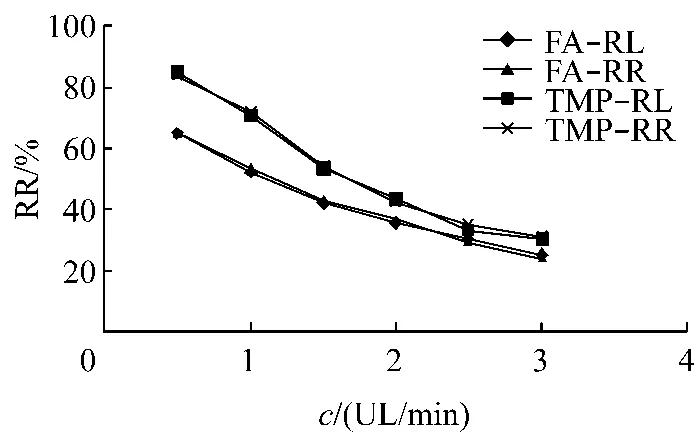
图2 不同流速对FA、TMP的RR、RL影响Fig.2 The effect on RR and RL under different flow rate
2.2.3 药物浓度对回收率的影响 体内微透析试验中,探针周围的药物浓度是实时变化的,为了保证透析液中药物浓度变化能正确反映组织中药物浓度的变化,探针回收率大小必须相对稳定。
将探针分别植入FA/TMP浓度分别为2.51/2.57、1.63/1.55、0.97/1.03、0.48/0.50、0.25/0.24 μg/mL的含药林格氏液,以空白林格氏液1.5 μL/min流速灌流探针,每种浓度中平衡0.5 h后收集5份样品,HPLC测定样品和含药林格氏液中药物浓度,按公式1计算回收率,每组取平均值;结果见图3。

图3 不同FA、TMP浓度对探针RR的影响Fig.3 The effect on RR under different FA/TMP concentration
结果显示,当以1.5 μL/min的流速灌注探针时,在5种不同药物浓度的透析媒体中,所得回收率很接近。以回收率对浓度作图,结果为一条与x轴大致平行的直线,表明在一定浓度范围内,探针对FA、TMP的回收率与浓度无关。
2.2.4 体内RL的稳定性考察 由于动物体内的药物实际浓度是未知的,所以探针真正的体内RR是无从测得的。前面已证明,相同条件下,RR与RL差别不大,说明RL可代替RR进行体内校正。但是,体内微透析试验持续时间一般较长,同一根探针常常需要连续灌流几个小时甚至是几十个小时,如果在长时间的取样过程中回收率发生变化,就会造成试验结果的可信度降低。
体内试验前将探针置肝素钠注射液中以0.5 μL/min的灌流速度灌流空白林格氏液20 min,使膜内外充分饱和肝素钠注射液,防止在探针植入过程发生凝血。然后使用FA/TMP浓度分别为0.92/0.96 μg/mL的含药林格氏液1.5 μL/min流速灌流探针。探针置入方法:SD大鼠,乌拉坦麻醉后钝性分离颈静脉,结扎远心端,并在远心端剪一小口,将血液探针朝心脏方向植入约2.4 cm,并用缝合线固定探针。平衡1 h后每隔20 min收集一次透析液样品,灌流10 h,测定含药林格氏液和透析液样品中药物浓度,按公式2计算体内RL。结果见图4。
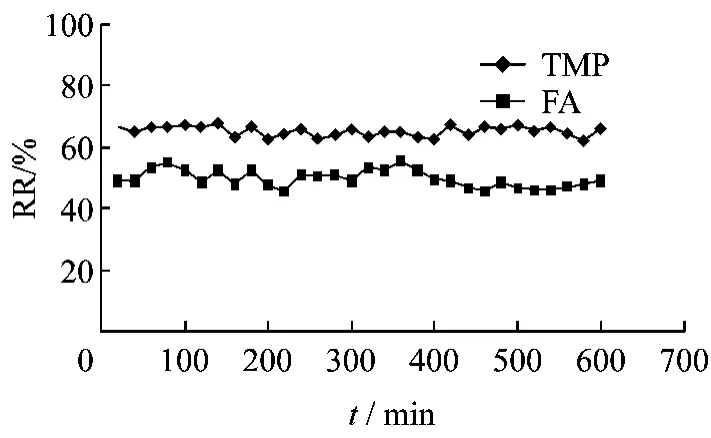
图4 体内回收率的稳定性考察结果Fig.4 The stability of RL in vivo
结果表明,当灌流液流速为1.5 μL/min时,FA、TMP体内RL在10 h内保持相对稳定,血液探针FA体内RL在10 h内平均回收率为49.71%,RSD为5.63%;TMP平均体内RL为65.16%,RSD为2.50%,均具有良好的体内稳定性。
2.2.5 连续使用5次的探针回收率的比较 取新探针用林格氏液以2 μL/min的灌流速度灌流5 h以上,使膜内外平衡、充分浸湿,并冲洗掉半透膜上的一些小分子,备用。取 SD大鼠5只,其余按2.2.4项下实验方法操作,每只大鼠在平衡1 h后接收5份样品,测定含药林格氏液和透析液样品中药物浓度,按公式2计算体内RL。结果见表1、表2。

表1 同一探针使用5次的FA回收率变化情况(n=5)Tab.1 The variation of RR of FA in 5 times in one probe(n=5)
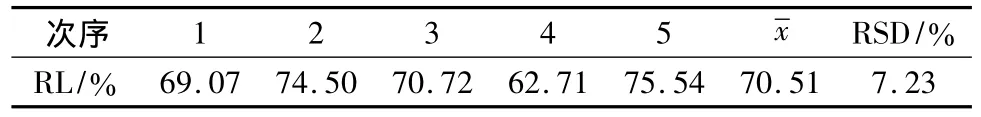
表2 同一探针使用5次的TMP回收率变化情况(n=5)Tab.2 The variation of RR of TMP in 5 times in one probe(n=5)
实验表明,同一只探针在使用5次后依然可以保持较高的回收率,但各次之间回收率波动较大,说明在每次实验后均需进行体内校正。
3 讨论
微透析技术是将灌流取样和透析技术结合起来并逐渐完善的一种新型生物采样技术,相对于其他生物取样技术,微透析技术具有以下几个方面独特的优势[9]:①其最大的优点是可在基本上不干扰体内正常生命过程的情况下进行在体、实时和在线取样,特别适用于研究生命过程的动态变化;②微透析技术不改变细胞外液(ECF)中的液体平衡,既可以对同一组织进行长时间连续采样,也可以对同一动物进行多个部位采样,因此,用较少的实验动物就可以得到足够的数据,避免了由于动物的个体差异所造成的实验误差;③由于微透析技术只允许小分子物质通过半透膜,大分子的蛋白、脂质类物质不随透析液进入检测装置,所得样品干净,可以直接进行样品分析,省去了繁琐的样品前处理步骤;④微透析技术可以直接对ECF中的物质分析,与采血取样技术相比,药物在ECF中的浓度与其药理或毒理作用的相关性更大。
在微透析取样过程中,组织中物质在探针透析膜内外的分布处于一种动态平衡中,但是由于探针持续灌流的溶液,导致了药物在组织液和灌注液之间的扩散不能达到绝对的平衡,透析液中的药物含量只是ECF中的一部分,要低于探针外细胞间的待测物的浓度。因此,在应用微透析技术进行药物药动学研究之前必须要考察微透析探针对所研究药物的回收率。而探针回收率的准确校正是测定生物体中待测组分确切浓度的一个关键问题[10],回收率的高低受到探针型号、待测物质的性质、灌流液的性质、流速等很多因素的影响。目前,探针回收率的校正方法也有多种[11],包括零净流量法、反向透析法、外推至零流速法等。其中,反透析法是通过测定药物经过半透膜时的流失量即探针对药物的相对损失率(RL)来间接计算探针的回收率,该法与零净通量法都是进行体内探针校正十分准确可靠的方法,但反透析法相对更简单易行、省时[12]。应用反透析法校正微透析探针回收率的前提条件是探针的RR和RL相等,而探针对药物的相对回收率和相对损失率是否相等与药物本身的性质有关,反透析法并非适用于所有药物。本实验通过体外回收率的研究,验证了所使用的微透析探针回收率与浓度无关性,这是利用微透析技术测定细胞外液中药物真实浓度的前提条件;考察的结果表明TMP、FA的探针回收率与损失率具有一致性,验证了反透析法测定药物体内回收率的可行性及合理性,可以以此来推断组织中的实际药物浓度。
中药复方中药效成分多样,且理化性质各异,能否将微透析法用于复方的药动学研究,首先要确定各种不同成分探针回收率的矫正方法。本实验拟将微透析技术应用到中药复方药动学研究中,通过体内、外实验方法探讨使用微透析法进行中药复方药动学研究的可行性,确定了体内可通过反透析法进行FA、TMP的回收率测定。本文的研究结果为微透析法技术用于FA、TMP的体内药动学研究提供了实验依据和方法支持。
[1]晏亦林,叶 勇,周莉玲,等.磷酸川芎嗪微透析体外回收率的研究[J].中药新药与临床药理,2008,19(2):117-119.
[2]晏亦林,周莉玲.川芎嗪的研究概况[J].时珍国医国药,2008,19(6):1343-1345.
[3]赵锦卉,吴秀玲,张 春.阿魏酸钠对缺血预处理后大鼠脑缺血再灌注损伤的保护作用[J].中国医药指南,2009,7(12):186-187.
[4]周 琴,廖维靖,杨万同,等.阿魏酸钠促进局灶性脑缺血再灌注后神经功能恢复和血管生成作用的研究[J].中国康复医学杂志,2006,21(3):200-204.
[5]王利胜,袁爱贤,韩 坚,等.HPLC法测定川芎嗪在小鼠血浆、脑、肝中的含量[J].中国药房,2008,19(9):654-656.
[6]王利胜,郭 琦,韩 坚,等.川芎嗪在小鼠血、脑和肝中的药动学研究[J].中草药,2009,40(6):935-938.
[7]郭 琦,王利胜,石宗丰,等.芎冰微乳抗脑缺血再灌注损伤保护作用研究[J].中药新药与临床药理,2010,21(5):477-480.
[8]王 丹,石力夫,胡晋红.微透析技术探针回收率的影响因素研究进展[J].国际药学研究杂志,2008,35(4):261-266.
[9]韩 冬,班春林,崔黎丽,等.微透析技术及在药学中的应用进展[J].药学实践杂志,2005,23(3):139-142.
[10]Garrisona K E,Stephanie A P,Joshua D,et al.A review of membrane sampling from biological tissues with applications in pharmacokinetics,metabolism and pharmacodynamics[J].Eur J Pharm Sci,2002,17(1-2):1-12.
[11]Plock N,Kloft C.Microdialysis theoretical background and recent implementation in applied life-sciences[J].Eur J Pharm Sci,2005,25:1-24.
[12]Parsons L H,Smith A D,Justice J B.Thein vivomicrodialysis recovery of dopamine is altered independently of basal level by 6 hydroxydopamine lesions to nucleus accumbens[J].J Neurosci Meth,1991,40:31.

