牛磺酸对阿霉素所致大鼠心肌线粒体损伤的影响
张晓丹, 蔡瑞雪, 吕高照, 曲彩霞
(1.哈尔滨商业大学药学院,黑龙江哈尔滨 150076;2.哈尔滨市红十字医院,黑龙江哈尔滨 150076)
阿霉素(Adriamycin,Adr)是一种高效的广谱抗肿瘤药物,该药抗瘤谱广、疗效显著。自1970年用于临床治疗肿瘤以来[1],被认为是治疗实体肿瘤最有效的药物。但是因其严重的心脏毒性限制了它在临床上的应用[2-3]。研究表明,心肌线粒体是其主要的毒性靶点之一[4-7]。牛磺酸(Taurine,Tau)从发现至今已有160多年的历史,因1827年首次从牛胆汁中分离出而得名[8]。研究表明,Tau的抗脂质过氧化作用和膜稳定作用可保护线粒体膜免受脂质过氧化,保持线粒体膜的完整性,从而维持线粒体结构和功能的稳定[9]。心肌线粒体损伤是 Adr引起心脏毒性发生的主要标志,而Tau能否通过对心肌线粒体的影响而减缓 Adr引起的心脏毒性,目前还未报道。本实验旨在探讨Tau对Adr所致大鼠心肌线粒体损伤的影响。
1 材料与方法
1.1 材料
1.1.1 实验动物 Wistar大鼠,180~220g/只,共40只,由哈尔滨医科大学动物实验研究中心提供,动物合格证号为SCXK(京2007-0001)。
1.1.2 药品与试剂 Tau(上海生物化学试剂公司提供,纯度>99%);阿霉素由深圳万乐药业有限公司生产,批号H44024359;Rhodamine123购于美国Sigma公司,分析纯;其它试剂均为国产。
1.1.3 实验仪器 JEM2100CXⅡ透射电镜(日本电子公司);2100MP激光扫描共聚焦显微镜(德国Leica公司);Langendorff灌流系统(美国Radnoti公司);RF25210荧光分光光度计(日本岛津公司);低温高速离心机(德国Sigma公司)。
1.2 方法
1.2.1 动物分组与给药 健康Wistar大鼠40只,♀♂各半,随机分成5组,每组8只。(1)Adr组:于实验开始后第2、4天腹腔注射Adr 1 mg/kg,第6、8天腹腔注射 Adr 2 mg/kg,第10、12天腹腔注射Adr 3 mg/kg,第 14、16 天腹腔注射 Adr 4 mg/kg,16天累计用药剂量达 20 mg/kg[10-11]。(2)Adr+TauⅠ组:Tau 灌胃给药[12-13]灌胃给药 100 mg/(kg·d);(3)Adr+TauⅡ组:Tau灌胃给药200 mg/(kg·d);(4)Adr+TauⅢ组:Tau灌胃给药400 mg/(kg·d)。各组Tau于实验第一天起开始给药,每日灌胃1次,连续16 d,同时,Adr的给药时间、给药剂量、给药次数同Adr组。Tau灌胃给药是在腹腔注射Adr前30min;(5)阴性对照组:实验处理同Adr组,腹腔注射等剂量生理盐水。
1.2.2 心肌组织的电镜观察 大鼠处死后,迅速取出心脏,在心尖处取约1 cm3的心肌组织,用2.5%的戊二醛固定,再经漂洗、脱水、浸透、包埋、切片、染色后进行电镜观察。
1.2.3 心肌细胞Ca2+浓度的测定 动物脱臼处死,取出心脏,置预冷的50 mol/L Tris-HCl缓冲液冲洗,剪碎,制备匀浆,过滤,离心,弃上清,沉淀用缓冲液复溶后再次离心同前,所得沉淀用缓冲液调整蛋白浓度值为0.8 g/L,考马斯亮兰法测定膜悬液[14]蛋白浓度,新鲜即用。取稳定好的细胞,离心,去上清后,用无钙台氏液洗涤,然后用Fluo-3AM染色,终浓度为2 μg/mL,避光,在37℃恒温水浴中孵育0.5 h,离心,用KB液洗涤,将细胞稀释,放入200~300 μL的浴槽。将Fluo-3AM负载好的细胞在激光扫描共聚焦显微镜下扫描细胞内荧光强度,激发波长为488 nm,放射波长526 nm,其荧光值与[Ca2+]i正相关,即以荧光值(FI)变化表示[Ca2+]i变化。
1.2.4 心肌线粒体膜电位的测定
1.2.4.1 心肌线粒体的制备[15]将大鼠饥饿处理多于12 h以上,以去除心肌组织内的糖元和脂肪;断头处死大鼠,取下心脏,剥离瓣膜,挤去心脏中的血液,放于冷的蒸馏水中洗去血液;迅速浸入0℃的匀浆介质中(匀浆介质的成分mmol/L:甘露醇225,蔗糖75,EDTA 1和0.25%的牛血清白蛋白,pH 7.4)。用组织剪将心肌剪成米粒样大小,同时去除脂肪和结缔等组织。将剪碎的心肌和匀浆液倒入匀浆管中,在冰浴下进行匀浆,进行20 min,匀浆基本彻底。按照差速离心法分离线粒体。采用考马斯亮兰法测定线粒体蛋白含量,调整线粒体蛋白浓度为1 mg/mL。
1.2.4.2 膜电位的测定 参照文献[16]将反应介质(蔗糖150 mmol/L,氯化镁5 mmol/L,琥珀酸钠5 mmol/L,鱼藤酮 2.5 mmol/L,Hepes 20 mmol/L)加入到各组线粒体悬液中,浓度为26 μmol/L的Rhodanmine123,室温下反应5 min;Rh123的激发波长为503 nm,发射波长为527 nm的条件下测定荧光强度。
1.3 统计学处理 数据以均数±标准差表示,均数比较用单因素方差分析(one-way ANOVA),所有实验数据采用SPSS 16.0进行统计分析。P<0.05为差异显著,P<0.01为差异非常显著。
2 结果
2.1 Tau对心肌细胞超微结构的影响 见图1。从图中可见:A.阴性对照组:心肌细胞完整,肌原纤维排列整齐,心肌纤维纹理清晰。线粒体结构清晰,膜较完整,基质清楚。B.Adr组:肌原纤维排列紊乱,肌纤维断裂;线粒体肿胀出现空泡变,内腔扩大,膜模糊不清;嵴排列稀疏,有断裂,肌节消失。C.Adr+TauⅠ组:对心肌保护作用较小,线粒体肿胀轻微减轻,但仍有空泡变出现,嵴仍有改变。D.Adr+TauⅡ组:心肌纤维肿胀进一步减轻,仍有个别线粒体出现轻度肿胀,肌节断裂减少。E.Adr+TauⅢ组:心肌显微结构基本恢复正常,线粒体肿胀减轻,结构较完整,嵴排列较整齐、致密,基本接近阴性对照组。

图1 Tau对心肌细胞超微结构的影响Fig.1 Effects of Tau on ultrastructure of cardiac muscle cell in electron microscope
2.2 Tau对心肌细胞Ca2+含量及线粒体膜电位的影响 由表1可知:与阴性对照组相比,Adr组Ca2+浓度明显升高,TauⅢ组能使心肌细胞内Ca2+浓度明显下降(P<0.01),TauⅡ组能使心肌细胞内Ca2+浓度显著降低(P<0.05),TauⅠ组心肌细胞内Ca2+浓度明显升高(P<0.05)。说明TauⅢ组能降低心肌细胞内Ca2+浓度,缓解钙超载。而与阴性对照组相比,Adr组心肌线粒体膜电位显著下降(P<0.05);给予Tau可使线粒体膜电位升高,TauⅡ、Ⅲ组可明显升高心肌线粒体膜电位(P<0.05),提示Tau可明显减轻Adr所致的大鼠心肌线粒体损伤。
表1 Tau对心肌细胞Ca2+含量、线粒体膜电位的影响(n=8,±s)Tab.1 Effects of Tau on the[Ca2+]i and MMP of myocardial mitochondria(n=8,±s)
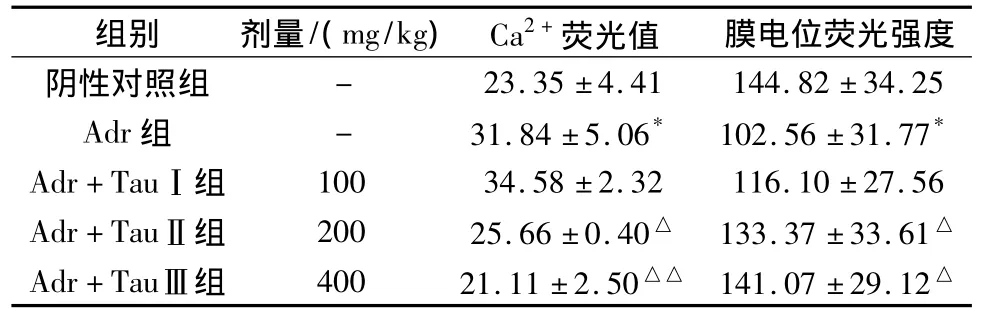
表1 Tau对心肌细胞Ca2+含量、线粒体膜电位的影响(n=8,±s)Tab.1 Effects of Tau on the[Ca2+]i and MMP of myocardial mitochondria(n=8,±s)
与阴性对照组比较*P<0.05,与Adr组比较△P<0.05,△△P<0.01。*P <0.05 **P <0.01 vs.Normal△P <0.05 △△P <0.01 vs.ADR group
组别 剂量/(mg/kg) Ca2+荧光值- 23.35±4.41 144.82±34.25 Adr组 - 31.84±5.06* 102.56±31.77*Adr+TauⅠ组 100 34.58±2.32 116.10±27.56 Adr+TauⅡ组 200 25.66±0.40△ 133.37±33.61△Adr+TauⅢ组 400 21.11±2.50△△ 141.07±29.12膜电位荧光强度阴性对照组△
3 讨论
自从1973年Lefrak首次报告了Adr心脏毒性,认为它比骨髓抑制作用、消化道和肾脏毒性等更为危险,由于心脏毒性而限制其作用。因此越来越多的学者就Adr引起的心脏毒性而进行了研究。研究认为,目前对Adr心肌毒性的机制尚未彻底清楚,可能包括自由基、钙超载、细胞凋亡和线粒体损伤等多因素共同作用的结果,多因素之间互相联系、互为因果,形成Adr心脏毒性的恶性网络,共同导致心脏毒性的发生和发展[17]。本实验就Adr可能产生的机制进行了研究,并从该机制着手,观察了Tau对Adr大鼠心脏毒性的影响。
Adr引起心脏毒性的可能机制有:钙超载和线粒体损伤。正常心肌细胞中Ca2+大部分储存于线粒体、肌浆网及肌膜上。Adr能破坏心肌细胞膜结构的完整性,影响膜的渗透性刺激线粒体和肌浆网,将Ca2+释放至胞质,加重 Ca2+超载[18]。线粒体在心肌细胞的能量代谢中起重要作用,其摄取Ca2+的速度很慢,但存储量很大,是调节细胞内Ca2+浓度的主要细胞器之一。研究表明Adr通过一种特异性的线粒体通透性转运阻滞剂环孢菌素A作用于钙释放通道而破坏线粒体内Ca2+的调节作用[19]。大量证据表明,在Adr引起的心脏毒性发病过程中,线粒体是主要靶向器官。Adr心脏毒性时产生大量氧自由基,线粒体发生脂质过氧化反应使线粒体受损,极容易发生线粒体功能障碍。Ca2+的蓄积与线粒体损伤,使其氧化磷酸化受到抑制,ATP生成减少。Adr还可使线粒体的NADH脱氢酶、细胞色素氧化酶、细胞色素还原酶及琥珀酸脱氢酶的活性降低,使其氧化磷酸化受到抑制,ATP生成障碍,严重影响心肌的收缩和舒张功能。
本实验结果显示,Adr组大鼠心肌细胞超微结构明显改变,表现为线粒体弥漫性肿胀,内腔扩大,空泡变。Adr可使心肌细胞内Ca2+浓度增加,加重钙超载,也可显著降低线粒体膜电位。说明Adr所致心脏毒性模型制备成功,提示线粒体损伤可能是阿霉素引起心脏毒性的主要机制。上述结果表明大剂量的Tau可改善Adr所致的大鼠心肌线粒体的病理改变,减轻钙超载,提高线粒体膜电位。说明Tau有可能是通过减缓钙超载及减轻线粒体损伤来防治Adr所致的心脏毒性。小剂量的Tau轻微的减轻线粒体损伤,但加重了钙超载,对心脏毒性并不能起有效的防治作用。
综上所述,大剂量Tau可以非常显著的改善线粒体损伤,钙超载及提高膜电位,且无毒副作用。同时本实验还证明了小剂量Tau不适用于防治Adr所致的心脏毒性。目前随着Adr在肿瘤治疗领域中具有不可替代的作用,其心脏毒性也越来越受到人们的重视。Tau能有效的防护心脑毒性[20],为临床应用Adr后的心肌保护性辅助用药提供了治疗策略。
[1]Wiliam P M.Prospective monitoring for ant hracycline cardiotoxicity:An intro-duction[J].Cancer Treat Rep,1978,62:855.
[2]Swain S M,Whaley F S,Ewer M S.Congestive heart failure in patients treated with doxorubicin:a retrospective analysis of three trials[J].Cancer,2003,97(11):2869-2879.
[3]洪建跃,赵不非,赵福弟.人参水提物对阿霉素所致大鼠心肌损伤的影响[J].北华大学学报:自然科学版,2008,9(2):135-137.
[4]Zhou S,Starkov A,Froberg M K,et al.Cumulative and irreversible cardiac mitochondrial dysfunction induced by doxorubicin[J].Cancer Res,2001,(61):771-777.
[5]Oliveira P J,Santos M S,Wallace K B.Doxorubicin-induced thiol-dependent alteration of cardiac mitochondrial permeability transition and respiration[J].Biochem(Mosc),2006,71(2):94-199.
[6]Green P S,Leeuwenburgh C.Mitochondrial dysfunction is an early indicator of doxorubicin-induced apoptosis [J].Biochim Biophys Acta,2002,1588(1):94-101.
[7]Childs A C,Phaneuf S L,Dirks A J,et al.Doxorubicin treatment in vivo causes cytochrome c release and cardiomyocyte apoptosis,as well as increased mitoch-ondrial efficiency,superoxide dismutase activity,and bcl-2:bax ratio[J].Cancer Res,2002,62:4592-4598.
[8]刘 莹,胡建民,富 亮.牛磺酸的性质及其生理功能[J].畜禽业,2006,(2):14-15.
[9]黄世文.牛磺酸对线粒体功能异常的积极影响[J].中国药物与临床,2008,8(6):429-431.
[10]周乐全,康亚丽,闫福曼,等.参附注射液保护阿霉素心肌毒性机理研究[J].辽宁中医药大学学报,2007,9(3):209-211.
[11]张晓丹,张婷姗,渠永清.蒺藜提取物对ADR所致大鼠心肌线粒体损伤的保护作用[J]. 中成药,2009,31(2):198-199.
[12]于 丹,王秀华.牛磺酸对阿霉素引起的心脏毒性的保护作用[J].中国社区医师,2008,10(9):8.
[13]张晓丹,渠永清,张婷姗.中药牛磺酸对DHF大鼠血流动力学和心肌细胞膜ATP酶的影响[J].中医药信息,2009,26(3):77-80.
[14]李沛清,王 燕,刘喜平,等.参参康心胶枣对缺血小鼠心肌线粒体损伤的保护作用[J].中医药学报,2007,35(1):19-21.
[15]Solem L E,Heller L J,Wallace K B.Dose-dependent increase in sensitivity to calcium-induced mitochondrial dysfunction and cardiomyocyte cell injury by doxorubicin[J].J Mol Cell Cardiol,1996,28:1023-1032.
[16]Ronald K E,Grunwald R,Lemasters J J.Rhodamine 123 as a probe of transm-embrane potential in isolated rat-liver mitochondria:spectral and metabolic properties[J].BBA,1986,850:4362448.
[17]何晓华,何并文,唐步坚.阿霉素心脏毒性的药物防护[J].中国癌症防治杂志,2010,2(1):60-63.
[18]Wallace KB.Adriamycin-induced interference with cardiac mitochondrial calcium homeostasis[J].Cardiovasc Toxicol,2007,7(2):101-107.
[19]余 薇,吴基良,汪 晖.阿霉素心脏毒性防治研究进展[J].咸宁学院学报:医学版,2008,22(4):351-354.
[20]尤丽菊.牛磺酸对受损心脑组织的保护作用[J].临床和实验医学杂志,2008,7(11):157-158.

