白芍对川楝子减毒作用机制研究
齐双岩, 金若敏, 梅彩霞, 周志兰, 崔金刚
(上海中医药大学药物安全评价研究中心上海 201203)
川楝子(Fructus Toosendan)是临床常用药,《中国药典》2010年版所载川楝子为楝科植物川楝Melia toosendanSieb.et Zucc.的干燥成熟果实,性苦味寒,有小毒,本课题前期实验研究发现,大鼠或小鼠口服大剂量的川楝子后可致肝损伤[1-2],其损伤机制与肝细胞的损伤、脂质过氧化、炎症反应有关[3-4],且川楝子批号不同毒性大小亦不同。根据中医药配伍理论,对川楝子的减毒配伍规律进行了初步研究,结果表明白芍对川楝子所致肝毒性的减毒效应较明显[5],为进一步明确白芍减毒效应的特点,本试验将对白芍减轻川楝子毒性的作用机制展开研究,希望能探索出中药复方配伍减毒的新的研究思路和研究方法,为中医药配伍理论和中药复方的安全应用提供实验依据。
1 实验材料
1.1 试验动物
SD大鼠,♀♂各半,体重160~180 g,清洁级,由上海必凯动物有限公司提供,动物质量合格证号SCXK(沪)2003-2002,饲养于上海中医药大学实验动物中心。
1.2 主要试剂
TNF-α(货号 RY10019)、IL-6(货号 RY10029)由RnD公司提供;即用型SABC免疫组化染色试剂盒、ICAM-1(CD54)一抗、NF-κB 一抗、DBA 显色试剂盒均由武汉博士德生物工程有限公司提供;兔抗bcl-2抗体由 Cell Signaling Technology公司提供,兔抗caspase-3抗体由BD Biosciences Pharmingen公司提供,兔抗 β-actin抗体、羊抗兔由 IgG/HRP,Abcam公司提供,ECL发光试剂盒由SANTA CRUZE公司提供。
2 方法
2.1 药材制备
川楝子(批号 060825,070615),白芍(批号061121),购于上海养和堂张江分店,经上海中医药大学中药学院赵志礼教授鉴定。
药材制备方法(水提醇沉):将药物粉碎至颗粒状,水煎3次,每次先以武火煮沸,再以文火煮30 min,过滤,合并3次药液,加“体积分数为0.95的乙醇”至浓度为70%,4℃冰箱放置过夜,滤去沉淀,回收乙醇,将上述水提醇沉液浓缩至浓度为10 g/mL,HPLC法测定含川楝素6.075×10-4g/g生药。药液置4℃冰箱,避光保存备用。临用前,用蒸馏水分别配成所需浓度的溶液。川楝子配伍白芍(根据白芍的临床常用剂量及预试验筛选的减毒最佳剂量确定白芍的使用剂量)的提取药液简称“川白”。
2.2 试验方法
取大鼠随机分成3组,分别为正常组、川楝子组及川白组,每组10只,♀♂各半。灌胃1次,容积为3 mL/100g。给药组分别灌服川楝子(150 g生药/kg)或川白(157.5 g生药/kg),正常组给予等容积的蒸馏水。大鼠于给药或水后2 h处理,处理前禁食不禁水过夜,各组大鼠称体重,腹腔注射25%乌来糖麻醉,摘取各组大鼠肝脏,取1份肝组织,置于10%中性福尔马林溶液中固定;令取2份肝组织置于DEPC处理过的离心管,迅速放入液氮中快速冷冻,而后转入超低温冰箱保存。
2.2.1 双抗体夹心 ABC-ELISA法检测肝组织TNF-α、IL-6[6-7]取正常、川楝子及川白组大鼠肝组织各0.2 g,每组6只,分别用冷生理盐水洗去污血,加冷0.9%生理盐水2 mL制成10%肝匀浆。3 000 r/min离心10 min,取上清液1.5 mL备用。
采用双抗体夹心ABC-ELISA法。用抗大鼠肿瘤坏死因子(TNF-α)或IL-6单抗包被于酶标板上,标准品和样品中的TNF-α或IL-6与单抗结合,加入生物素化的抗大鼠TNF-α或IL-6抗体,形成免疫复合物连接在板上,辣根过氧化物酶标记的Streptavidin与生物素结合,加入酶底物OPD,出现黄色,加终止液硫酸,颜色变深,在492nm处测OD值,TNF-α或IL-6浓度与OD值成正比,可通过绘制标准曲线求出标本中TNF-α或IL-6浓度。
2.2.2 免疫组化SABC法检测大鼠肝组织NF-κB、ICAM-1 蛋白表达[8-10]取正常、川楝子及川白组中性福尔马林固定的大鼠肝组织,每组6只,以APES处理载玻片,按常规进行脱水、透明、浸蜡、包埋、切片,厚度为5 μm。切片60℃恒温箱中烘烤2 h。常规脱蜡、脱水。采用免疫组织化学SABC法染色,具体操作步骤参照试剂盒说明书。
结果判断:NF-κB免疫组化染色以细胞质和(或)细胞核内出现黄色或棕黄色颗粒为阳性表达;ICAM-1免疫组化染色以细胞膜和细胞胞浆内呈现黄色或棕黄色颗粒为阳性表达。光镜下,任选取1个高倍视野(×400)拍片,Image-Pro-Plus 4.0 图像分析软件对每张组织片上NF-κB及 ICAM-1蛋白进行定量分析,结果以累积光密度值(IOD)表示。
2.2.3 Western-Blot法检测肝组织 caspase-3、bcl-2蛋白表达[11]将少量肝组织置于匀浆器中,加含PMSF的裂解液,在4℃条件下匀浆,裂解30 min后,离心(4℃,12 000 r/min 5min),取上清液。经电泳分离后,在4℃条件下,将蛋白从胶上转移至NC膜上。用10%脱脂奶粉封闭37℃,2 h,PBS洗膜3次;与稀释于10%脱脂奶粉中的抗体(抗 bcl-2,抗caspase3,抗β-actin)4℃孵育过夜,PBST洗膜3次;与稀释于10%脱脂奶粉中的羊抗兔IgG/HRP室温孵育1 h,PBST洗涤3次。等量混合ECL显色系统的A液+B液,滴加至NC膜表面,X-ray胶片感光。
2.3 统计方法
应用SPSS13.0统计软件。计量资料采用“均数±标准差(±s)”表示,两组间比较采用t检验,多组间比较采用单因素方差法,组间两两比较方差齐性时用LSD方法分析,方差不齐时用Dunnett’s方法分析。
3 结果
3.1 对大鼠肝组织TNF-α、IL-6的影响
大鼠给予川楝子以后,肝组织 TNF-α、IL-6水平显著提高,白芍与川楝子配伍后能够对抗肝组织TNF-α、IL-6水平的提高,与川楝子组比较有显著性差异(P<0.05或P<0.01),白芍显示了一定的减毒作用。结果见表1。
表1 白芍配伍川楝子对大鼠肝组织TNF-α、IL-6的影响(±s)
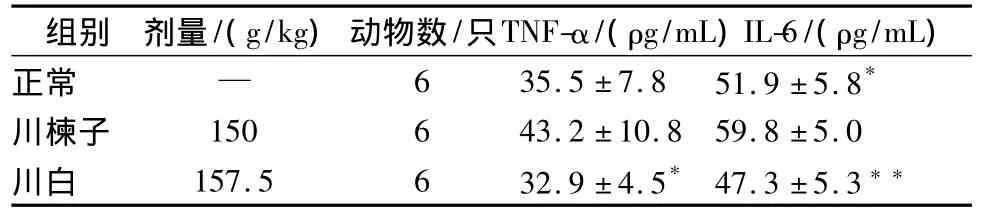
表1 白芍配伍川楝子对大鼠肝组织TNF-α、IL-6的影响(±s)
注:与川楝子组比较,*P <0.05,**P <0.01。
组别 剂量/(g/kg) 动物数/只TNF-α/(ρg/mL)IL-6/(ρg/mL)正常 — 6 35.5±7.8 51.9±5.8*川楝子 150 6 43.2±10.8 59.8±5.0川白 157.5 6 32.9±4.5* 47.3±5.3**
3.2 对大鼠肝组织NF-κB、ICAM-1蛋白表达的影响
大鼠给予川楝子以后,NF-κB、ICAM-1 蛋白表达显著增强,与正常组比较有极显著性差异(P<0.01);白芍与川楝子配伍后能够对抗肝组织NF-κB、ICAM-1蛋白表达的增强,与川楝子组比较有极显著性差异(P<0.01),表明白芍有一定的减毒作用。结果见表2。

表2 白芍配伍川楝子对大鼠肝组织NF-κB、ICAM-1蛋白表达的影响(¯x ±s)
3.3 对肝组织 caspase-3、bcl-2 蛋白表达的影响
大鼠给予川楝子以后,与正常组比较,caspase-3蛋白表达明显增加,bcl-2蛋白表达明显下降;白芍与川楝子配伍后能够对抗肝组织caspase-3蛋白表达的上调和bcl-2蛋白表达的下调,表明白芍有一定的减毒作用。
4 讨论
肝主疏泄,性喜条达而恶抑郁,多用疏散肝气的药物,但此类药物多升散,用之不当则耗散肝之阴血,故养肝柔肝为治肝之必需。白芍既能养肝阴,也能补肝血,更是柔肝之要品,切中肝阴易虚的病理特点,也与肝喜柔和的生理特点最为合拍。柔肝养肝即顺应了“肝喜柔和”的生理特性,也防止或纠正了肝阴不足的病理变化。本实验的川楝子与白芍,取其功用相近之相须相使的配伍关系,来验证中医学通过配伍以制毒纠偏的可行性与科学性,探索白芍减轻川楝子所致肝毒性的可能机制,为探索中药配伍减毒系统提供实验研究思路和方法。
本课题前期研究结果表明,大剂量川楝子可导致肝细胞损伤,肝细胞急性坏死是川楝子肝损害的主要形式[1-4]。在川楝子导致细胞坏死的通路中,抗氧化活性物质(SOD、GSH-Px)含量的降低、过氧化产物(MDA)及炎症因子(NF-κB、ICAM-1、TNF-α)含量的增多从中起到了重要的作用,进而推测氧化应激和炎症反应是川楝子致肝细胞损伤的重要机制;白芍与川楝子配伍应用后,能够对抗川楝子导致的炎症因子表达的增强,并从基因水平上抑制了肝细胞坏死的发生,表明白芍的减毒机制与对抗川楝子导致的炎症反应及调节抗-促凋亡基因的表达有关。
[1]熊彦红,齐双岩,金若敏,等.川楝子对大鼠肝毒性的时效和量效关系研究[J]. 江苏中医药,2008,40(7):83-85.
[2]齐双岩,熊彦红,金若敏,等.川楝子对小鼠肝毒性的时效和量效关系研究[J]. 时珍国医国药,2008,19(11):2694-2696.
[3]齐双岩,金若敏,刘红杰,等.川楝子致大鼠肝毒性机制研究[J]. 中国中药杂志,2008,16:2045-2047.
[4]齐双岩,谷颖敏,金若敏,等.川楝子对大鼠肝组织超微结构和原代培养肝细胞的影响[J].中国中药杂志,2009,34(22):2966-2968.
[5]齐双岩,金若敏,梅彩霞,等.川楝子减毒配伍规律初探[J].四川中医,2009,27(2):9-11.
[6]王 蕾,刘清泉,朱雪琦,等.参附黄注射液对脓毒症大鼠组织和血浆致炎因子TNF-α水平的影响[J].中国中医药信息杂志,2006,13(8):23-25.
[7]刘建华,娄树航,刘正玲.慢性肝病患者血清HA、LN、TNF-、及IL-6 的水平变化及意义[J].社区医学杂志,2006,4(5):45-46.
[8]刘 琳,严新民,华映昆,等.血清 IL-6、TNFα、sICAM-1与肝细胞损伤的相关性观察[J].现代检验医学杂志,2003,18:54-55.
[9]Liu SL,Degli Esposti S,Yao T,et al.Vitamin E therapy of acute CCl4-induced hepatic injury in mice is associated with inhibition of nuclear factor kappa B binding[J].Hepatology,1995,22:1474-1481.
[10]郭顺根,江 涛,张 玮,等.中药复方保肝作用的组织化学、免疫组织化学研究[J].中国组织化学与细胞化学杂志,2004,13:269-274.
[11]卓蕴慧,陈建杰,王灵台.清开颗粒对急性肝衰竭小鼠肝细胞凋亡和Caspase-3表达的影响[J].上海中医药大学学报,2007,21:56-58.

